第一单元 分子构型与物质的性质 分子的空间构型第一课时
文档属性
| 名称 | 第一单元 分子构型与物质的性质 分子的空间构型第一课时 |

|
|
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-10 00:00:00 | ||
图片预览



文档简介
课件19张PPT。 组织建设化学 · 选修 3《物质结构与性质》第二节 分子的立体构型
(第一课时)
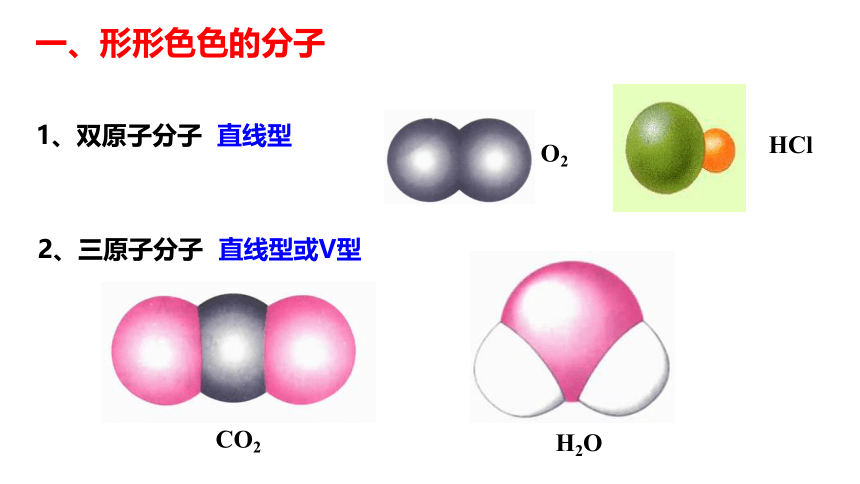
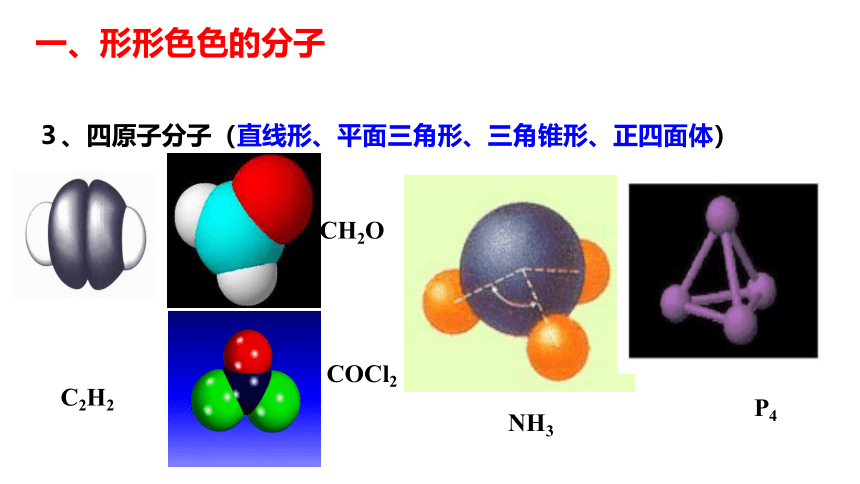
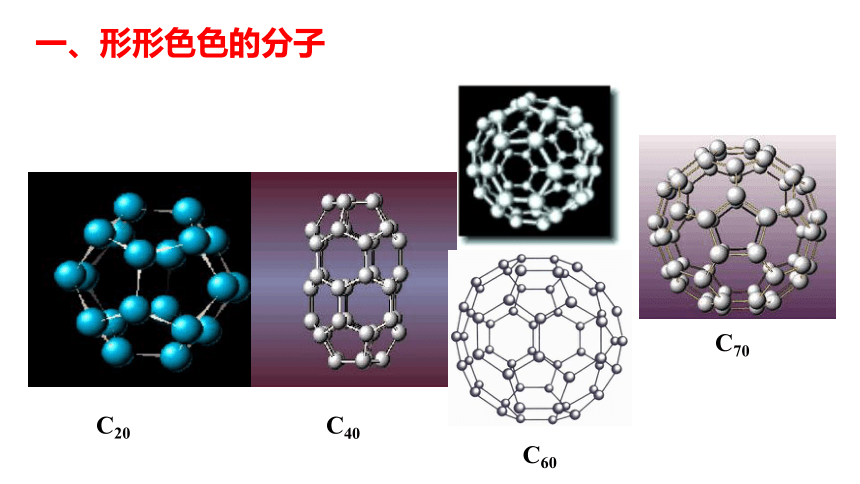
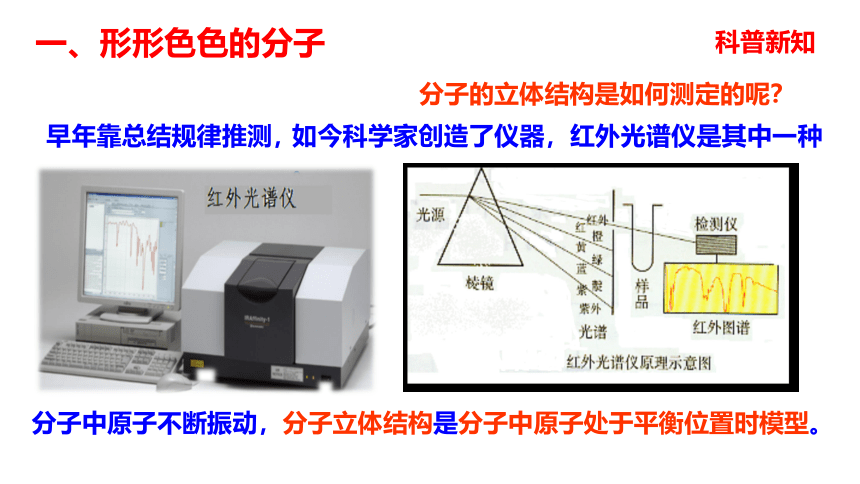
一、形形色色的分子1、双原子分子 直线型2、三原子分子 直线型或V型一、形形色色的分子3、四原子分子(直线形、平面三角形、三角锥形、正四面体)C2H2CH2ONH3COCl2P44、五原子分子正四面体5、其他CH3CH2OHCH3COOHC6H6C8H8CH3OH一、形形色色的分子C60C20C40C70一、形形色色的分子科普新知分子的立体结构是如何测定的呢?分子中原子不断振动,分子立体结构是分子中原子处于平衡位置时模型。早年靠总结规律推测,如今科学家创造了仪器,红外光谱仪是其中一种。一、形形色色的分子 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考: 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因? 为了探究其原因,发展了许多结构理论。有一种十分简单的理论叫做价层电子对互斥理论,这种简单的理论可以用来预测分子的立体结构。?二、价层电子对互斥理论 分子(或离子)中的中心原子周围的价电子对的几何构型,主要取决于价电子对数(z),价电子对尽量远离,使它们之间斥力最小,能量最低,物质最稳定。σ键电子对和孤对电子对VSEPR模型:价层电子对数目 2 3 4 二、价层电子对互斥理论2、价层电子对数的计算(1)确定中心原子(2)确定中心原子的价电子数,用字母a表示(3)确定与中心原子形成共价键的原子最多可以接受的电子的个数,用字母b表示。(4)确定σ键的电子对数,用字母x表示(5)确定孤对电子数,用字母m表示,m=1/2(a-bx)(6)确定中心原子的价电子对数,用字母z表示,z=m+x二、价层电子对互斥理论C42202直线形OBNC63541111233410024434四面体形平面三角形四面体形四面体形2、价层电子对数的计算二、价层电子对互斥理论3、预测分子的立体构型中心原子无孤对电子时:
VSEPR模型就是其分子立体结构有孤对电子时:
先得VSEPR模型,后略去孤对电子,
剩下是分子立体结构二、价层电子对互斥理论3、预测分子的立体构型404314224四面体形四面体形四面体形正四面体形三角锥形V形思考与交流?离子的立体构型该如何判断呢二、价层电子对互斥理论4、 离子立体构型的判断 阳离子中
a=中心原子的价电子数-阳离子所带电荷数 阴离子中
b=中心原子的价电子数+阴离子所带电荷数二、价层电子对互斥理论4、 离子立体构型的判断四面体形四面体形平面三角形三角锥形正四面体形COOO平面三角形O5C31414024286S303你学到了什么呢?本堂小结当堂巩固1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是 形。
2 、下列分子或离子中,不含有孤对电子的是 ( )
A、H2O、 B、H3O+、 C、NH3、 D、NH4+ 直线V平面三角三角锥D正四面体3、用价层电子对互斥模型判断SO3的分子构型是( )
A、正四面体形 B、V形 C、三角锥形 D、平面三角形D4、下列分子①BCl3、②CCl4、③CS2中,其键角由小到大的顺序为 ( ) ②① ③ 5、下列物质中分子立体结构与水分子相似的是( )
A.CO2 B.H2S
C.PCl3 D.SiCl4
6、下列分子立体结构其中属于直线型分子的是( )
A.H2O B.CO2
C.C2H2 D.P4
B BC 再 见!
(第一课时)
一、形形色色的分子1、双原子分子 直线型2、三原子分子 直线型或V型一、形形色色的分子3、四原子分子(直线形、平面三角形、三角锥形、正四面体)C2H2CH2ONH3COCl2P44、五原子分子正四面体5、其他CH3CH2OHCH3COOHC6H6C8H8CH3OH一、形形色色的分子C60C20C40C70一、形形色色的分子科普新知分子的立体结构是如何测定的呢?分子中原子不断振动,分子立体结构是分子中原子处于平衡位置时模型。早年靠总结规律推测,如今科学家创造了仪器,红外光谱仪是其中一种。一、形形色色的分子 同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?思考: 同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因? 为了探究其原因,发展了许多结构理论。有一种十分简单的理论叫做价层电子对互斥理论,这种简单的理论可以用来预测分子的立体结构。?二、价层电子对互斥理论 分子(或离子)中的中心原子周围的价电子对的几何构型,主要取决于价电子对数(z),价电子对尽量远离,使它们之间斥力最小,能量最低,物质最稳定。σ键电子对和孤对电子对VSEPR模型:价层电子对数目 2 3 4 二、价层电子对互斥理论2、价层电子对数的计算(1)确定中心原子(2)确定中心原子的价电子数,用字母a表示(3)确定与中心原子形成共价键的原子最多可以接受的电子的个数,用字母b表示。(4)确定σ键的电子对数,用字母x表示(5)确定孤对电子数,用字母m表示,m=1/2(a-bx)(6)确定中心原子的价电子对数,用字母z表示,z=m+x二、价层电子对互斥理论C42202直线形OBNC63541111233410024434四面体形平面三角形四面体形四面体形2、价层电子对数的计算二、价层电子对互斥理论3、预测分子的立体构型中心原子无孤对电子时:
VSEPR模型就是其分子立体结构有孤对电子时:
先得VSEPR模型,后略去孤对电子,
剩下是分子立体结构二、价层电子对互斥理论3、预测分子的立体构型404314224四面体形四面体形四面体形正四面体形三角锥形V形思考与交流?离子的立体构型该如何判断呢二、价层电子对互斥理论4、 离子立体构型的判断 阳离子中
a=中心原子的价电子数-阳离子所带电荷数 阴离子中
b=中心原子的价电子数+阴离子所带电荷数二、价层电子对互斥理论4、 离子立体构型的判断四面体形四面体形平面三角形三角锥形正四面体形COOO平面三角形O5C31414024286S303你学到了什么呢?本堂小结当堂巩固1、多原子分子的立体结构有多种,三原子分子的立体结构有___ 形和 形,大多数四原子分子采取 形和 ___ 形两种立体结构,五原子分子的立体结构中最常见的是 形。
2 、下列分子或离子中,不含有孤对电子的是 ( )
A、H2O、 B、H3O+、 C、NH3、 D、NH4+ 直线V平面三角三角锥D正四面体3、用价层电子对互斥模型判断SO3的分子构型是( )
A、正四面体形 B、V形 C、三角锥形 D、平面三角形D4、下列分子①BCl3、②CCl4、③CS2中,其键角由小到大的顺序为 ( ) ②① ③ 5、下列物质中分子立体结构与水分子相似的是( )
A.CO2 B.H2S
C.PCl3 D.SiCl4
6、下列分子立体结构其中属于直线型分子的是( )
A.H2O B.CO2
C.C2H2 D.P4
B BC 再 见!
