第一单元 分子构型与物质的性质 第一课时课件28张PPT
文档属性
| 名称 | 第一单元 分子构型与物质的性质 第一课时课件28张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-10 00:00:00 | ||
图片预览

文档简介
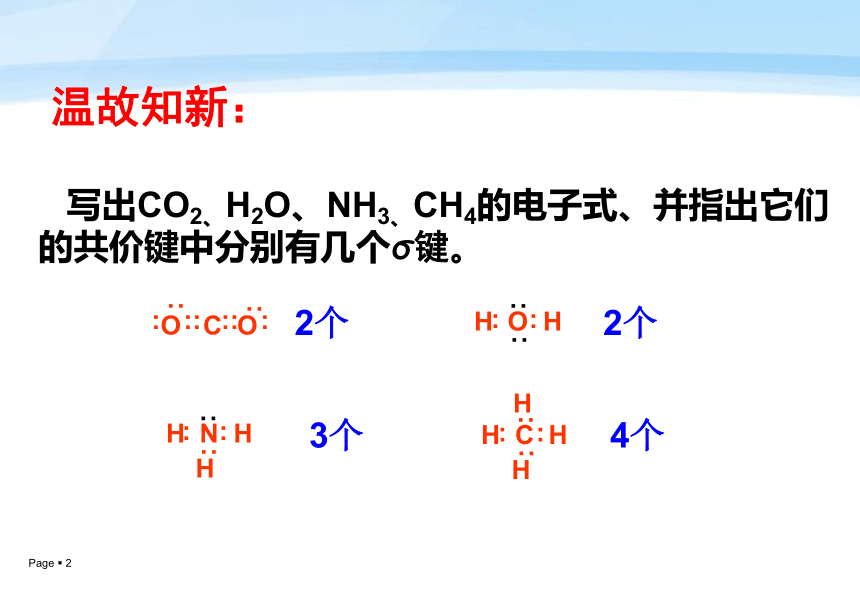
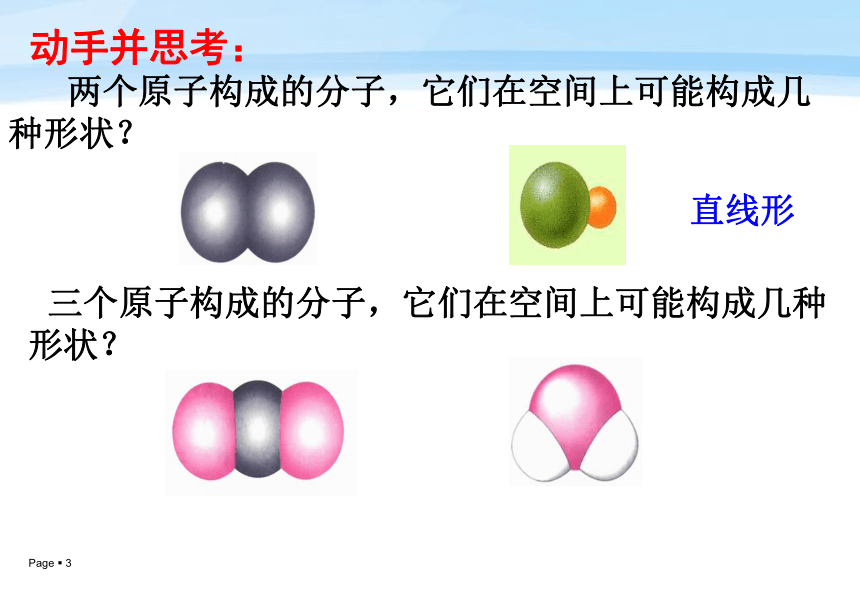
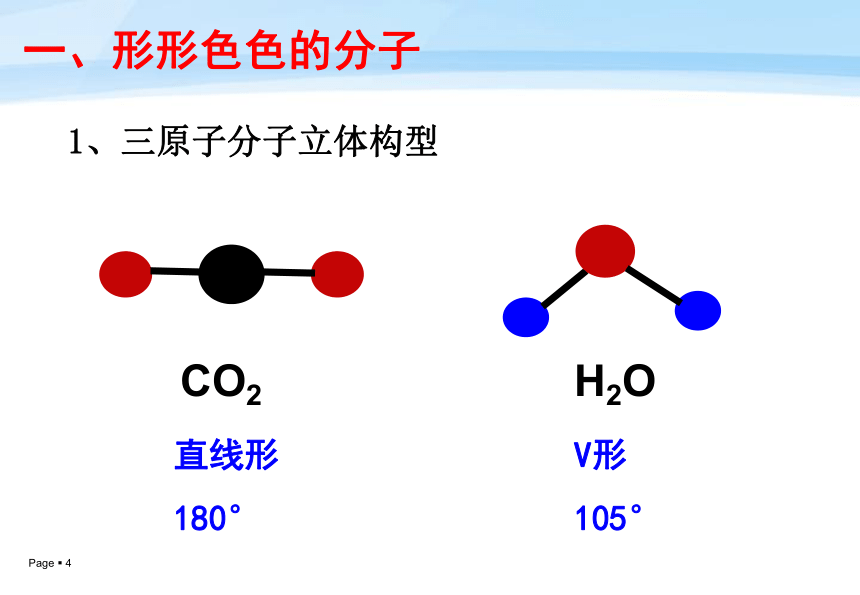
课件28张PPT。第一课时——价层电子对互斥理论第二节分子的立体构型温故知新: 写出CO2、H2O、NH3、CH4的电子式、并指出它们的共价键中分别有几个σ键。动手并思考: 两个原子构成的分子,它们在空间上可能构成几种形状?直线形 三个原子构成的分子,它们在空间上可能构成几种形状?一、形形色色的分子H2OCO2 1、三原子分子立体构型直线形
180°V形
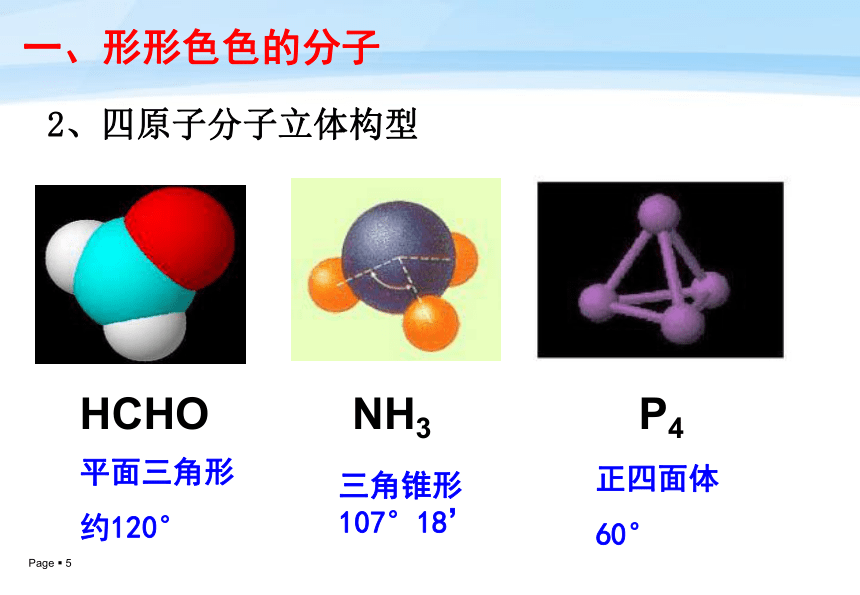
105°一、形形色色的分子 2、四原子分子立体构型HCHONH3平面三角形
约120°三角锥形
107°18’P4正四面体
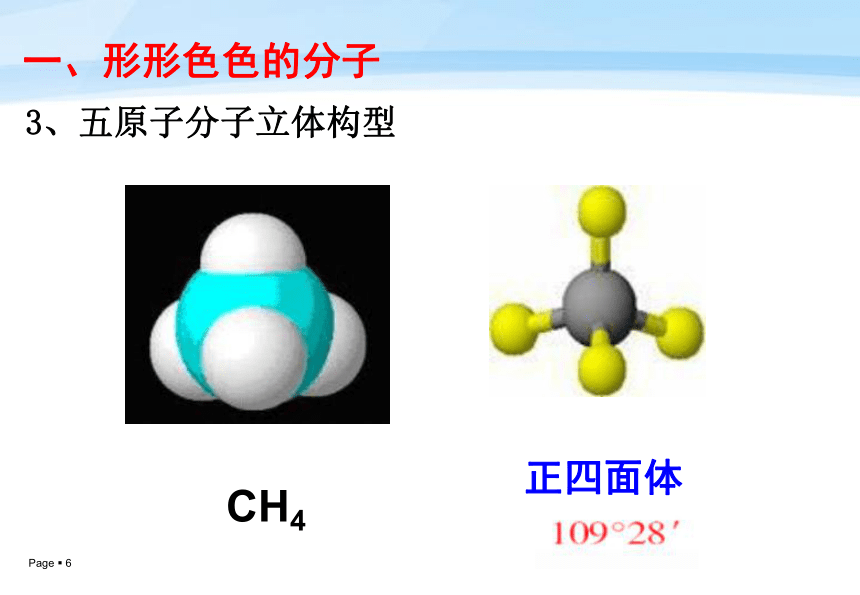
60°3、五原子分子立体构型一、形形色色的分子CH4正四面体
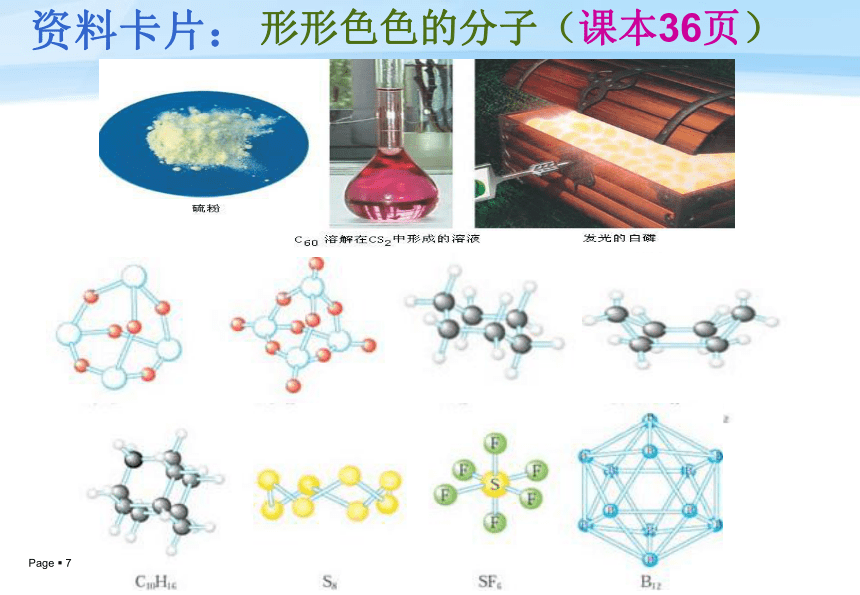
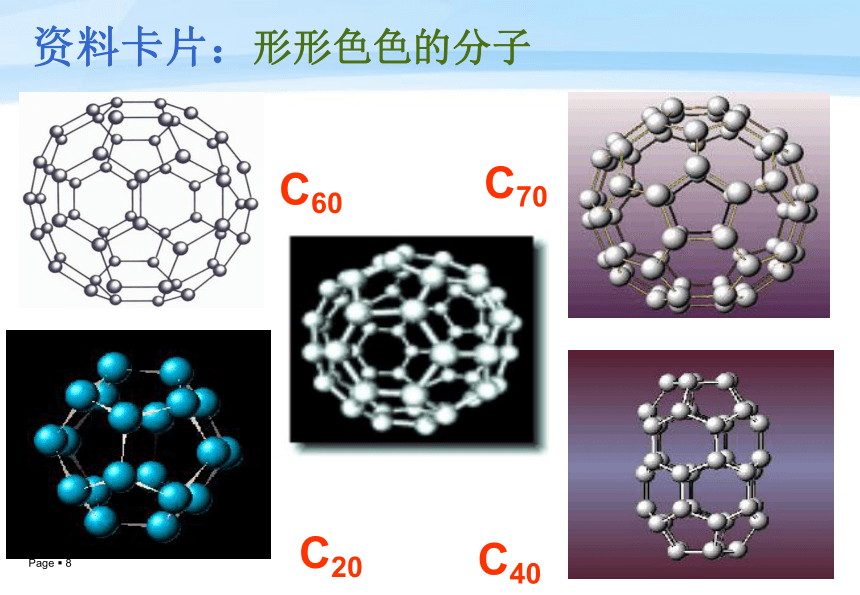
资料卡片:形形色色的分子(课本36页)C60C20C40C70资料卡片:形形色色的分子测分子的立体构型:红外光谱仪→吸收峰→分析。
课本37页科学视野分子结构又是怎么测定的呢? 观察并思考 二、价层电子对互斥理论(VSEPR)1.价层电子对(分子中中心原子上的电子对)H2ONH3CO2CH42342224314404202 价层电子对数=σ键电子对数+中心原子上的孤电子对数
σ键电子对数 = 与中心原子结合的原子(配位原子)数 孤电子对数=?(a-xb)2.中心原子上的孤电子对数计算方法:
中心原子A的价电子数
与中心原子结合的原子B最多能接受的电子数对于阳离子:a为中心原子的价电子数减去离子所带的电荷数;对于阴离子:a为中心原子的价电子数加上离子所带的电荷数)ABX中X:与中心原子结合的原子数。 6 15-1=4 0 4+2=6 0224132孤电子对数 =?(a-xb)(表2-4)343价层电子对数二、价层电子对互斥理论3.内容对ABx型的分子或离子,中心原子A价层电子对之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使分子体系能量最低,最稳定。排斥力最小
σ键电子对和孤电子对
4.价层电子对互斥模型即VSEPR模型
价层电子对数目m与VSEPR模型的关系m=2 m=3 m=4 孤电子对四面体V形VSEPR模型的应用
-------推测H2O分子的立体构型价层电子对数:4
孤电子对数:2H2O的VSEPR模型H2O的立体构型价层电子对间斥力大小:孤对-孤对>孤对-键对>键对-键对105°判断分子立体构型方法:价层电子对数VSEPR模型略去孤电子对分子(离子)的立体构型 中心原子上无孤电子对的分子,VSEPR模型就是其分子的立体构型。 中心原子上存在孤电子对的分子,VSEPR模型略去孤电子对在模型中占有的空间,剩下的就是分子的立体构型。注意:二、价层电子对互斥理论5.价层电子对互斥模型即VSEPR模型应用4401正四面体正四面体四面体三角锥形233001直线形直线形平面三角形平面三角形V形平面三角形5. 用VSEPR模型确定分子的立体构型正四面体思考与交流(课本第39页)1043立体构型三角锥形平面三角形 正四面体04平面三角形四面体确定SO32-、BF3、NH4+的VSEPR模型和它们的立体构型。直线形平面三角形正四面体V 形三角锥形规律:常见ABx型分子的立体构型课堂小结一、形形色色的分子:二、价层电子对互斥理论: 1.价层电子对(分子中中心原子上的电子对) 2.中心原子上的孤电子对数计算 3.价层电子对互斥理论内容5.VSEPR模型的应用:推测分子的立体构型4.价层电子对互斥模型即VSEPR模型
1.若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,下列说法正确的是( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确C基础训练3.用价层电子对互斥模型判断ClO3-的分子的立体构型为( )
A、正四面体形 B、V形
C、三角锥形 D、平面三角形DC2.下列分子或离子中,不含孤电子对的是( )
A、H2S B、H3O+ C、NH3 D、SO34.以下分子或离子的结构为正四面体,且键角为109°28′ 的是( )
①CCl4 ②ClO4- ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④
C、①②⑤ D、①④⑤C能力提升5.下列物质中,分子的立体结构与NH3分子相似的是( )
A.BeCl2 B.BCl3 C.PO43- D.PCl3
D1.2012年辽宁高考理综37题:
(4).气态SeO3分子的立体构型为 ;S032-离子的立体构型为 。
2.2011年辽宁高考理综37题:
(3).BF4-离子的立体构型为 。 高考链接平面三角形三角锥形正四面体3.2010年辽宁高考理综37题:
(1).W3(O3)分子的立体构型为 。 V形谢谢!
180°V形
105°一、形形色色的分子 2、四原子分子立体构型HCHONH3平面三角形
约120°三角锥形
107°18’P4正四面体
60°3、五原子分子立体构型一、形形色色的分子CH4正四面体
资料卡片:形形色色的分子(课本36页)C60C20C40C70资料卡片:形形色色的分子测分子的立体构型:红外光谱仪→吸收峰→分析。
课本37页科学视野分子结构又是怎么测定的呢? 观察并思考 二、价层电子对互斥理论(VSEPR)1.价层电子对(分子中中心原子上的电子对)H2ONH3CO2CH42342224314404202 价层电子对数=σ键电子对数+中心原子上的孤电子对数
σ键电子对数 = 与中心原子结合的原子(配位原子)数 孤电子对数=?(a-xb)2.中心原子上的孤电子对数计算方法:
中心原子A的价电子数
与中心原子结合的原子B最多能接受的电子数对于阳离子:a为中心原子的价电子数减去离子所带的电荷数;对于阴离子:a为中心原子的价电子数加上离子所带的电荷数)ABX中X:与中心原子结合的原子数。 6 15-1=4 0 4+2=6 0224132孤电子对数 =?(a-xb)(表2-4)343价层电子对数二、价层电子对互斥理论3.内容对ABx型的分子或离子,中心原子A价层电子对之间由于存在排斥力,将使分子的几何构型总是采取电子对相互排斥最小的那种构型,以使分子体系能量最低,最稳定。排斥力最小
σ键电子对和孤电子对
4.价层电子对互斥模型即VSEPR模型
价层电子对数目m与VSEPR模型的关系m=2 m=3 m=4 孤电子对四面体V形VSEPR模型的应用
-------推测H2O分子的立体构型价层电子对数:4
孤电子对数:2H2O的VSEPR模型H2O的立体构型价层电子对间斥力大小:孤对-孤对>孤对-键对>键对-键对105°判断分子立体构型方法:价层电子对数VSEPR模型略去孤电子对分子(离子)的立体构型 中心原子上无孤电子对的分子,VSEPR模型就是其分子的立体构型。 中心原子上存在孤电子对的分子,VSEPR模型略去孤电子对在模型中占有的空间,剩下的就是分子的立体构型。注意:二、价层电子对互斥理论5.价层电子对互斥模型即VSEPR模型应用4401正四面体正四面体四面体三角锥形233001直线形直线形平面三角形平面三角形V形平面三角形5. 用VSEPR模型确定分子的立体构型正四面体思考与交流(课本第39页)1043立体构型三角锥形平面三角形 正四面体04平面三角形四面体确定SO32-、BF3、NH4+的VSEPR模型和它们的立体构型。直线形平面三角形正四面体V 形三角锥形规律:常见ABx型分子的立体构型课堂小结一、形形色色的分子:二、价层电子对互斥理论: 1.价层电子对(分子中中心原子上的电子对) 2.中心原子上的孤电子对数计算 3.价层电子对互斥理论内容5.VSEPR模型的应用:推测分子的立体构型4.价层电子对互斥模型即VSEPR模型
1.若ABn型分子的中心原子A上没有未用于形成共价键的孤电子对,运用价层电子对互斥模型,下列说法正确的是( )
A.若n=2,则分子的立体构型为V形
B.若n=3,则分子的立体构型为三角锥形
C.若n=4,则分子的立体构型为正四面体形
D.以上说法都不正确C基础训练3.用价层电子对互斥模型判断ClO3-的分子的立体构型为( )
A、正四面体形 B、V形
C、三角锥形 D、平面三角形DC2.下列分子或离子中,不含孤电子对的是( )
A、H2S B、H3O+ C、NH3 D、SO34.以下分子或离子的结构为正四面体,且键角为109°28′ 的是( )
①CCl4 ②ClO4- ③CH3Cl ④P4 ⑤SO42-
A、①②③ B、①②④
C、①②⑤ D、①④⑤C能力提升5.下列物质中,分子的立体结构与NH3分子相似的是( )
A.BeCl2 B.BCl3 C.PO43- D.PCl3
D1.2012年辽宁高考理综37题:
(4).气态SeO3分子的立体构型为 ;S032-离子的立体构型为 。
2.2011年辽宁高考理综37题:
(3).BF4-离子的立体构型为 。 高考链接平面三角形三角锥形正四面体3.2010年辽宁高考理综37题:
(1).W3(O3)分子的立体构型为 。 V形谢谢!
