课题3 溶液的浓度 (第1课时)(16张PPT)
文档属性
| 名称 | 课题3 溶液的浓度 (第1课时)(16张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 746.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-09 17:53:25 | ||
图片预览




文档简介
(共16张PPT)
课题3:溶质的质量分数(一)
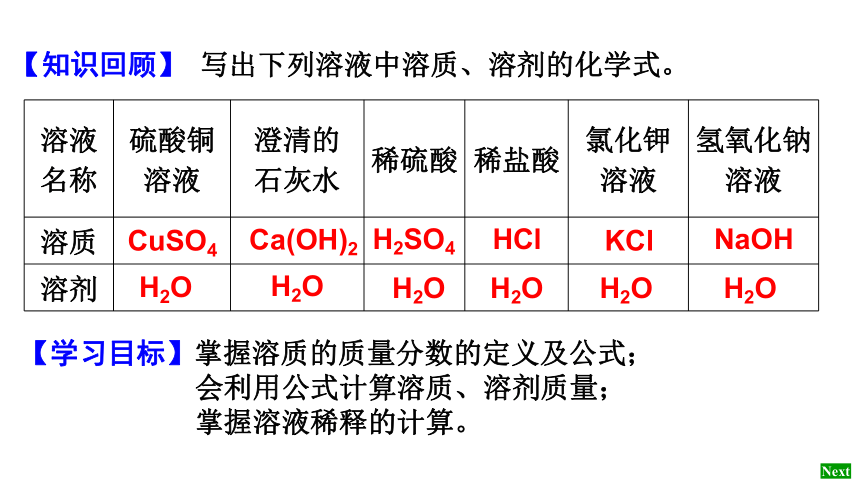
溶液名称 硫酸铜溶液 澄清的
石灰水 稀硫酸 稀盐酸 氯化钾溶液 氢氧化钠溶液
溶质
溶剂
【知识回顾】 写出下列溶液中溶质、溶剂的化学式。
【学习目标】掌握溶质的质量分数的定义及公式;
会利用公式计算溶质、溶剂质量;
掌握溶液稀释的计算。
CuSO4
Ca(OH)2
H2SO4
HCl
KCl
NaOH
H2O
H2O
H2O
H2O
H2O
H2O
Next
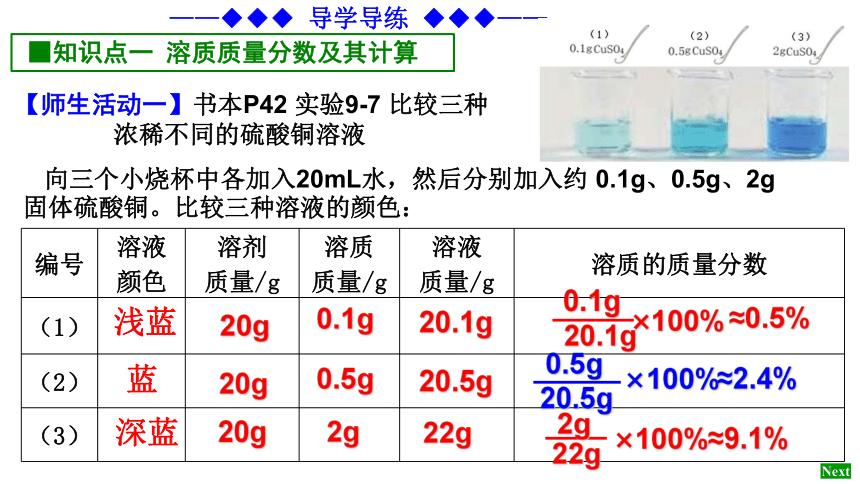
编号 溶液
颜色 溶剂
质量/g 溶质
质量/g 溶液
质量/g 溶质的质量分数
(1)
(2)
(3)
【师生活动一】书本P42 实验9-7 比较三种
浓稀不同的硫酸铜溶液
向三个小烧杯中各加入20mL水,然后分别加入约 0.1g、0.5g、2g
固体硫酸铜。比较三种溶液的颜色:
——◆◆◆ 导学导练 ◆◆◆——
■知识点一 溶质质量分数及其计算
浅蓝
蓝
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.1g
20.1g
×100%
≈0.5%
20.5g
×100%
≈2.4%
0.5g
22g
×100%
≈9.1%
2g
Next
◆实战演练一◆
1.某温度下,将10g NaCl完全溶解在90克水中,所得溶液的溶质
质量分数为 。
2.某温度时,7g氯化钾完全溶于水,得到35g氯化钾溶液,则此
溶液的溶质质量分数是 。
溶液中溶质的质量分数是溶质质量和溶液质量之比,
计算公式是:
溶质质量分数 = 。
溶质质量
溶液质量
×
100%
或=
溶质质量
溶质质量+溶剂质量
×100%
10%
20%
Next
■知识点二 求溶质、溶剂的质量
溶质质量=( )× ( )
溶剂质量=( ) ? ( )
【师生活动二】 在农业生产中,常需要用质量分数为16%的
氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠
和水的质量各是多少?
溶液的质量
溶质的质量分数
溶液的质量
溶质的质量
150Kg
16%
24Kg
m(NaCl)
150Kg
24Kg
126Kg
m(水)
解:
答:
需要氯化钠质量为24Kg,需要水质量为126Kg.
Next
◆实战演练二◆
配制500mL质量分数是10%的氢氧化钠溶液(密度为1.1g/cm3)
需要氢氧化钠和水的质量各是多少?
550g
10%
55g
m(NaOH)
550g
55g
495g
m(水)
解:
答:
需要氢氧化钠质量为55g,需要水质量为495g.
500mL
1.1g/cm3
550g
m(NaOH溶液)
Next
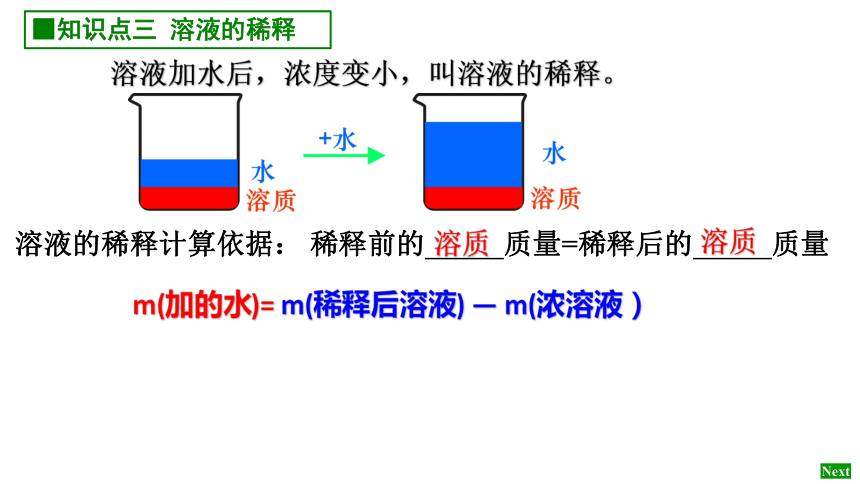
■知识点三 溶液的稀释
溶液加水后,浓度变小,叫溶液的稀释。
溶质
溶质
溶液的稀释计算依据: 稀释前的 质量=稀释后的 质量
m(加的水)= m(稀释后溶液) — m(浓溶液)
Next
【师生活动三】化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,稀释后所得硫酸的质量是多少?需要水的质量是多少?
■知识点三 溶液的稀释
答:
稀释后所得硫酸的质量为245g,需要水质量为195g。
Next
50g
m(稀硫酸)
×98%
×20%
=
50g×98%=X ×20%
解:设稀释后的稀硫酸的质量为X
X=245g
m(水)=245-50=195g
◆实战演练三◆
汽车用铅酸蓄电池中的电瓶水通常为溶质质量分数为40%的
硫酸溶液,现有98%的浓硫酸配制980g该电瓶水,需浓硫酸的
质量为多少?
答:需要浓硫酸的质量为400g。
Next
X×98%=980g ×40%
解:设需浓硫酸的质量为X
X=400g
■知识点四 发生化学反应的溶质质量分数的计算
【师生活动四】6.5克锌粒与100克稀硫酸恰好完全反应,求此
稀硫酸的溶质质量分数。
解:设100g稀硫酸中含有H2SO4的质量为X。
Zn+H2SO4 = ZnSO4+ H2↑
98
6.5g X
98
6.5g X
=
X=9.8g
H2SO4 %=
9.8g
100g
100%=9.8%
答:稀硫酸的溶质质量分数为9.8%。
Next
◆实战演练四◆
25克的大理石和100克稀盐酸恰好完全反应,放出CO2的质量为8.8g。
求:(1)此盐酸的溶质质量分数是多少?
(2)此大理石的纯度是多少?
解:设100g稀盐酸中含有HCl的质量为X,反应的CaCO3质量为y。
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 73 44
y X 8.8g
73 44
X 8.8g
=
X=14.6g
(1)HCl %=
14.6g
100g
100%=14.6%
答(1)此盐酸的溶质质量分数为14.6%,(2)此大理石的纯度为80%。
100 44
y 8.8g
=
y=20g
(2)CaCO3 %=
20g
25g
×100%
=80%
Next
——◆◆◆ 课后作业 ◆◆◆——
1.从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。计
算这瓶溶液中溶质的质量分数为 。
2.在t℃时,将30g硝酸钾固体加入100g水中,充分搅拌后,仍有5g固体
硝酸钾固体未溶解。则所得溶液的溶质质量分数是 。
3.要配制400克15%的氢氧化钠溶液,需要称量氢氧化钠 克,同时量
取多少水 mL。
4.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)小明配制了5%的双氧水溶液600g,则600g溶液中溶质为 g,
溶剂为 g;
(2)小明倒出了300g双氧水溶液进行消毒,剩余溶液的溶质质量分数
是 。
14%
25%
60
340
30
570
5%
Next
5.有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,计算:
(1)该瓶葡萄糖溶液中葡萄糖的
质量为 g。
(2)若将该瓶溶液稀释为5%的溶
液,需要加水的质量为 。
6.实验室需要配制500克10%的盐酸溶液,需要36%的盐酸多少克?
体积为多少毫升?(36%的盐酸密度为1. 19克/毫升)
葡萄糖溶液
溶质的质量分数:25%
溶液的质量:500g
125
2000g
解:
m(浓盐酸)
138.89g≈138.9g
答:需要36%的盐酸138.9g,体积为116.7mL。
500g
36%
10%
m(浓盐酸)
V(浓盐酸) =
138.89g
1.19g/mL
≈ 116.7mL
Next
7.为了测定一瓶过氧化氢溶液的溶质质量分数,取17.0g过氧化氢溶液
于烧杯中,加入0.2g二氧化锰,充分反应至烧杯中物质质量不再减轻,
称量烧杯中剩余物质质量为16.8g,假设生成的气体全部逸出。
(1)根据质量守恒定律可知,生成氧气的质量为___________。
(2)计算这瓶过氧化氢溶液中溶质的质量分数(计算结果精确到0.1%)
0.4g
解:设17g过氧化氢溶液中含有H2O2的质量为X。
2H2O2 ══ 2H2O+ O2↑
MnO2
68 32
X 0.4g
68 32
X 0.4g
=
X=0.85g
H2O2 %=
0.85g
17g
100%=5.0%
答:这瓶过氧化氢溶液中溶质的质量分数为5.0%。
Next
实 验 一 二 三 四
加入样品
的质量/g 5 10 15 20
生成CO2
的质量/g 1. 76 3. 52 4. 4 m
8.学校学习小组为测定当地矿山石灰石中碳酸钙的质量分数,取来了
一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如右表:
(1)上表中m的数值是?????? ? ;
(2)矿石有剩余是第??? 次实验;
(3)这种石灰石矿中碳酸钙的质量
分数是多少?
(4)稀盐酸中溶质的质量分数是多少?
5
1.76
5
1.76
5
0.88
5g
1.76g
X
0.88g
=
X=2.5g
0
0
2.5
4.4
4.4
三
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 44
X 1.76g
100 44
X 1.76g
=
X=4g
(3)解:设5g石灰石中含碳酸钙质量为X。
CaCO3%=
4g
5g
100%=80%
答:这种石灰石矿中碳酸钙的质量分数为80%。
Next
CaCO3+2HCl= CaCl2+CO2↑+H2O
73 44
y 4.4g
73 44
y 4.4g
=
y=7.3g
(4)解:每一份实验的稀盐酸质量为:
HCl%=
7.3g
50g
100%=14.6%
答:稀盐酸中溶质的质量分数为14.6%。
200g
4
=50g
设50g盐酸中HCl的质量为y。
End
课题3:溶质的质量分数(一)
溶液名称 硫酸铜溶液 澄清的
石灰水 稀硫酸 稀盐酸 氯化钾溶液 氢氧化钠溶液
溶质
溶剂
【知识回顾】 写出下列溶液中溶质、溶剂的化学式。
【学习目标】掌握溶质的质量分数的定义及公式;
会利用公式计算溶质、溶剂质量;
掌握溶液稀释的计算。
CuSO4
Ca(OH)2
H2SO4
HCl
KCl
NaOH
H2O
H2O
H2O
H2O
H2O
H2O
Next
编号 溶液
颜色 溶剂
质量/g 溶质
质量/g 溶液
质量/g 溶质的质量分数
(1)
(2)
(3)
【师生活动一】书本P42 实验9-7 比较三种
浓稀不同的硫酸铜溶液
向三个小烧杯中各加入20mL水,然后分别加入约 0.1g、0.5g、2g
固体硫酸铜。比较三种溶液的颜色:
——◆◆◆ 导学导练 ◆◆◆——
■知识点一 溶质质量分数及其计算
浅蓝
蓝
深蓝
20g
20g
20g
0.1g
0.5g
2g
20.1g
20.5g
22g
0.1g
20.1g
×100%
≈0.5%
20.5g
×100%
≈2.4%
0.5g
22g
×100%
≈9.1%
2g
Next
◆实战演练一◆
1.某温度下,将10g NaCl完全溶解在90克水中,所得溶液的溶质
质量分数为 。
2.某温度时,7g氯化钾完全溶于水,得到35g氯化钾溶液,则此
溶液的溶质质量分数是 。
溶液中溶质的质量分数是溶质质量和溶液质量之比,
计算公式是:
溶质质量分数 = 。
溶质质量
溶液质量
×
100%
或=
溶质质量
溶质质量+溶剂质量
×100%
10%
20%
Next
■知识点二 求溶质、溶剂的质量
溶质质量=( )× ( )
溶剂质量=( ) ? ( )
【师生活动二】 在农业生产中,常需要用质量分数为16%的
氯化钠溶液来选种。现要配制150Kg这种溶液,需要氯化钠
和水的质量各是多少?
溶液的质量
溶质的质量分数
溶液的质量
溶质的质量
150Kg
16%
24Kg
m(NaCl)
150Kg
24Kg
126Kg
m(水)
解:
答:
需要氯化钠质量为24Kg,需要水质量为126Kg.
Next
◆实战演练二◆
配制500mL质量分数是10%的氢氧化钠溶液(密度为1.1g/cm3)
需要氢氧化钠和水的质量各是多少?
550g
10%
55g
m(NaOH)
550g
55g
495g
m(水)
解:
答:
需要氢氧化钠质量为55g,需要水质量为495g.
500mL
1.1g/cm3
550g
m(NaOH溶液)
Next
■知识点三 溶液的稀释
溶液加水后,浓度变小,叫溶液的稀释。
溶质
溶质
溶液的稀释计算依据: 稀释前的 质量=稀释后的 质量
m(加的水)= m(稀释后溶液) — m(浓溶液)
Next
【师生活动三】化学实验室现有质量分数为98%的浓硫酸,但在实验室中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的硫酸,稀释后所得硫酸的质量是多少?需要水的质量是多少?
■知识点三 溶液的稀释
答:
稀释后所得硫酸的质量为245g,需要水质量为195g。
Next
50g
m(稀硫酸)
×98%
×20%
=
50g×98%=X ×20%
解:设稀释后的稀硫酸的质量为X
X=245g
m(水)=245-50=195g
◆实战演练三◆
汽车用铅酸蓄电池中的电瓶水通常为溶质质量分数为40%的
硫酸溶液,现有98%的浓硫酸配制980g该电瓶水,需浓硫酸的
质量为多少?
答:需要浓硫酸的质量为400g。
Next
X×98%=980g ×40%
解:设需浓硫酸的质量为X
X=400g
■知识点四 发生化学反应的溶质质量分数的计算
【师生活动四】6.5克锌粒与100克稀硫酸恰好完全反应,求此
稀硫酸的溶质质量分数。
解:设100g稀硫酸中含有H2SO4的质量为X。
Zn+H2SO4 = ZnSO4+ H2↑
98
6.5g X
98
6.5g X
=
X=9.8g
H2SO4 %=
9.8g
100g
100%=9.8%
答:稀硫酸的溶质质量分数为9.8%。
Next
◆实战演练四◆
25克的大理石和100克稀盐酸恰好完全反应,放出CO2的质量为8.8g。
求:(1)此盐酸的溶质质量分数是多少?
(2)此大理石的纯度是多少?
解:设100g稀盐酸中含有HCl的质量为X,反应的CaCO3质量为y。
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 73 44
y X 8.8g
73 44
X 8.8g
=
X=14.6g
(1)HCl %=
14.6g
100g
100%=14.6%
答(1)此盐酸的溶质质量分数为14.6%,(2)此大理石的纯度为80%。
100 44
y 8.8g
=
y=20g
(2)CaCO3 %=
20g
25g
×100%
=80%
Next
——◆◆◆ 课后作业 ◆◆◆——
1.从一瓶氯化钾溶液中取出20克溶液,蒸干后得到2.8克氯化钾固体。计
算这瓶溶液中溶质的质量分数为 。
2.在t℃时,将30g硝酸钾固体加入100g水中,充分搅拌后,仍有5g固体
硝酸钾固体未溶解。则所得溶液的溶质质量分数是 。
3.要配制400克15%的氢氧化钠溶液,需要称量氢氧化钠 克,同时量
取多少水 mL。
4.双氧水(H2O2)既是工业上重要的绿色氧化剂,又是常用的医用消毒剂。
(1)小明配制了5%的双氧水溶液600g,则600g溶液中溶质为 g,
溶剂为 g;
(2)小明倒出了300g双氧水溶液进行消毒,剩余溶液的溶质质量分数
是 。
14%
25%
60
340
30
570
5%
Next
5.有一瓶葡萄糖(C6H12O6)溶液,部分标签如图所示,计算:
(1)该瓶葡萄糖溶液中葡萄糖的
质量为 g。
(2)若将该瓶溶液稀释为5%的溶
液,需要加水的质量为 。
6.实验室需要配制500克10%的盐酸溶液,需要36%的盐酸多少克?
体积为多少毫升?(36%的盐酸密度为1. 19克/毫升)
葡萄糖溶液
溶质的质量分数:25%
溶液的质量:500g
125
2000g
解:
m(浓盐酸)
138.89g≈138.9g
答:需要36%的盐酸138.9g,体积为116.7mL。
500g
36%
10%
m(浓盐酸)
V(浓盐酸) =
138.89g
1.19g/mL
≈ 116.7mL
Next
7.为了测定一瓶过氧化氢溶液的溶质质量分数,取17.0g过氧化氢溶液
于烧杯中,加入0.2g二氧化锰,充分反应至烧杯中物质质量不再减轻,
称量烧杯中剩余物质质量为16.8g,假设生成的气体全部逸出。
(1)根据质量守恒定律可知,生成氧气的质量为___________。
(2)计算这瓶过氧化氢溶液中溶质的质量分数(计算结果精确到0.1%)
0.4g
解:设17g过氧化氢溶液中含有H2O2的质量为X。
2H2O2 ══ 2H2O+ O2↑
MnO2
68 32
X 0.4g
68 32
X 0.4g
=
X=0.85g
H2O2 %=
0.85g
17g
100%=5.0%
答:这瓶过氧化氢溶液中溶质的质量分数为5.0%。
Next
实 验 一 二 三 四
加入样品
的质量/g 5 10 15 20
生成CO2
的质量/g 1. 76 3. 52 4. 4 m
8.学校学习小组为测定当地矿山石灰石中碳酸钙的质量分数,取来了
一些矿石样品,并取稀盐酸200 g,平均分成4份进行实验,结果如右表:
(1)上表中m的数值是?????? ? ;
(2)矿石有剩余是第??? 次实验;
(3)这种石灰石矿中碳酸钙的质量
分数是多少?
(4)稀盐酸中溶质的质量分数是多少?
5
1.76
5
1.76
5
0.88
5g
1.76g
X
0.88g
=
X=2.5g
0
0
2.5
4.4
4.4
三
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 44
X 1.76g
100 44
X 1.76g
=
X=4g
(3)解:设5g石灰石中含碳酸钙质量为X。
CaCO3%=
4g
5g
100%=80%
答:这种石灰石矿中碳酸钙的质量分数为80%。
Next
CaCO3+2HCl= CaCl2+CO2↑+H2O
73 44
y 4.4g
73 44
y 4.4g
=
y=7.3g
(4)解:每一份实验的稀盐酸质量为:
HCl%=
7.3g
50g
100%=14.6%
答:稀盐酸中溶质的质量分数为14.6%。
200g
4
=50g
设50g盐酸中HCl的质量为y。
End
同课章节目录
