8.3:金属资源的保护和利用(含解析)
文档属性
| 名称 | 8.3:金属资源的保护和利用(含解析) |  | |
| 格式 | zip | ||
| 文件大小 | 253.5KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-11 08:53:54 | ||
图片预览

文档简介
中小学教育资源及组卷应用平台
初中化学人教版九年级下学期第八单元课题3:金属资源的保护和利用
一、单选题(共7题;共14分)
1.下列有关金属材料的说法正确的是(?? )
A.?硬铝片比纯铝片硬度小???????????????????????????????????????B.?钢的性能优良,是很纯的铁
C.?沙漠地区的铁制品锈蚀较快????????????????????????????????D.?为防止钢铁生锈要,可在其表面涂油
2.地壳中含量前四位的元素由多到少的排列顺序是(? )
A.?H、O、C、N????????????????B.?O、Si、Al、Fe????????????????C.?N、O、C、H????????????????D.?Si、O、Fe、Al
3.“绿水青山就是金山银山”,垃圾分类处理有利于生态文明建设。废弃物中,易拉罐属于(?? )
A.?可回收物???????????????????????????B.?餐厨垃圾???????????????????????????C.?有害垃圾???????????????????????????D.?其它垃圾
4.下列说法错误的是()
A.?铁在潮湿的空气中易生锈????????????????????????????????????B.?铁可以在空气中燃烧
C.?铁跟稀硫酸反应生成硫酸亚铁和氢气??????????????????D.?生铁是含杂质的合金
5.探究铁生锈的条件,有利于寻找防止铁制品锈蚀的方法。下列对比实验设计与所探究的条件(蒸馏水经煮沸并迅速冷却),对应关系正确的是(?? )
A.?甲和乙:水????????????????????B.?乙和丙:空气????????????????????C.?甲和丙:空气????????????????????D.?甲和丁:水
6.被雨水淋湿的自行车,应( ???)
A.?先用布擦干,再用带油的布擦拭车链等部位????????B.?在自行车表面刷一层油漆
C.?用布擦干即可?????????????????????????????????????????????????????D.?晾干后,用盐酸除去锈层
7.地壳中含量最多的金属元素与非金属元素组成的化合物的化学式为()
A.?SiO2???????????????????????????????????B.?FeO???????????????????????????????????C.?Fe3O4???????????????????????????????????D.?Al2O3
二、填空题(共3题;共16分)
8.近日,在重庆“服役”51年的牛角沱嘉陵江大桥开始大修了,这座跨越了半个多世纪的大桥是重庆主城首座城市大桥,也是市级文物保护单位。其中,大桥桥面部分的施工是大修工程的重点之一,主要是进行行车道板改造。工程将拆除桥面现有的混凝土行车道板,更换为钢桥面板。请回答下列有关问题:
(1)钢桥面板的主要材料________合金(填“是”或“不是”),选择该材料的原因是________(填字母序号)。
A.密度大?????????? B.硬度大?????????? C.导热性好
(2)桥梁外表面由于处于潮湿和酸性大气中,容易腐蚀生锈。请写出用稀硫酸清洗铁锈的化学方程式________。
(3)如果你是桥梁维护人员,请说出一种防止钢铁生锈的方法________。
9.铁在地壳中含量居所有金属元素的第________位,由于铁的化学性质________,所以铁在地壳中以________形式存在.常见的含铁的矿物有:磁铁矿(主要成分为________)、赤铁矿:(主要成分为________).工业炼铁时,把________、________、________一起加入高炉,利用焦炭与氧气反应生成的________把铁从________里还原出来.
10.与生活密切相关,下列成语或俗语蕴藏了什么化学原理? “金无足赤”________.
三、综合题(共3题;共17分)
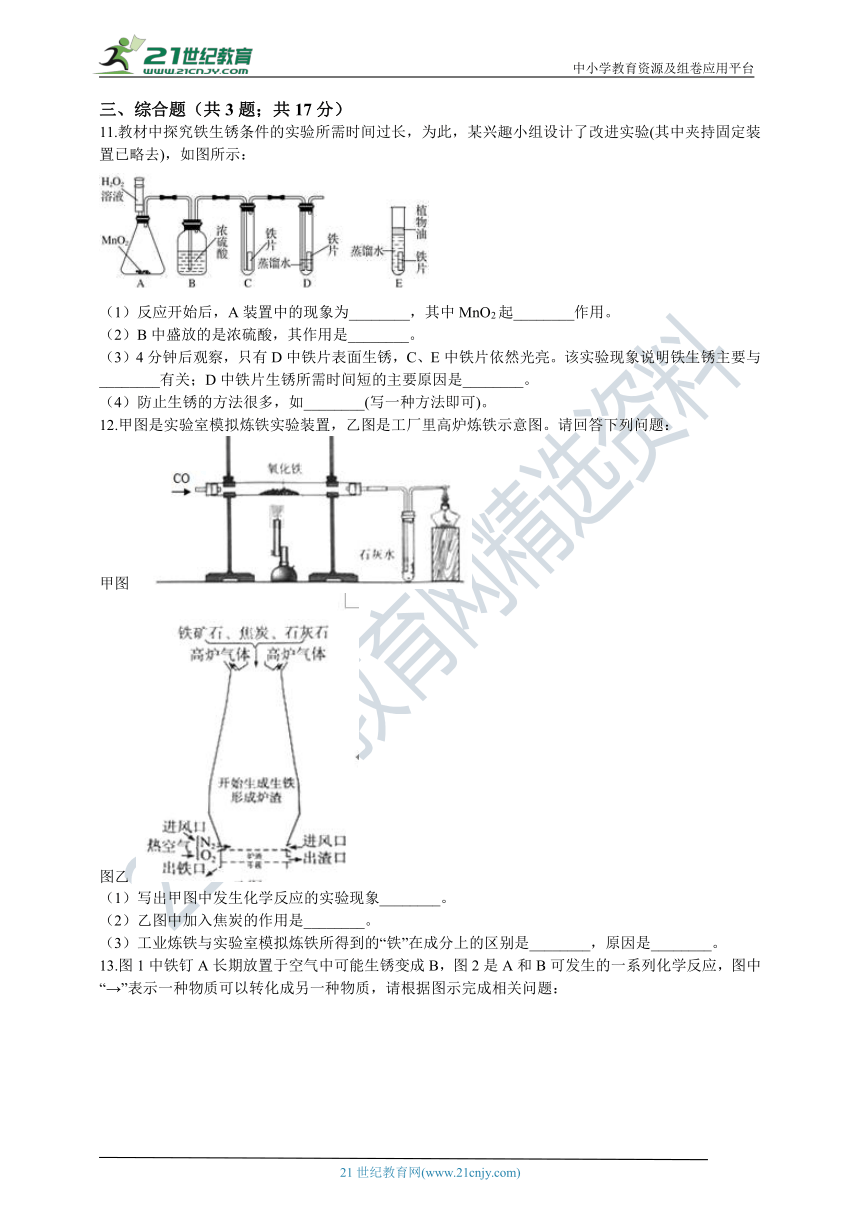
11.教材中探究铁生锈条件的实验所需时间过长,为此,某兴趣小组设计了改进实验(其中夹持固定装置已略去),如图所示:
(1)反应开始后,A装置中的现象为________,其中MnO2起________作用。
(2)B中盛放的是浓硫酸,其作用是________。
(3)4分钟后观察,只有D中铁片表面生锈,C、E中铁片依然光亮。该实验现象说明铁生锈主要与________有关;D中铁片生锈所需时间短的主要原因是________。
(4)防止生锈的方法很多,如________(写一种方法即可)。
12.甲图是实验室模拟炼铁实验装置,乙图是工厂里高炉炼铁示意图。请回答下列问题:
甲图
图乙
(1)写出甲图中发生化学反应的实验现象________。
(2)乙图中加入焦炭的作用是________。
(3)工业炼铁与实验室模拟炼铁所得到的“铁”在成分上的区别是________,原因是________。
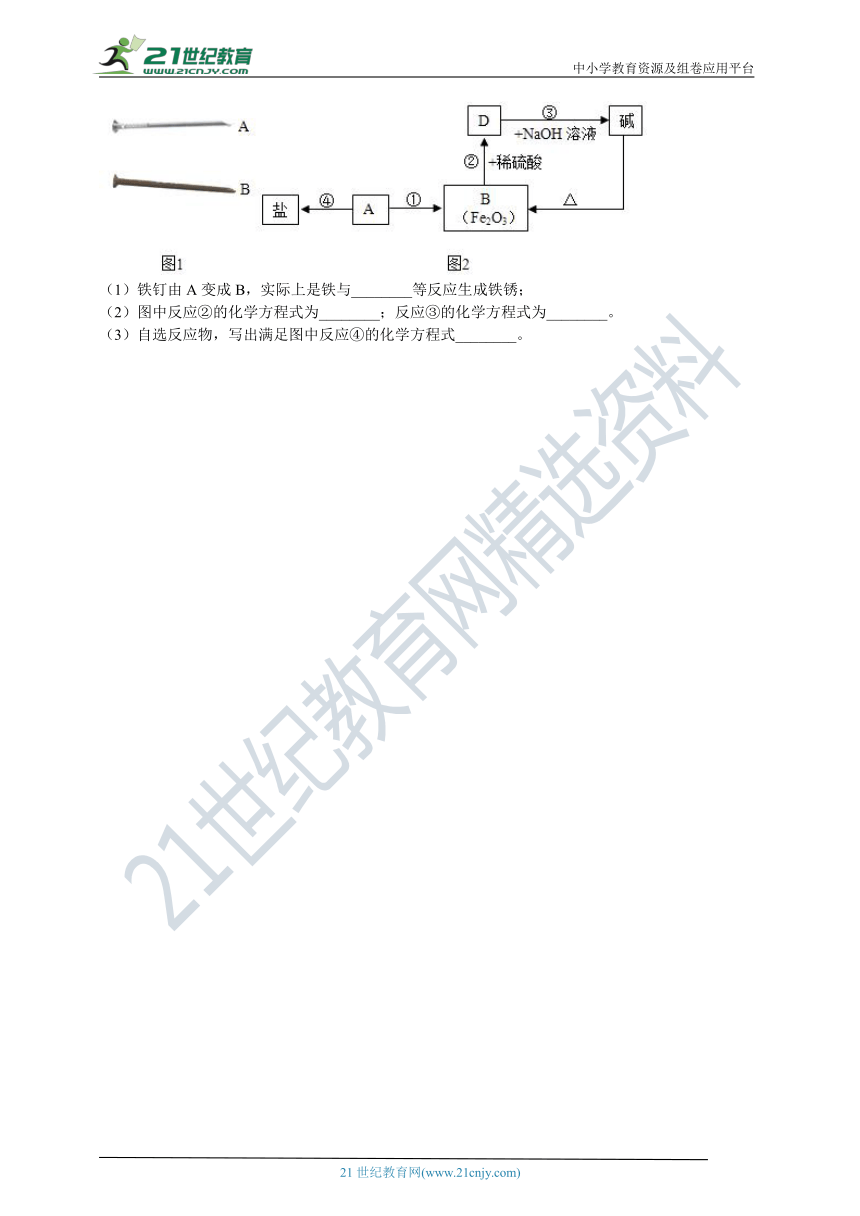
13.图1中铁钉A长期放置于空气中可能生锈变成B,图2是A和B可发生的一系列化学反应,图中“→”表示一种物质可以转化成另一种物质,请根据图示完成相关问题:
(1)铁钉由A变成B,实际上是铁与________等反应生成铁锈;
(2)图中反应②的化学方程式为________;反应③的化学方程式为________。
(3)自选反应物,写出满足图中反应④的化学方程式________。
答案解析部分
一、单选题
1.答案: D
解析:A. 硬铝片为合金,比纯铝片硬度大,不符合题意;
B.钢是铁与碳制成的合金,不符合题意;
C. 沙漠地区干燥,铁制品锈蚀较慢,不符合题意;
D. 为防止钢铁生锈要,可在其表面涂油 ,以隔离氧气和水,符合题意;
故答案为:D
A、根据合金的硬度比纯金属的大分析;
B、根据钢是铁的合金分析;
C、根据沙漠地区空气干燥及铁生锈的实质分析;
D、根据铁生锈是铁与氧气和水共同作用分析。
2.答案: B
解析:地壳中元素含量的顺序由多到少的顺序为:氧、硅、铝、铁、钙、钠、钾、镁、氢等。
故答案为:B。
根据地壳中元素的含量分析
3.答案: A
解析: 易拉罐属于金属材料,可回收利用;
故答案为:A
根据易拉罐属于金属材料,属于可回收物分析。
4.答案: B
解析:A、铁与氧气、水同时接触易生锈,故铁在潮湿的空气中易生锈,不符合题意;
B、铁在纯氧中才能燃烧,在空气中不燃烧,符合题意;
C、铁跟稀硫酸反应生成硫酸亚铁和氢气,不符合题意;
D、生铁是铁和碳的合金,是混合物,不符合题意。
故答案为:B。
A、根据铁生锈是铁与氧气和水共同作用分析;
B、根据铁在氧气中可以燃烧分析;
C、根据铁与酸发生反应生成亚铁盐和氢气分析;
D、根据生铁是铁的合金分析。
5.答案: D
解析:A.甲和乙没进行铁生锈的对比实验,不符合题意;
B.乙和丙都是铁与水接触,不能探究铁生锈与空气有关,不符合题意;
C.甲和丙没有铁生锈的对比实验,不符合题意;
D.甲铁与氧气接触不与水接触,丁接触水和氧气,通过甲不生锈丁生锈可证明与水有关,符合题意;
故答案为:D
根据对比实验设计方法分析,在进行对比实验时要注意变量的控制,保证变量的唯一性,且必须有发生反应与不发生反应的对比实验来完成。
6.答案: A
解析:铁与水和空气接触很容易生锈, 被雨水淋湿的自行车,为防止其生锈,要先用布擦干,再用带油的布擦拭车链等部位,以防止锈蚀;
故答案为:A
根据铁生锈是铁与氧气和水共同作用的结果分析。
7.答案: D
解析:地壳中含量最多的金属元素是铝元素,地壳中含量最多的非金属元素是氧元素,故形成的化合物为氧化铝,铝元素化合价为+3,氧元素化合价为-2,其中金属元素写在左边,非金属元素写在右边,故氧化铝化学式为Al2O3。
故答案为:D。
根据地壳中含量最多的金属元素为铝元素、最多的非金属元素为氧元素结合化学式书写原则分析。
二、填空题
8.答案: (1)是;B
(2)
(3)刷漆
解析:(1)钢是一种铁合金,其硬度大,所以可用来制钢桥面板;故填:是;B;(2)铁锈的主要成分是氧化铁,与硫酸反应生成硫酸铁和水,反应的化学方程式是:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O;(3)为了防止钢铁的锈蚀,人们常采用在其表面刷漆、涂油或镀上其他金属等覆盖保护膜的方法,这些方法都能够防止锈蚀的共同原理是隔绝氧气和水。故填:刷漆(答案合理皆可)。
(1)根据钢是合金及合金的特点分析
(2)根据氧化铁和稀硫酸反应生成硫酸铁和水分析
(3)根据铁生锈的条件确定防锈的方法
9.答案:二;活泼;化合物;四氧化三铁;氧化铁;铁矿石;焦炭;石灰石;一氧化碳;化合物
解析:解:在地壳中前五位元素是:氧、硅、铝、铁,所以铁在地壳中含量居所有金属元素的第二位;铁的化学性质活泼,在自然界中主要以化合物的形式存在,磁铁矿主要成分是四氧化三铁,赤铁矿的主要成分是氧化铁;工业炼铁的原料是铁矿石、焦炭、石灰石,利用还原剂与铁的化合物反应还原出金属铁. 故答案为:二;活泼;化合物;四氧化三铁;氧化铁;铁矿石;焦炭;石灰石;一氧化碳;化合物.
根据在地壳中前五位元素是:氧、硅、铝、铁考虑铁属于第几位;铁的化学性质活泼,在自然界中主要以化合物的形式存在,磁铁矿主要成分是四氧化三铁,赤铁矿的主要成分是氧化铁;工业炼铁的原料是铁矿石、焦炭、石灰石,利用还原剂与铁的化合物反应还原出金属铁.
10.答案:在自然界中100%的纯净物是不存在的
解析:解:虽然说金的自然状态大都是游离状的纯金,但自然界中的纯金却很少是真正纯净的,它们大都含金达99%以上,但总含有少量银,另外还含有微量的钯、铂、汞、铜、铅等.金无足赤说明在自然界中100%的纯净物是不存在的. 故答案为:在自然界中100%的纯净物是不存在的
混合物是两种或两种以上的物质组成,纯净物是单一的一种物质.
三、综合题
11.答案: (1)产生大量气泡;催化
(2)干燥气体
(3)水和氧气;氧气的浓度大
(4)涂油漆等
解析:(1)过氧化氢在二氧化锰催化作用下分解生成水和氧气,反应开始后,A装置中的现象为产生大量气泡,其中MnO2起催化作用;(2)浓硫酸具有吸水性。B中盛放的是浓硫酸,其作用是干燥气体;(3)铁在有水和氧气并存时易生锈,C中铁制品只与氧气没与水接触,E装置中的铁制品只与水接触和极少量的氧气接触,只有D中的铁制品同时和水、氧气接触生锈最快。4分钟后观察,只有D中铁片表面生锈,C、E中铁片依然光亮。该实验现象说明铁生锈主要与水和氧气有关;D中铁片生锈所需时间短的主要原因是氧气的浓度大;(4)防止生锈的方法很多,防锈的方法是使铁与水或氧气隔绝,如涂油漆等。
(1)根据过氧化氢分解制取氧气的现象与二氧化锰的催化作用分析;
(2)根据浓硫酸的吸水性分析;
(3)根据铁生锈实质分析,铁生锈是铁与氧气和水共同作用,且化学反应速率与物质的浓度有关;
(4)根据生锈原理确定防锈方法分析。
12.答案: (1)玻璃管中红色粉末变黑色,石灰水变浑浊,末端导管有蓝色火焰
(2)提供炼铁所需要的热量,提供反应所需要的还原剂
(3)实验室炼铁可得到纯铁,工业炼铁得到的是含有碳等杂质的生铁;因为工业炼铁中所用的原料有焦炭等其它固体成分,在反应过程中这些固体会混在生成的铁中
解析:(1)在高温的条件下,一氧化碳与氧化铁反应生成铁和二氧化碳,二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,尾气中含有的一氧化碳能够燃烧,产生蓝色火焰;故填:玻璃管中红色粉末变黑色,石灰水变浑浊,末端导管有蓝色火焰;(2)高炉炼铁中原料焦炭的作用是提供热量和得到还原剂一氧化碳,故填:提供炼铁所需要的热量,提供反应所需要的还原剂;(3)因为工业炼铁中所用的原料有焦炭等其它固体成分,在反应过程中这些固体会混在生成的铁中,所以实验室炼铁可得到纯铁,工业炼铁得到的是含有碳等杂质的生铁;故填:实验室炼铁可得到纯铁,工业炼铁得到的是含有碳等杂质的生铁;因为工业炼铁中所用的原料有焦炭等其它固体成分,在反应过程中这些固体会混在生成的铁中。
(1)根据一氧化碳还原氧化铁的现象分析;
(2)根据炼铁中各原料的作用分析;
(3)根据炼铁产物为生铁,而一氧化碳与氧化铁反应产物为纯铁分析。
13.答案:(1)氧气、水
(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4
(3)Fe+2HCl=FeCl2+H2↑
解析:解:铁和空气中的氧气、水固体作用,会发生锈蚀,氧化铁和硫酸反应生成硫酸铁和水,硫酸铁和氢氧化钠反应生成氢氧化铁沉淀和硫酸钠,氢氧化铁加热会生成氧化铁和水,铁和盐、酸反应会生成亚铁盐,经过验证,推导正确,所以(1)铁钉由A变成B,实际上是铁与氧气、水等反应生成铁锈;(2)反应②是氧化铁和硫酸反应硫酸铁和水,化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,反应③是硫酸铁和氢氧化钠反应生成氢氧化铁沉淀和硫酸钠,化学方程式为:Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4;(3)自选反应物,满足图中反应④是铁和盐酸反应生成氯化亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑。
故答案为:(1)氧气、水;(2)Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,Fe2(SO4)3+6NaOH=2Fe(OH)3↓+3Na2SO4;(3)Fe+2HCl=FeCl2+H2↑。
(1)腐蚀的条件考查,即为空气,水等,(2)根据给出的反应物作答,(3)由题目信息可知是一个生成盐的反应,如酸和碱,酸和盐,酸和金属单质,酸和金属氧化物等
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
同课章节目录
