河西成功学校2019年度初中化学 《金属的化学性质》专项练习四
文档属性
| 名称 | 河西成功学校2019年度初中化学 《金属的化学性质》专项练习四 |

|
|
| 格式 | zip | ||
| 文件大小 | 278.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-11 00:00:00 | ||
图片预览



文档简介
河西成功学校2019年度初中化学
《金属的化学性质》专项练习四
1、选择题
1、2018年11月20日,哈尔滨市滨北线松花江公铁两用桥通车了。下层为滨北线铁路桥梁,上层为市政桥梁,该桥实现二环与江北之间快速交通功能。下列相关说法不正确的是(?? )
A. 该桥的建成缓解了城市交通,过江开车只需5分钟
B. 桥面上铺设了特种沥青,沥青是石油炼制的产品
C.建设该桥时用到大量的钢材,钢的含碳量比生铁高,硬度更大
D. 铺设的钢轨为韧性好、硬度大的锰钢,其主要成分为铁、锰和碳
2、向等质量的锌粉和铁粉中分别加入足量稀硫酸,下列图象描述正确的是( )
A. B. C. D.
3、有X、Y、Z三种金属,将X、Y、Z分别加入到相同的稀盐酸溶液中,只有Y表面产生气泡,另将X加入到Z的硝酸盐溶液中,无明显现象产生,由此判断金属活动性顺序正确的是( )
A.X>Y>Z? B.Y>Z>X? C.Y>X>Z? D.Z>Y>X
4、下列物质中,不属于合金的是( )
A.不锈钢?? B.氧化汞?? C.黄铜 D.生铁
5、下列四个图象能正确反映实验变化关系的有( )
A.
常温下,足量的镁、铁分别同时放入少量等质量、等质量分数的稀盐酸中
B.
敞口放置于空气中的浓硫酸或稀盐酸
C.
加热KNO3、Ca(OH)2的饱和溶液(不考虑溶剂的蒸发)
D.
少量的碳在密闭的集气瓶中与氧气完全燃烧
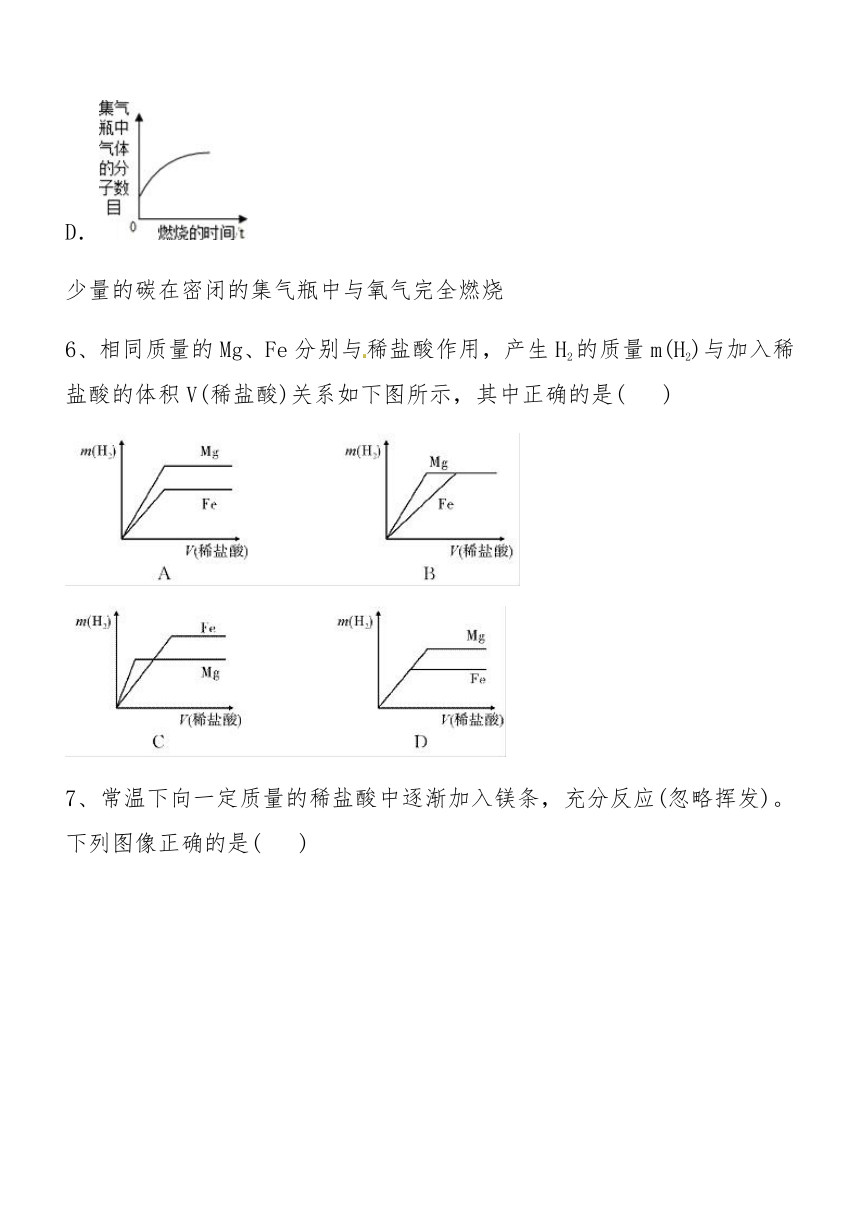
6、相同质量的Mg、Fe分别与稀盐酸作用,产生H2的质量m(H2)与加入稀盐酸的体积V(稀盐酸)关系如下图所示,其中正确的是(???? )
7、常温下向一定质量的稀盐酸中逐渐加入镁条,充分反应(忽略挥发)。下列图像正确的是(???? )
A.①② ??????? ?B.②③ ?????? ?C.①④ ?????? ?D.②④
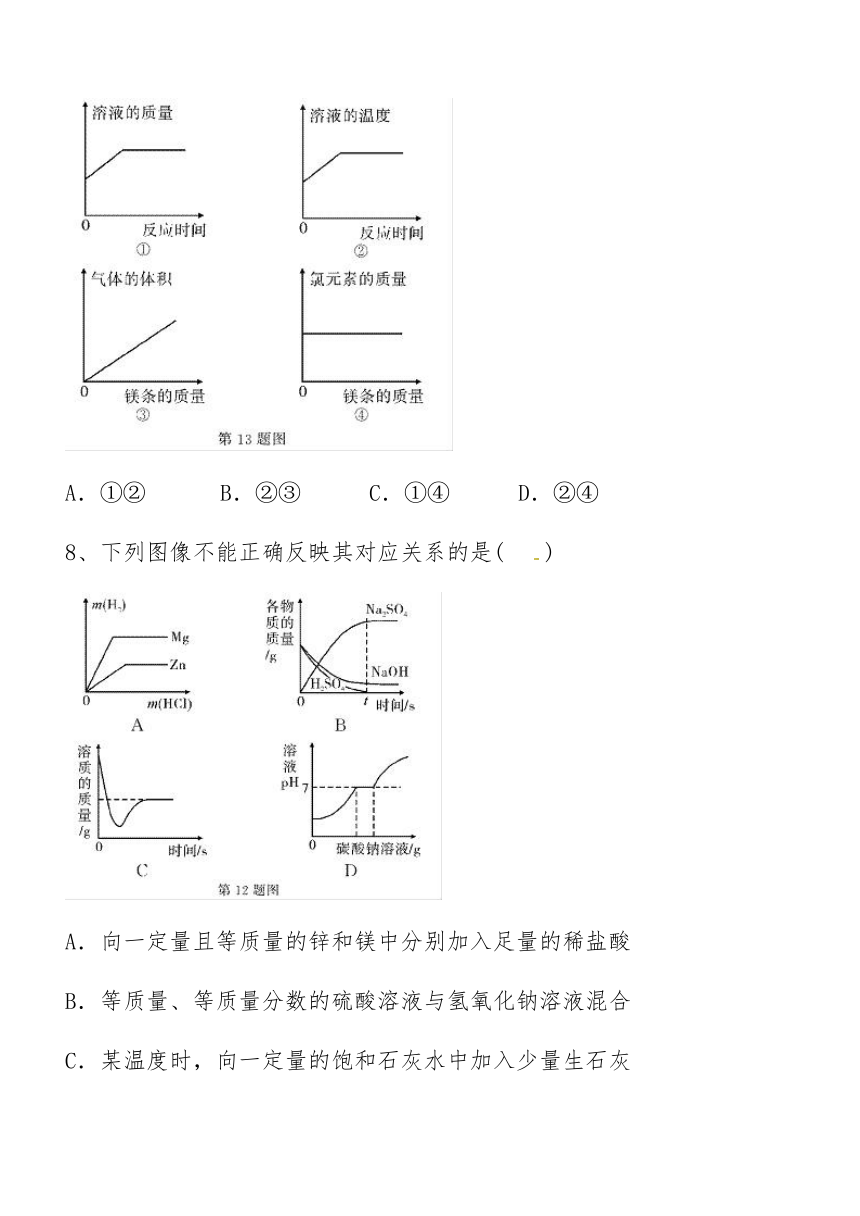
8、下列图像不能正确反映其对应关系的是(??? ?)
A.向一定量且等质量的锌和镁中分别加入足量的稀盐酸
B.等质量、等质量分数的硫酸溶液与氢氧化钠溶液混合
C.某温度时,向一定量的饱和石灰水中加入少量生石灰
D.向一定量的氯化钙与盐酸的混合溶液中逐滴加碳酸钠溶液至过量
9、氧化铜和稀盐酸发生反应时,容器中溶液总质量随时间的变化曲线如图所示。下列说法正确的是(???? )
A.该实验是将氧化铜逐渐加入稀盐酸中
B.n点和m点对应溶液中铜元素质量不相等
C.n点和m点对应溶液蒸发结晶后得到的固体成分相同
D.该曲线不能反映溶液中溶剂质量随时间的变化关系
二、填空题
10、我国第一艘国产航母下水和国产大型客机C919首飞,标志着我国航海、航空事业有了重大突破,结合所学知识回答下列问题:
(1)铜运用于航母电力系统的导线是利用了铜的导电性和_____________性;
(2)大型客机大量使用的钛合金属于_______________(填“纯净物”或“混合物”);
(3)建造一艘排水量为6万吨的航母约需6万吨的特种钢材,通过高炉炼铁生产6万吨含铁98%的铁制品,需含氧化铁80%的赤铁矿石___________万吨。
(4)是航天、航空、航海、兵器和核能等高科技领域不可缺少的关键材料,比较Mn、Pd(钯)Cu三种金属的活动性顺序。
①将Mn片、Pd片、Cu片分别加入到稀盐酸中,Mn片表面有气泡产生,Pd片和Ca片没有变化,根据上述实验现象得出的结论是__________________________________________;
②要确切得出这三种金属的活动性顺序,还需将Pd片加入到______________溶液中,观察现象。
11、为探究Fe、Cu、Ag的金属活动性强弱,某兴趣小组做了如下实验:
实验前需将金属丝打磨,目的是______。
甲实验中发生反应的化学方程式为______;乙实验中观察到的现象为______。
通过甲、乙实验探究,可得出三种金属活动性由强到弱的顺序为______。
若采用丙实验方案也可得出相同结论,则金属C是______。
12、分类、类比是学习化学常用的方法。
(1)物质的分类标准有多种,标准可以是物质的组成、性质、用途等。请根据所学知识,依据物质的类别,自拟分类标准,将下列物质平均分成三类:
火碱、干冰、亚硝酸钠、消石灰、氯化铵、生石灰
①分类标准:???? ;②包括物质的化学式:???? 。
(2)在金属活动性顺序里,位于①??的金属能把位于后面的金属从它们的盐溶液中置换出来,但是除K、Ca、Na外,因为这三种金属活动性太强,加入盐溶液中先与水反应生成相应的碱和氢气,生成的碱再与盐反应。请你写出金属钠与硫酸铜溶液反应的总化学方程式:②??。
13、材料:我国第四套人民币中的一元硬币是钢芯镀镍(Ni),镍与稀硫酸能发生下列反应:Ni+H2SO4═NiSO4+H2↑. 根据此材料及金属活动性顺序,请回答:
(1)铸造硬币用到的材料是 (填“合成材料”或“金属材料”);
(2)写出Ni与CuSO4溶液发生置换反应的方程式.
14、港珠大桥于2018年10月24日正式通车运营。港珠大桥的设计使用寿命长达120年,打破了国内大桥的“百年惯例”。据了解,广东韶关钢铁有限公司供应了螺纹钢、盘螺、钢箱梁等金属材料。请根据金属的相关性质回答下列问题:
(1)港珠澳大桥所用的螺纹钢是 (选填“纯金属”或“合金”);
(2)钢铁器件上一般会喷油漆,这是为了防止铁制品与 (填物质的化学式)发生反应而生锈;
(3)金属矿物的储量有限,下列做法属于保护金属资源的有效途径是 (填字母序号);
A.合理开釆矿物???? B.寻找金属替代品?? C.回收利用金属???? D.禁止使用铁制品
(4)将一定量的铁粉加入硝酸银、硝酸铜的混合溶液中,充分反应后过滤,得到滤液和滤渣。试分析:
①若向滤渣中加入稀盐酸,有气泡冒出,则滤渣中含有 (填物质化学式,下同);
②若向滤渣中加入稀盐酸,无明显现象,则滤液中一定有 ,可能有 。
15、白铜(Cu、Ni合金)因光泽好、耐腐蚀等优点,常代替银做饰品。下图所示是某实验室分离废弃白铜饰品成分的流程(部分反应产物在图中已略去,Ni在化合物中显+2价,其化合物的水溶液呈绿色)。
分析该流程,回答下列问题:
(1)操作I名称是____________,操作用到的玻璃仪器有烧杯、____________和玻璃棒,坡璃棒的作用是____________。
(2)废旧白铜饰品中加入适量稀硫酸时观察到的现象是__________________________________________。
(3)溶液A加入适量锌粉发生反应的化学方程式________________________________________________。
(4)Cu、Ni、Zn的金属活动性由强到弱的顺序是______________________________。
16、早在春秋战国时期,我国就开始生产和使用铁器。从1世纪起,铁成了一种最主要的金属材料,工业上可利用一氧化碳还原赤铁矿制得金属铁。
(1)如下图回答问题:
①加热一段时间后玻璃管内的现象是? ? ,反应的化学方程式为? ?
②你认为B装置的优点是? ?
(2)某钢铁厂用1000t80%的赤铁矿冶炼生铁,最终能得到含铁97%的生铁多少吨?(结果保留一位小数)
17、某同学将光亮的镁条放入滴有酚酞的NaHCO3饱和溶液中,产生大量气泡和白色固体,溶液红色加深.
(一)溶液红色加深,则反应后溶液的碱性______(填“增强”、“不变”或“减弱”).
(二)为确定气体和固体的成分,该同学进行了如下的探究.
(1)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象.则该气体为______(写化学式).
(2)对白色固体做出如下猜测并进行实验:
【猜测】
查阅资料1:Mg(HCO3)2能溶于水.
①白色固体可能是MgCO3;
②白色固体可能是______;
③白色固体可能是MgCO3和Mg(OH)2.
【实验】
①取洗净后的白色固体,加入足量的______溶液,观察到______,则白色固体一定含有MgCO3.
查阅资料2:MgCO3、Mg(OH)2加热易分解,分别生成两种氧化物.
②为进一步确定白色固体的组成,该同学进行了定量实验:
称取干燥的白色固体22.6g,充分加热至不再产生气体为止,并使分解产生的气体全部先通过浓硫酸,浓硫酸增重1.8g,则白色固体中含有______,再通过碱石灰,碱石灰增重8.8g,则固体中各成分的质量比为______
18、小敏探究影响锌与盐酸反应快慢的因素。
序号 盐酸溶液浓度 2分钟内产生氢气的体积
1 5% 10 mL
2 15% 28 mL
(1)图中A、B仪器可以组装一套测量气体体积的装置,利用该装置时A中的________管接c。
(2)他选用2 g完全相同的锌片分别和同体积5%、15%的稀盐酸进行实验。获得表格数据。由此推断实验是通过__________________________来体现反应快慢的。
(3)小敏分析数据得到如下结论:锌与盐酸反应快慢与盐酸浓度有关,盐酸浓度越大反应越快。其他同学认为结论不可靠,他们的依据是__________________________________。
(4)实验中小敏发现锌与盐酸反应时,一开始产生氢气速率并没有随盐酸浓度的减少而减慢,查阅资料得知化学反应中往往伴随着能量变化。由此做出猜想:锌与盐酸反应快慢还与________有关。?
19、同学们一起探究铝、铁、铜三种金属的活动性,小刚同学设计了用铜丝、铝丝、铁丝和稀盐酸,只用一只试管、取用一次盐酸的探究方案。请你和他们一起完成下表的探究方案并回答有关问题。
(1)填表:
实验步骤 观察到的现象
①在试管中加入适量的盐酸,插入铁丝,充分反应 ????
②在①所得的溶液中,插入???? ,充分反应 无明显现象
③在②所得的溶液中,插入???? ,充分反应 ????
结论:金属活动性:铝>铁>铜
(2)将铝丝插入溶液前应进行的简单操作是??? ? 。
(3)小刚同学认为只要在上述实验中补充一个实验,就能得到铝>铁>H>铜的结论,则补充的实验是??? ? 。
(4)实验①对应的化学方程式:??? ? 。
20、我国劳动人民早在五千年前就会使用木炭炼铜.在化学实验室里模拟炼铜,既可用传统的实验装置(如图甲),又能用改进的微型实验装置(如图乙).化学兴趣小组采用图乙装置,开展以下探究活动.
【提出问题】木炭与CuO反应所得红色固体中含有什么物质?
【查阅资料】
(1)木炭与CuO的反应是:C+2CuO2Cu+CO2↑,若该反应进行的不彻底,产物中还有氧化亚铜(Cu2O).
(2)Cu不活泼,不能与稀硫酸反应;Cu2O是红色固体,能与稀硫酸反应:Cu2O+H2SO4═Cu+CuSO4+H2O
【作出猜想】红色固体的成分:①全部是Cu;②全部是Cu2O;③ .
【实验探究】
(1)取木炭、CuO两种黑色粉末适量,再也少许CaC12(能降低反应温度,加快反应速率)均匀混合,然后将黑色粉末装入长柄V形玻璃管的直管内.
(2)按图乙连好实验装置,然后加热反应物;2分钟后,黑色粉末出现红热现象,同时澄清的石灰水变浑浊,此时停止加热.
(3)待玻璃管冷却后,提取里面的红色固体,进行如表的验证:
步? 骤 现? 象 结 论
①取1.44g红色固体装入试管,滴入足量的稀硫酸,充分反应 ?红色固体部分减少,溶液为 色 猜想 ① 错误
②滤了试管中残留的红色固体,洗涤干燥称其质量为1.04g 猜想 正确
【评价反思】
(1)使用图乙装置与使用图甲装置相比,其优点是(写出1条即可) .
(2)若要证明CaC12是该反应的催化剂,还需要验证CaCl2的 .
21、某炼铁厂用赤铁矿石炼铁(除氧化铁外,其他成分不溶于水,也不与酸反应),现要测定该赤铁矿中氧化铁的含量,进行如下实验:
(1)写出上述发生反应的化学方程式____________________;
(2)列出求解20g赤铁矿石中氧化铁质量(x)的比例式__________________;
(3)此赤铁矿中氧化铁的质量分数为_______________;
(4) 向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为___________;
(5)若用配制100g21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为______________g;
配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有。
22、某同学用锌和稀硫酸制取氢气。向气体发生装置中加入一定量锌粒,将30 g稀硫酸分三次加入,每次生产气体的质量如下表。
次数 第一次 第二次 第三次
加入稀硫酸质量/g 10 10 10
生成氢气质量/g 0.04 0.04 0.02
(1)共制得氢气多少g。???
(2)第二次所用10g稀硫酸的质量分数。???
23、某炼铁厂用赤铁矿石炼铁(除氧化铁外,其他成分不溶于水,也不与酸反应),现要测定该赤铁矿中氧化铁的含量,进行如下实验:
(1)写出上述发生反应的化学方程式??? ? ;
(2)列出求解20g赤铁矿石中氧化铁质量(x)的比例式??? ? ;
(3)此赤铁矿中氧化铁的质量分数为???? ;
(4)向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为???? ;
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为???? g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有???? 。
24、向某铁粉样品中,加入溶质质量分数为16%的硫酸铜溶液100g,恰好完全反应,样品中杂质不溶于水也不与硫酸铜反应.请结合他提供的数据计算.
(1)求a的数值 .
(2)向不饱和滤液中加入100.8g水,求所得溶液中溶质的质量分数 .(保留一位小数)
参考答案
一、选择题
1、C
2、B
3、B.
4、B.
5、A.
6、D
7、C
8、A
9、C
二、填空题
10、【答案】(1)延展性 (2)混合物 (3)10.5
(4)①Mn的金属活动性比氢强,Pd和Cu的金属活动性比氢弱”
或“Mn的金属活动性比Pd和Cu强”(其他表述合理均可)
②硫酸铜/氯化铜/硝酸铜
11、【答案】除去金属表面的氧化膜 ?? ? 铁丝的表面有一层红色物质,溶液由蓝色逐渐变为浅绿色 ? ?? Cu
12、【解答】(1)以上几种物质可以分为氧化物、碱和盐三类,其中干冰和生石灰是由两种元素组成的化合物,其中含有氧元素,属于氧化物;火碱、消石灰在电离时,产生的阴离子全部是氢氧根离子,属于碱;亚硝酸钠和氯化铵是由金属阳离子(或铵根离子)与酸根离子构成的化合物,属于盐;故填:氧化物、碱、盐;CO2、CaO;NaOH、Ca(OH)2;NH4Cl、NaNO2;
(2)在金属活动性顺序里,位于前面的金属(K、Ca、Na必须除外)能把位于后面的金属从它们盐的溶液里置换出来。K、Ca、Na必须除外是因为K、Ca、Na盐溶液的反应先是和里面的水的反应生成碱和氢气,生成的碱再与盐反应。钠与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠;故填:前面;2Na+CuSO4+2H2O=Na2SO4+Cu(OH)2↓+H2 ↑。
13、【解答】(1)根据题干所知硬币的组成成分都是金属的合金,所以铸造以上硬币用到的材料都是金属材料;故填:金属材料;
(2)镍与稀硫酸能发生下列反应:Ni+H2SO4═NiSO4+H2↑. 说明镍在氢的前面,镍的化合价为+2价,故镍的活泼性比铜强,镍与硫酸铜反应生成铜和硫酸镍,反应的方程式为:Ni+CuSO4═Cu+NiSO4.
答案:(1)金属材料;(2)Ni+CuSO4═Cu+NiSO4.
14、【解答】(1)钢属于铁的合金;故填:合金;
(2)喷油漆是为了防止铁与水和氧气接触发生反应而生锈,故填:O2、H2O;
(3)保护金属资源的有效途径除了防止金属锈蚀外,还有金属的回收利用;有计划、合理地开采矿物;寻找金属的代用品;故填:ABC;
(4)①由三种金属活动性强弱关系:铁>氢>铜>银,在硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,铁能与硝酸银、硝酸铜依次发生反应。由向滤渣中加入稀盐酸,有气泡冒出,说明铁有剩余,则硝酸银中的银、硝酸铜中的铜已被铁完全置换出来,所以滤渣中含有铁、银和铜;故填:Fe、Ag、Cu;
②由三种金属活动性强弱关系:铁>氢>铜>银,在硝酸银和硝酸铜的混合溶液中,加入一定量的铁粉,铁能与硝酸银、硝酸铜依次发生反应。由向滤渣中加入稀盐酸,无明显现象,则说明铁粉无剩余,滤渣中一定有金属银,滤液中一定硝酸亚铁。因为铁的量如果不足,则滤液中可能有硝酸铜和硝酸银;故填:Fe(NO3)2;AgNO3、Cu(NO3)2。
15、【答案】(1)过滤,漏斗,引流
(2)固体部分溶解,有无色气泡产生,溶液变成绿色,答出“气泡”、“溶液变绿“
(3)NiSO4+Zn=ZnSO4+Ni
(4)Zn>Ni>Cu
16、【答案】(1)①红色固体变黑;??? Fe2O3+3CO===2Fe+3CO2
②收集一氧化碳,防止污染空气(合理即可)
(2)解:设得到纯铁的质量为X。
? Fe2O3+3CO ==== 2Fe+3CO2
160????? ??112
1000t×80%????X
160/1000t×80%=112/X
X=560t
560t/97%=577.3t
答:最终得到生铁约577.3t.
17、【答案】? 增强???????? H2??????? Mg(OH)2
稀盐酸有气泡
Mg(OH)2?? 29:84(84:29)
18、【答案】?(1)b
(2)相同时间内产生气体多少
(3)没有换用不同浓度盐酸多次实验等
(4)温度
19、【解答】(1)①在试管中加入适量的盐酸,插入铁丝,充分反应,产生气泡,溶液由无色变成浅绿色,是因为铁和稀盐酸反应生成氯化亚铁和氢气,即金属活动性顺序中铁排在氢前面;
②在①所得的溶液中,插入铜丝,充分反应,无明显现象,是因为铜不能和氯化亚铁反应,即铁比铜活泼;
③在②所得的溶液中,插入铝丝,充分反应,铝丝表面析出黑色固体,溶液由浅绿色保持无色,是因为铝和氯化亚铁反应生成氯化铝和铁,即铝比铁活泼,实验过程如下所示:
实验步骤 观察到的现象
①在试管中加入适量的盐酸,插入铁丝,充分反应 产生气泡,溶液由无色变成浅绿色
②在①所得的溶液中,插入铜丝,充分反应 无明显现象
③在②所得的溶液中,插入铝丝,充分反应 铝丝表面析出黑色固体,溶液由浅绿色保持无色
(2)将铝丝插入溶液前应进行的简单操作是打磨,以除去表面的氧化膜。
故填:打磨。
(3)小刚同学认为只要在上述实验中补充一个实验,就能得到铝>铁>H>铜的结论,
补充的实验是把铜丝伸入稀盐酸中,无明显现象,说明铜不能和稀盐酸反应,即金属活动性顺序中铜排在氢后面。
故填:把铜丝伸入稀盐酸中,观察现象。
(4)实验①中,铁和稀盐酸反应生成氯化亚铁和氢气,反应的化学方程式为:Fe+2HCl═FeCl2+H2↑。
故填:Fe+2HCl═FeCl2+H2↑。
20、【解答】【作出猜想】红色固体的成分:③既有Cu也有Cu2O.
【实验探究】
(3)红色固体部分减少,推测含有Cu2O,故滴入的应是稀硫酸,氧化亚铜与稀硫酸反应生成硫酸铜、铜和水,故溶液变为蓝色,所以猜想①错误;
由化学方程式Cu2O+H2SO4═Cu+CuSO4+H2O知,每144份质量的氧化亚铜反应会生成64份质量的铜,若有1.44g的氧化亚铜反应会生成0.64g的铜,而实际收集到的铜的质量为1.04g,故1.44g是氧化亚铜和铜的混合物.
【评价反思】
(1)微型实验装置药品用量较少,节约药品;
(2)催化剂能改变其他物质的化学反应速率,而本身的质量和化学性质在化学反应前后不变,故若要证明CaC12是该反应的催化剂,还需要验证CaCl2的质量和化学性质在反应前后不变;
故答案为:【作出猜想】既有Cu也有Cu2O;【实验探究】(3)蓝;①;有红色固体;③;【评价反思】(1)节约药品;(2)质量和化学性质在反应前后不变.
21、【答案】(1)Fe2O3+6HCl==2FeCl3+3H2O
(2)160/219==x/21.9 g
(3)80%
(4)20%
(5)60 g?? 玻璃棒、胶头滴管
22、【答案】(1)解:根据表格可以看出,生成的氢气的质量=0.04g+0.04+0.02g=0.1g
(2)解:设10g硫酸中含有溶质的质量为x,
Zn+ H2SO4=ZnSO4+ H2↑
98 2
x 0.04g
??
x=1.96g,
第二次所用硫酸的质量分数为: ×100%=19.6%。
23、【解答】
该过程发生反应是氧化铁和盐酸反应生成氯化铁和水,对应的化学方程式 Fe2O3+6HCl═2FeCl3+3H2O;
设20g赤铁矿石中氧化铁质量为x,生成的氯化铁的质量为y
消耗的HCl的质量为100g×21.9%=21.9g
Fe2O3+6HCl═2FeCl3+3H2O
160????? 219???? 162.5
x????????? 21.9g?? y
==
x=16g
y=16.25g
此赤铁矿中氧化铁的质量分数为×100%=80%;
向反应后所得溶液中加入46.5g水,则最终溶液中溶质的质量分数为 ×100%=10%;
(5)若用配制100g 21.9%的稀盐酸,则需要36.5%的浓盐酸的质量为=60g;配制稀盐酸时除了需要烧杯、量筒外,还需要的仪器有 玻璃棒、胶头滴管。
24、【解答】(1)设:样品中铁的质量为x,生成铜的质量为y,生成硫酸亚铁的质量为z.
硫酸铜的质量=100g×16%=16g
Fe+CuSO4=FeSO4+Cu
56 160??????? 152???? 64
x?? 16g????????? z?????? y
x=5.6g,y=6.4g,z=15.2g
a=5.6g+(6.8g﹣6.4g)=6g
(2)溶液的质量=5.6g+100g﹣6.4g+100.8g=200g
所得溶液中溶质的质量分数=×100%=7.6%
同课章节目录
