课题2 金属的化学性质:如何设计实验验证金属活动性顺序(共19张PPT)
文档属性
| 名称 | 课题2 金属的化学性质:如何设计实验验证金属活动性顺序(共19张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 471.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-12 10:24:04 | ||
图片预览






文档简介
(共19张PPT)
海兴县第二中学
田树平
如何设计实验验证金属活动性顺序
学习目标
1.初步学会设计实验验证金属活动性的强弱。
2.理解金属活动性顺序的应用。
学具准备
铁丝、铜丝、铝片、CuSO4溶液、盐酸、AlCl3 溶液、 FeCl2溶液、 试管(6支)砂纸、镊子
常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
温故知新
3、在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来(前金换后金)。
金属活动性顺序的应用:
1、在金属活动顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(氢前可换氢)。
讨论:如何判断Fe和Cu活动性强弱?
思考:两种金属活动性强弱探究
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1
2
3
实验方案
现象
结论
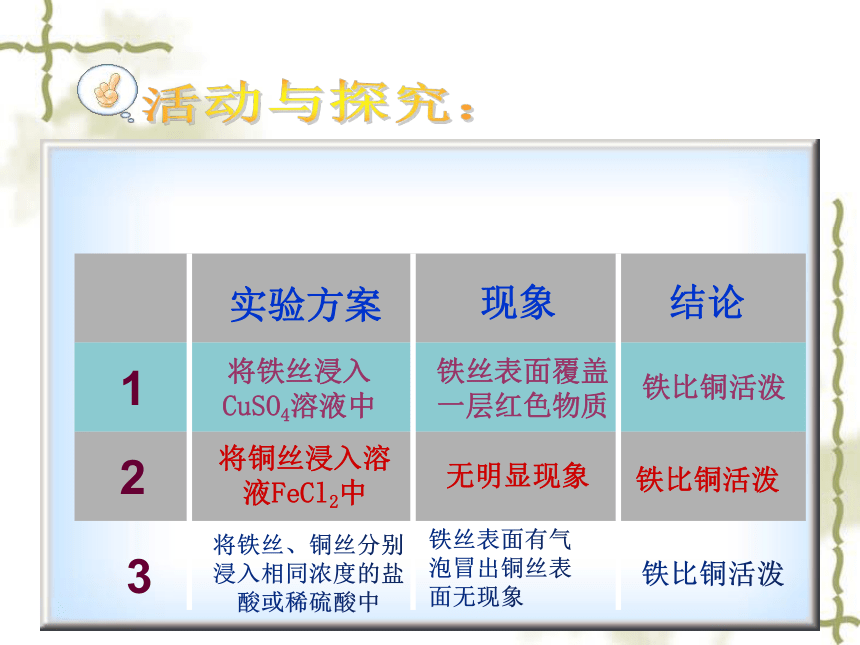
活动与探究:
将铁丝浸入CuSO4溶液中
铁丝表面覆盖一层红色物质
铁比铜活泼
将铜丝浸入溶液FeCl2中
无明显现象
铁比铜活泼
铁丝表面有气泡冒出铜丝表面无现象
铁比铜活泼
将铁丝、铜丝分别浸入相同浓度的盐酸或稀硫酸中
比较两种金属的活动性顺序
(1)根据金属能否与酸反应
(2)根据金属能否与金属化合
物溶液反应
结 论:
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
探究Al、Fe、Cu三种金属的活动性
三种金属活动性强弱探究
活动与探究:
2. 根据金属活动性顺序实验可行的方案
方案① Al、 FeCl2溶液、Cu;
方案② AlCl3溶液、Fe、 CuSO4溶液
方案4 Al、Fe、Cu、稀盐酸、AlCl3溶液、 FeCl2溶液
方案③ Al、FeCl2溶液、Fe、 CuSO4溶液
实验方案
现象 结论
1
2
3
一主两翼
一单两化
铝丝表面有黑色固体覆盖,铜丝表面无现象
Al> Fe> Cu
双龙点头
两单入化
铁丝放入AlCl3溶液
无明显现象,放入CuSO4溶液中中,铁丝表面有红色固体覆盖
Al> Fe> Cu
Al> Fe>H> Cu
Al、Fe、Cu分别与盐酸反应;铝丝放入FeCl2溶液
Al、Fe表面有气泡冒出,Cu表面无现象。
铝丝表面有黑色固体覆盖
以上三种金属活动性顺序为:
Al Fe Cu
金属活动性由强到弱
结论:
只用一支试管,只取一次盐酸也能证明出 Al、Fe、Cu三种金属活动性强弱吗?
学海泛舟
在盐酸中加入金属的顺序是: Fe、 Cu、Al或(Cu、Fe、Al)
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
氢前
氢后
四种金属的活动性顺序探究
讨论:
如何验证Al、Fe、Cu、Ag的活动性?
设计实验
加酸
分组
能反应 Al Fe
不能反应 Cu Ag
再分组比较
把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z (NO3)2溶液中,M加入到YNO3溶液中。反应关系如图2所示。据此判断四种金属的活动性顺序为
A.Z>X>M>Y B.X>Z>M>Y
C.X>Z>Y>M D.Y>M>Z>X
设计实验验证金属活动性顺序
一、两种金属
1、金属+酸(盐酸、稀硫酸)
2、金属1+金属2化合物的溶液
二、三种金属
1、金属1+金属2化合物的溶液
①连续跳跃,依次置换 Al FeCl2 Fe CuSO4
②一主两翼,一单两化 AlCl3 Fe CuSO4
③双龙点头,两单入化 Al FeCl2 Cu
2、三金一酸一盐
三、多种金属
分两步走:
1.加酸分组
2.组内比较
设计实验验证金属活动性强弱的思路
利用以上规律设计一系列的化学反应
※金属+酸(盐酸、稀硫酸)
※金属1+金属2化合物的溶液
一种方法一个思路
一个思路多种方法
创意无限
精彩无限
谢谢合作!
海兴县第二中学
田树平
如何设计实验验证金属活动性顺序
学习目标
1.初步学会设计实验验证金属活动性的强弱。
2.理解金属活动性顺序的应用。
学具准备
铁丝、铜丝、铝片、CuSO4溶液、盐酸、AlCl3 溶液、 FeCl2溶液、 试管(6支)砂纸、镊子
常见金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
温故知新
3、在金属活动顺序里,位于前面的金属能把位于后面的金属从它们化合物的溶液中置换出来(前金换后金)。
金属活动性顺序的应用:
1、在金属活动顺序里,金属的位置越靠前,它的活动性就越强。
2、在金属活动性顺序里,位于氢前面的金属能置换出盐酸、稀硫酸中的氢(氢前可换氢)。
讨论:如何判断Fe和Cu活动性强弱?
思考:两种金属活动性强弱探究
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
1
2
3
实验方案
现象
结论
活动与探究:
将铁丝浸入CuSO4溶液中
铁丝表面覆盖一层红色物质
铁比铜活泼
将铜丝浸入溶液FeCl2中
无明显现象
铁比铜活泼
铁丝表面有气泡冒出铜丝表面无现象
铁比铜活泼
将铁丝、铜丝分别浸入相同浓度的盐酸或稀硫酸中
比较两种金属的活动性顺序
(1)根据金属能否与酸反应
(2)根据金属能否与金属化合
物溶液反应
结 论:
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
探究Al、Fe、Cu三种金属的活动性
三种金属活动性强弱探究
活动与探究:
2. 根据金属活动性顺序实验可行的方案
方案① Al、 FeCl2溶液、Cu;
方案② AlCl3溶液、Fe、 CuSO4溶液
方案4 Al、Fe、Cu、稀盐酸、AlCl3溶液、 FeCl2溶液
方案③ Al、FeCl2溶液、Fe、 CuSO4溶液
实验方案
现象 结论
1
2
3
一主两翼
一单两化
铝丝表面有黑色固体覆盖,铜丝表面无现象
Al> Fe> Cu
双龙点头
两单入化
铁丝放入AlCl3溶液
无明显现象,放入CuSO4溶液中中,铁丝表面有红色固体覆盖
Al> Fe> Cu
Al> Fe>H> Cu
Al、Fe、Cu分别与盐酸反应;铝丝放入FeCl2溶液
Al、Fe表面有气泡冒出,Cu表面无现象。
铝丝表面有黑色固体覆盖
以上三种金属活动性顺序为:
Al Fe Cu
金属活动性由强到弱
结论:
只用一支试管,只取一次盐酸也能证明出 Al、Fe、Cu三种金属活动性强弱吗?
学海泛舟
在盐酸中加入金属的顺序是: Fe、 Cu、Al或(Cu、Fe、Al)
K Ca Na Mg Al Zn Fe Sn Pb〔H〕Cu Hg Ag Pt Au
金属活动性由强逐渐减弱
氢前
氢后
四种金属的活动性顺序探究
讨论:
如何验证Al、Fe、Cu、Ag的活动性?
设计实验
加酸
分组
能反应 Al Fe
不能反应 Cu Ag
再分组比较
把等质量的X、Y、Z、M四种金属分别加入到同体积、同浓度的足量稀盐酸中。再把X加入到Z (NO3)2溶液中,M加入到YNO3溶液中。反应关系如图2所示。据此判断四种金属的活动性顺序为
A.Z>X>M>Y B.X>Z>M>Y
C.X>Z>Y>M D.Y>M>Z>X
设计实验验证金属活动性顺序
一、两种金属
1、金属+酸(盐酸、稀硫酸)
2、金属1+金属2化合物的溶液
二、三种金属
1、金属1+金属2化合物的溶液
①连续跳跃,依次置换 Al FeCl2 Fe CuSO4
②一主两翼,一单两化 AlCl3 Fe CuSO4
③双龙点头,两单入化 Al FeCl2 Cu
2、三金一酸一盐
三、多种金属
分两步走:
1.加酸分组
2.组内比较
设计实验验证金属活动性强弱的思路
利用以上规律设计一系列的化学反应
※金属+酸(盐酸、稀硫酸)
※金属1+金属2化合物的溶液
一种方法一个思路
一个思路多种方法
创意无限
精彩无限
谢谢合作!
同课章节目录
