人教版化学选修3第一章第二节原子结构与元素的性质(共52张PPT)
文档属性
| 名称 | 人教版化学选修3第一章第二节原子结构与元素的性质(共52张PPT) |
|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-13 00:00:00 | ||
图片预览









文档简介
(共52张PPT)
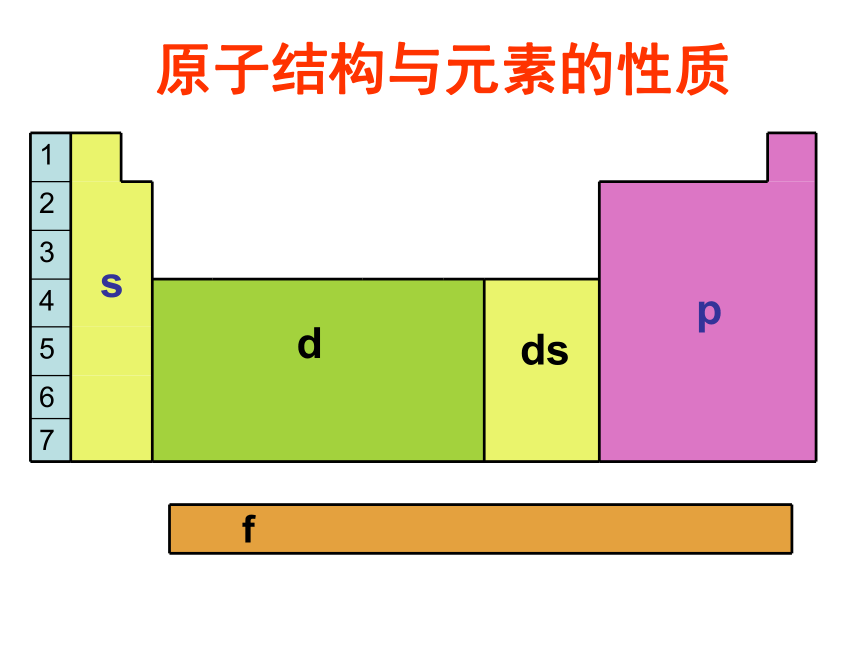
原子结构与元素的性质
s
d
ds
p
f
1
2
3
4
5
6
7
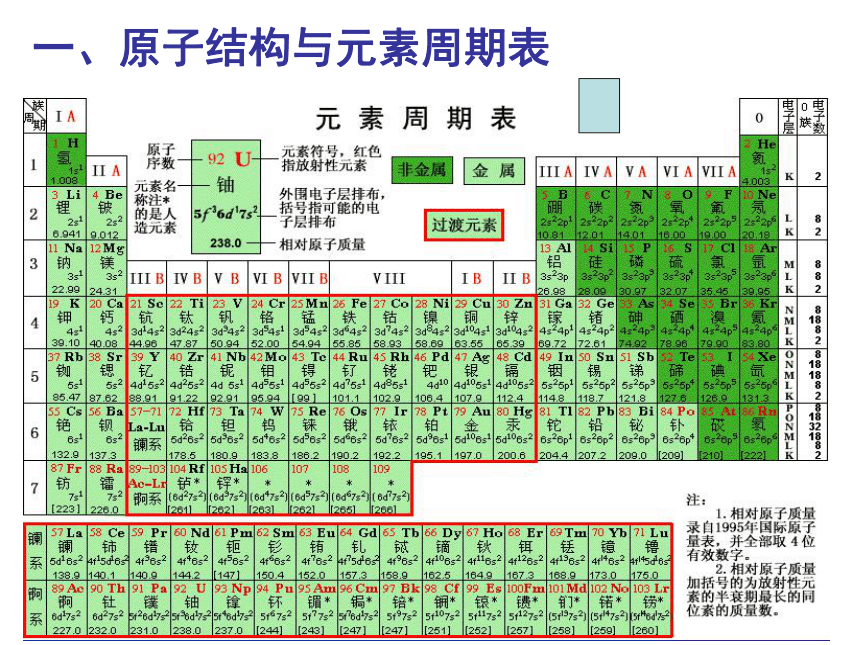
一、原子结构与元素周期表
一、原子结构与元素周期表
复习提问:
1、元素周期表的编排原则?主族元素的原子结构与元素在周期表中的位置有何关系?
2、元素周期表共有几个周期?共有几个族?各周期元素的种数?
3、各族在周期表中的位置?什么叫镧系元素、锕系元素?
问题与思考:
1.除第一周期外,元素周期表中每一周期的第一个元素是什么元素?最后一个元素是什么元素?请写出它们的电子排布式。
2.每一周期元素基态原子电子排布式有什么规律?
3Li
10Ne
11Na
18Ar
19K
36Kr
37Rb
54Xe
55Cs
86Rn
1s22s1
1s22s22p6
1s22s22p63s1
1s22s22p63s23p6
[Ar]4s1
[Ar]3d104s24p6
[Kr]5s1
[Kr] 4d105s25p6
[Xe]6s1
87Fr
118X
[Xe] 4f145d106s26p6
[Rn] 5f146d107s27p6
1H
2He
1s1
1s2
[Rn]7s1
周期 第一种元素 基态原子电子排布式 最后一种元素 基态原子电子排布式
一
二
三
四
五
六
七
2
8
8
18
18
32
32
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
2
8
8
18
18
32
32
周期 元素种数 相应能级组中的原子轨道 电子最大容量
一
二
三
四
五
六
七
问题与思考:
3.写出各主族元素的价电子排布式
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子排布
问题与思考:
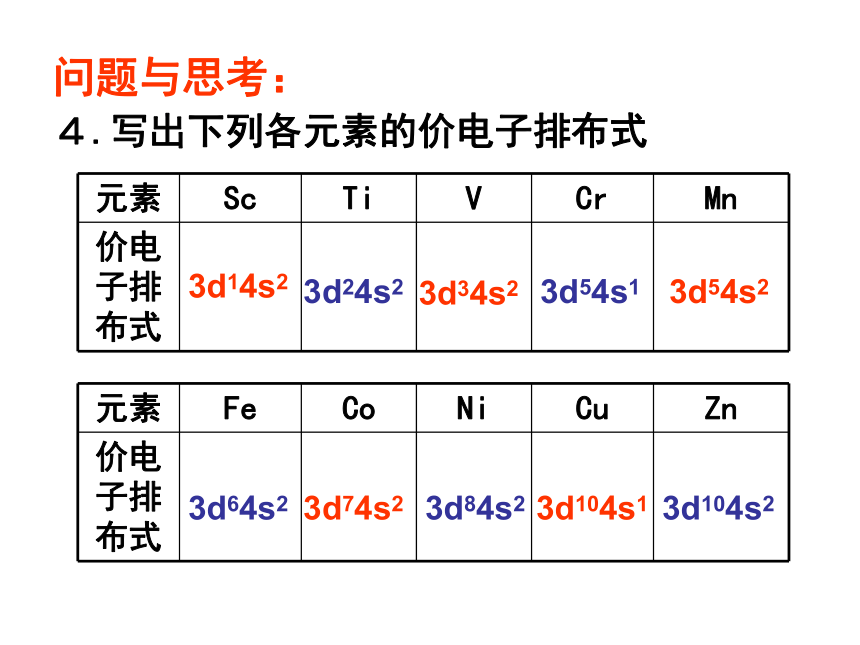
4.写出下列各元素的价电子排布式
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
元素 Sc Ti V Cr Mn
价电子排布式
元素 Fe Co Ni Cu Zn
价电子排布式
按电子排布,可把周期表里的元素划分为5个
区,如图:
科学探究
考察元素周期表,探究下列问题:
s
d
ds
p
f
1
2
3
4
5
6
7
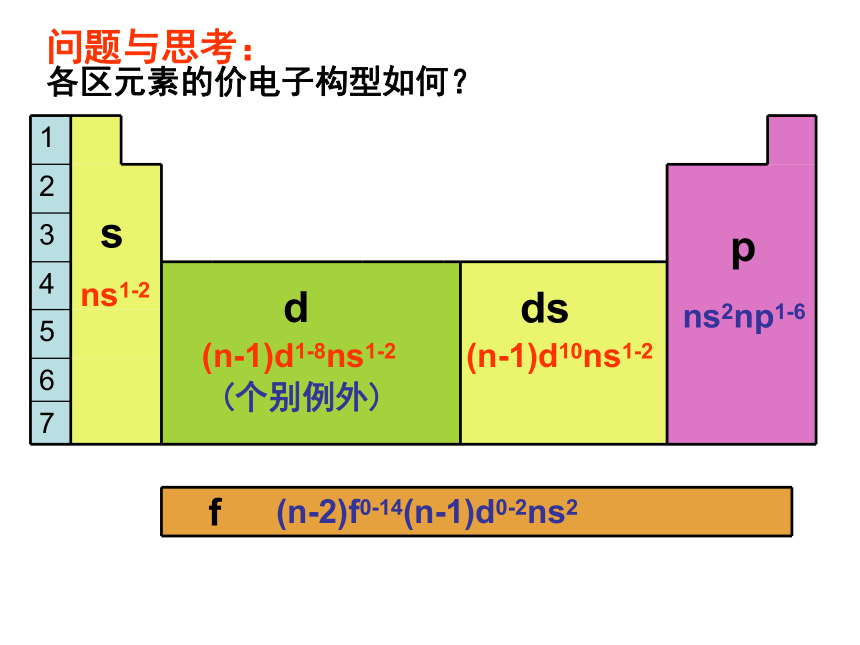
问题与思考:
各区包含哪些元素?
s
d
ds
p
f
ⅠA
ⅡA
ⅢB--ⅦB、Ⅷ
ⅢA--ⅦA、
0族
ⅠB
ⅡB
镧系、锕系
1
2
3
4
5
6
7
问题与思考:
各区元素的价电子构型如何?
ns1-2
(n-1)d1-8ns1-2
(n-1)d10ns1-2
s
d
ds
p
ns2np1-6
f
(n-2)f0-14(n-1)d0-2ns2
(个别例外)
1
2
3
4
5
6
7
问题与思考:
如何根据原子的价电子构型判断元素在周期表中位置?
价电子构型 4s1 3d3 4s2 4d55s1 5d76s2 4s24p5
位置
位置 5周期
ⅡA族 4周期
ⅥA族 7周期
ⅣB族 6周期
ⅡB族 5周期
ⅠB族
价电子构型
问题与思考:
金属与非金属的分区?
“硼-砹”分界线
小结:
元素周期系的周期性变化并不是单调的重复,而象螺壳上的螺旋。
原子结构的周期性变化
元素性质的周期性变化
表现形式
元素周期表
小结:
科学探究:
科学史话:
p14
p15
二、元素周期律
复习提问:
什么叫元素周期律?元素周期律的内容?元素周期律的本质?
元素周期律是指元素的性质随着原子序数的递增而周期性的变化规律
本质:元素性质的周期性变化是原子核外电子排布周期性变化的必然结果
二、元素周期律
原子的核外电子排布
原子半径
原子半径的变化规律:
同周期主族元素从左到右,原子半径( )
逐渐减小
同主族元素的原子半径从上到下( )
逐渐增大
原子半径的大小
取决于
1、电子的能层数
2、核电荷数
影响原子半径的因素?
比较下列微粒的半径的大小:
(1) Ca AI
(2) Na+ Na
(3) Cl- Cl
(4)K+ Ca2+ S2- CI-
>
<
>
S2->CI->K+>Ca2+
元素主要化合价
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
主要化合价
氢化物化学式
最高价氧化物化学式
最高价氧化物的水化物化学式
元素的金属性与非金属性
什么叫元素的金属性与非金属性?
同周期、同主族元素的金属性与非金属性的递变规律?
如何验证元素的金属性与非金属性?
电离能
(1)概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能。用符号I1表示,单位:kj/mol
从一价气态基态正离子中再失去一个电子所需要的能量叫做第二电离能。符号I2
观察图1-21,总结电离能的变化规律:
(2)元素第一电离能的变化规律:
同周期从左到右呈现逐渐增大的趋势(最小的是碱金属,最大的是稀有气体的元素;第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素)(第ⅡA元素和第ⅤA元素的反常现象如何解释?)
同主族的元素自上而下第一电离能逐渐减少.
电离能是衡量气态原子失去电子难易的物理量。元素的电离能越小,表示气态时越容易失去电子,即元素在气态时的金属性越强。
(3)电离能的意义:
1.碱金属的电离能与碱金属的活泼性存在什么关系?
碱金属元素的 第一电离能越小,金属的活泼性就越强。
学与问:
2.为什么原子逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有何关系?数据的突跃变化说明了什么?
因为随着电子的失去,阳离子所带的正电荷越来越大,再失去一个电子需克服的电性引力越来越大,消耗的能量越来越多。
同种元素I1﹤I2﹤I3﹤I4﹤……
同周期元素从左到右第一电离能呈现逐渐增大的趋势
同主族元素自上而下第一电离能逐渐减少
结论:
课堂练习:
下列说法正确的是 ( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大.
D.钾的第一电离能比镁的第一电离能大.
A
电负性
(1)基本概念
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,形象地叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子
电负性:
元素的原子在化合物中吸引键合电子的标度,电负性是相对值,没单位。
标准 F:4.0 Li: 1.0
电负性
(2)元素电负性变化规律:
(2)元素电负性变化规律:
随核电荷数增大元素的电负性呈周期性变化
同周期从左到右电负性逐渐增大
同主族从上到下电负性逐渐减小。
金属与非金属区分:
(3)电负性的应用:
化学键的类型:
一般以电负性差1.7为标准
小于1.7为共价键
大于1.7为离子键
同周期
同主族
电负性的大小也可以作为判断金属性和非金属性强弱的尺度下列关于电负性的变化规律正确的是 ( )
A.周期表从左到右,元素的电负性逐渐变大
B.周期表从上到下,元素的电负性逐渐变大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOHB.第一电离能:NaC.电负性:Na>Mg>Al
D.还原性:Na>Mg>Al
科学探究(对角线规则)
在空气中燃烧产物:Li2O
在空气中燃烧产物:MgO
在空气中燃烧产物:Na2O2
Be(OH)2两性氢氧化物
Al(OH)3两性氢氧化物
H3BO3 酸性很弱
H2SiO3酸性很弱
Mg(OH)2中强碱
Li Be B
Na Mg Al Si
外围电子构型为4f75d16s2元素在周期表中的位置是
A.四周期ⅦB族
B.五周期ⅢB族
C.六周期ⅦB族
D.六周期ⅢB族
外围电子构型为3d104s1的元素在周期表中的位置是
A.第四周期ⅠB族????????????????
B.第五周期ⅡB族
C.第四周期ⅦB族????????????????
D.第五周期ⅢB族
已知某原子的电子排布是
1s22s22p63s23p63d104s24p1。 (1)这元素的原子序数是多少? (2)这元素属第几周期? 第几族?是主族元素还是过渡元素? (3)哪些电子是这个原子的价电子。
某周期ⅡA族元素的原子序数为 x,则同周期的Ⅲ族元素的原子序数是
A.只有 x +1
B.可能是 x +8或 x +18
C.可能是 x +2
D.可能是 x +1或 x +11或 x +25
根据下列原子基态时的最外层电子排布,不能确定该元素在元素周期表中所在族的是A.ns2 B.ns23p1 C.ns2np6 D.ns2np3
下面的电子结构中,第一电离能最小的原子可能是 ( )
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
Li、Be、B原子失去一个电子,所需要的能量相差不是很大, 但最难失去第二个电子的原子估计是A. Li???????? B. Be????????? C.B?????????? D. 都相同
已知某元素的电离能(IA/kJ/mol):I1=577;I2=1820;I3=2740;I4=11600;I5=14800;I6=18400;I7=23400,试回答:
(1)该元素原子失去的第一个电子具有的能量是多少?
(2)该元素原子最外层有几个电子?
五种元素的原子电子层结构如下:A.1s22s1 ;B.1s22s22p4 ;C.1s22s22p6; D.1s22s22p63s23p2 E.[Ar]3d104s1。
(1)元素的第一电离能最大的是 ;
(2)属于过渡元素的是 ;
(3)元素的电负性最大的是 ;
(4)上述元素之间能形成X2Y型化合物的化学式是 。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ/mol):
①为什么锂原子的第二电离能远远大于第一电离能 。
电离能 锂 X Y
I1 519 502 580
I2 7296 4570 1820
I3 11799 6920 2750
I4 9550 11600
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅥA
ⅤA
ⅣA
ⅢA
ⅦA
0
ⅥB
ⅤB
ⅣB
ⅢB
ⅦB
ⅠB
Ⅷ
ⅡB
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅥA
ⅤA
ⅣA
ⅢA
ⅦA
0
ⅥB
ⅤB
ⅣB
ⅢB
ⅦB
H
Li
Na
K
Rb
Cs
Fr
Be
Mg
Ca
Sr
Ba
Ra
B
Al
Ga
In
Tl
113
C
Si
Ge
Sn
Pb
114
N
P
ⅠB
ⅡB
Ⅷ
As
Sb
Bi
115
O
S
Se
Te
Po
116
F
Cl
Br
I
At
117
He
Ne
Ar
Kr
Xe
Rn
118
57
71
89
103
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
原子结构与元素的性质
s
d
ds
p
f
1
2
3
4
5
6
7
一、原子结构与元素周期表
一、原子结构与元素周期表
复习提问:
1、元素周期表的编排原则?主族元素的原子结构与元素在周期表中的位置有何关系?
2、元素周期表共有几个周期?共有几个族?各周期元素的种数?
3、各族在周期表中的位置?什么叫镧系元素、锕系元素?
问题与思考:
1.除第一周期外,元素周期表中每一周期的第一个元素是什么元素?最后一个元素是什么元素?请写出它们的电子排布式。
2.每一周期元素基态原子电子排布式有什么规律?
3Li
10Ne
11Na
18Ar
19K
36Kr
37Rb
54Xe
55Cs
86Rn
1s22s1
1s22s22p6
1s22s22p63s1
1s22s22p63s23p6
[Ar]4s1
[Ar]3d104s24p6
[Kr]5s1
[Kr] 4d105s25p6
[Xe]6s1
87Fr
118X
[Xe] 4f145d106s26p6
[Rn] 5f146d107s27p6
1H
2He
1s1
1s2
[Rn]7s1
周期 第一种元素 基态原子电子排布式 最后一种元素 基态原子电子排布式
一
二
三
四
五
六
七
2
8
8
18
18
32
32
1s
2s 2p
3s 3p
4s 3d 4p
5s 4d 5p
6s 4f 5d 6p
7s 5f 6d 7p
2
8
8
18
18
32
32
周期 元素种数 相应能级组中的原子轨道 电子最大容量
一
二
三
四
五
六
七
问题与思考:
3.写出各主族元素的价电子排布式
ns1
ns2
ns2np1
ns2np2
ns2np3
ns2np4
ns2np5
族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
价电子排布
问题与思考:
4.写出下列各元素的价电子排布式
3d14s2
3d24s2
3d34s2
3d54s1
3d54s2
3d64s2
3d74s2
3d84s2
3d104s1
3d104s2
元素 Sc Ti V Cr Mn
价电子排布式
元素 Fe Co Ni Cu Zn
价电子排布式
按电子排布,可把周期表里的元素划分为5个
区,如图:
科学探究
考察元素周期表,探究下列问题:
s
d
ds
p
f
1
2
3
4
5
6
7
问题与思考:
各区包含哪些元素?
s
d
ds
p
f
ⅠA
ⅡA
ⅢB--ⅦB、Ⅷ
ⅢA--ⅦA、
0族
ⅠB
ⅡB
镧系、锕系
1
2
3
4
5
6
7
问题与思考:
各区元素的价电子构型如何?
ns1-2
(n-1)d1-8ns1-2
(n-1)d10ns1-2
s
d
ds
p
ns2np1-6
f
(n-2)f0-14(n-1)d0-2ns2
(个别例外)
1
2
3
4
5
6
7
问题与思考:
如何根据原子的价电子构型判断元素在周期表中位置?
价电子构型 4s1 3d3 4s2 4d55s1 5d76s2 4s24p5
位置
位置 5周期
ⅡA族 4周期
ⅥA族 7周期
ⅣB族 6周期
ⅡB族 5周期
ⅠB族
价电子构型
问题与思考:
金属与非金属的分区?
“硼-砹”分界线
小结:
元素周期系的周期性变化并不是单调的重复,而象螺壳上的螺旋。
原子结构的周期性变化
元素性质的周期性变化
表现形式
元素周期表
小结:
科学探究:
科学史话:
p14
p15
二、元素周期律
复习提问:
什么叫元素周期律?元素周期律的内容?元素周期律的本质?
元素周期律是指元素的性质随着原子序数的递增而周期性的变化规律
本质:元素性质的周期性变化是原子核外电子排布周期性变化的必然结果
二、元素周期律
原子的核外电子排布
原子半径
原子半径的变化规律:
同周期主族元素从左到右,原子半径( )
逐渐减小
同主族元素的原子半径从上到下( )
逐渐增大
原子半径的大小
取决于
1、电子的能层数
2、核电荷数
影响原子半径的因素?
比较下列微粒的半径的大小:
(1) Ca AI
(2) Na+ Na
(3) Cl- Cl
(4)K+ Ca2+ S2- CI-
>
<
>
S2->CI->K+>Ca2+
元素主要化合价
主族 ⅠA ⅡA ⅢA ⅣA ⅤA ⅥA ⅦA
主要化合价
氢化物化学式
最高价氧化物化学式
最高价氧化物的水化物化学式
元素的金属性与非金属性
什么叫元素的金属性与非金属性?
同周期、同主族元素的金属性与非金属性的递变规律?
如何验证元素的金属性与非金属性?
电离能
(1)概念
气态电中性基态原子失去一个电子转化为气态基态正离子所需要的能量叫做第一电离能。用符号I1表示,单位:kj/mol
从一价气态基态正离子中再失去一个电子所需要的能量叫做第二电离能。符号I2
观察图1-21,总结电离能的变化规律:
(2)元素第一电离能的变化规律:
同周期从左到右呈现逐渐增大的趋势(最小的是碱金属,最大的是稀有气体的元素;第ⅡA元素>ⅢA的元素;第ⅤA元素>ⅥA元素)(第ⅡA元素和第ⅤA元素的反常现象如何解释?)
同主族的元素自上而下第一电离能逐渐减少.
电离能是衡量气态原子失去电子难易的物理量。元素的电离能越小,表示气态时越容易失去电子,即元素在气态时的金属性越强。
(3)电离能的意义:
1.碱金属的电离能与碱金属的活泼性存在什么关系?
碱金属元素的 第一电离能越小,金属的活泼性就越强。
学与问:
2.为什么原子逐级电离能越来越大?这些数据跟钠、镁、铝的化合价有何关系?数据的突跃变化说明了什么?
因为随着电子的失去,阳离子所带的正电荷越来越大,再失去一个电子需克服的电性引力越来越大,消耗的能量越来越多。
同种元素I1﹤I2﹤I3﹤I4﹤……
同周期元素从左到右第一电离能呈现逐渐增大的趋势
同主族元素自上而下第一电离能逐渐减少
结论:
课堂练习:
下列说法正确的是 ( )
A.第3周期所含的元素中钠的第一电离能最小
B.铝的第一电离能比镁的第一电离能大
C.在所有元素中,氟的第一电离能最大.
D.钾的第一电离能比镁的第一电离能大.
A
电负性
(1)基本概念
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,形象地叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子
电负性:
元素的原子在化合物中吸引键合电子的标度,电负性是相对值,没单位。
标准 F:4.0 Li: 1.0
电负性
(2)元素电负性变化规律:
(2)元素电负性变化规律:
随核电荷数增大元素的电负性呈周期性变化
同周期从左到右电负性逐渐增大
同主族从上到下电负性逐渐减小。
金属与非金属区分:
(3)电负性的应用:
化学键的类型:
一般以电负性差1.7为标准
小于1.7为共价键
大于1.7为离子键
同周期
同主族
电负性的大小也可以作为判断金属性和非金属性强弱的尺度下列关于电负性的变化规律正确的是 ( )
A.周期表从左到右,元素的电负性逐渐变大
B.周期表从上到下,元素的电负性逐渐变大
C.电负性越大,金属性越强
D.电负性越小,非金属性越强
对Na、Mg、Al的有关性质的叙述正确的是 ( )
A.碱性:NaOH
D.还原性:Na>Mg>Al
科学探究(对角线规则)
在空气中燃烧产物:Li2O
在空气中燃烧产物:MgO
在空气中燃烧产物:Na2O2
Be(OH)2两性氢氧化物
Al(OH)3两性氢氧化物
H3BO3 酸性很弱
H2SiO3酸性很弱
Mg(OH)2中强碱
Li Be B
Na Mg Al Si
外围电子构型为4f75d16s2元素在周期表中的位置是
A.四周期ⅦB族
B.五周期ⅢB族
C.六周期ⅦB族
D.六周期ⅢB族
外围电子构型为3d104s1的元素在周期表中的位置是
A.第四周期ⅠB族????????????????
B.第五周期ⅡB族
C.第四周期ⅦB族????????????????
D.第五周期ⅢB族
已知某原子的电子排布是
1s22s22p63s23p63d104s24p1。 (1)这元素的原子序数是多少? (2)这元素属第几周期? 第几族?是主族元素还是过渡元素? (3)哪些电子是这个原子的价电子。
某周期ⅡA族元素的原子序数为 x,则同周期的Ⅲ族元素的原子序数是
A.只有 x +1
B.可能是 x +8或 x +18
C.可能是 x +2
D.可能是 x +1或 x +11或 x +25
根据下列原子基态时的最外层电子排布,不能确定该元素在元素周期表中所在族的是A.ns2 B.ns23p1 C.ns2np6 D.ns2np3
下面的电子结构中,第一电离能最小的原子可能是 ( )
A. ns2np3 B. ns2np5 C. ns2np4 D. ns2np6
Li、Be、B原子失去一个电子,所需要的能量相差不是很大, 但最难失去第二个电子的原子估计是A. Li???????? B. Be????????? C.B?????????? D. 都相同
已知某元素的电离能(IA/kJ/mol):I1=577;I2=1820;I3=2740;I4=11600;I5=14800;I6=18400;I7=23400,试回答:
(1)该元素原子失去的第一个电子具有的能量是多少?
(2)该元素原子最外层有几个电子?
五种元素的原子电子层结构如下:A.1s22s1 ;B.1s22s22p4 ;C.1s22s22p6; D.1s22s22p63s23p2 E.[Ar]3d104s1。
(1)元素的第一电离能最大的是 ;
(2)属于过渡元素的是 ;
(3)元素的电负性最大的是 ;
(4)上述元素之间能形成X2Y型化合物的化学式是 。
下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
(1)下列 (填写编号)组元素的单质具有良好导电性。
①a、c、h ②b、g、k ③c、h、1 ④d、e、f
(2)下表是一些气态原子失去核外不同电子所需的能量,(即电离能,单位为kJ/mol):
①为什么锂原子的第二电离能远远大于第一电离能 。
电离能 锂 X Y
I1 519 502 580
I2 7296 4570 1820
I3 11799 6920 2750
I4 9550 11600
②表中X可能为以上13种元素中的 (填写字母)元素。用元素符号表示X和j形成化合物的化学式 。
③Y是周期表中 族元素。
1
2
3
4
5
6
7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
17
18
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅥA
ⅤA
ⅣA
ⅢA
ⅦA
0
ⅥB
ⅤB
ⅣB
ⅢB
ⅦB
ⅠB
Ⅷ
ⅡB
1
2
3
4
5
6
7
ⅠA
ⅡA
ⅥA
ⅤA
ⅣA
ⅢA
ⅦA
0
ⅥB
ⅤB
ⅣB
ⅢB
ⅦB
H
Li
Na
K
Rb
Cs
Fr
Be
Mg
Ca
Sr
Ba
Ra
B
Al
Ga
In
Tl
113
C
Si
Ge
Sn
Pb
114
N
P
ⅠB
ⅡB
Ⅷ
As
Sb
Bi
115
O
S
Se
Te
Po
116
F
Cl
Br
I
At
117
He
Ne
Ar
Kr
Xe
Rn
118
57
71
89
103
Sc
Ti
V
Cr
Mn
Fe
Co
Ni
Cu
Zn
