沪教版(上海)九年级化学下6.2.1盐的化学性质(第一课时)教学课件 (共15张PPT)
文档属性
| 名称 | 沪教版(上海)九年级化学下6.2.1盐的化学性质(第一课时)教学课件 (共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 129.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版(试用本) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-14 16:14:27 | ||
图片预览






文档简介
(共15张PPT)
盐的化学性质
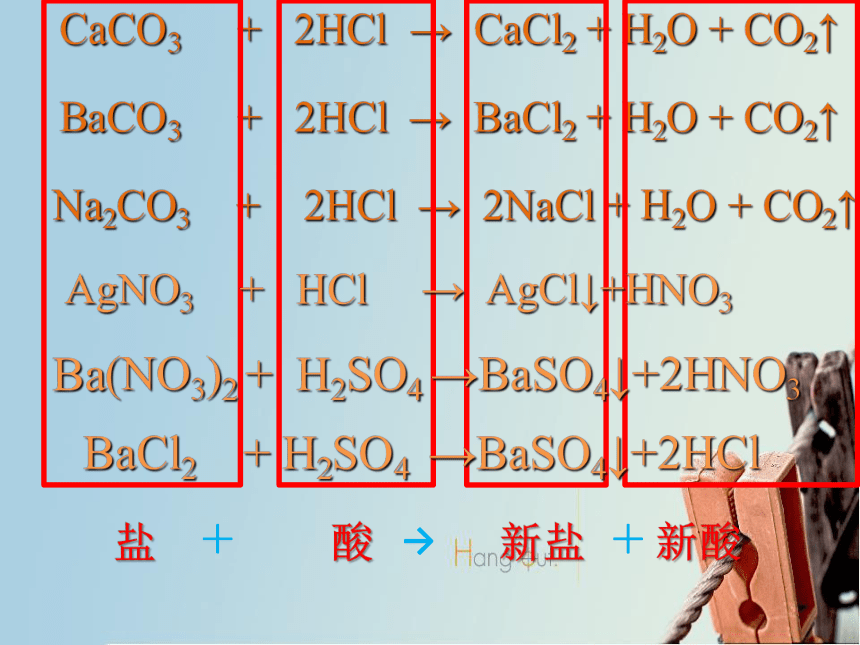
CaCO3 + 2HCl→CaCl2 + H2O + CO2↑
BaCO3 + 2HCl→BaCl2 + H2O + CO2↑
现象:
白色固体溶解,冒气泡
Na2CO3+ 2HCl→2NaCl + H2O + CO2↑
现象:
冒气泡
1、检验CO3
操作:先加入_______溶液,再通入_______
现象:________________________
盐酸
碳酸盐
新盐
新酸
H2CO3
+ → +
石灰水
盐酸
冒气泡
,石灰水变浑浊
盐酸和硝酸盐的反应:
①稀HCl与AgNO3溶液
HCl + AgNO3→
AgCl + HNO3
↓
现象:
白色沉淀
滴加AgNO3
沉淀不溶解
检验盐酸:
滴加稀HNO3
Ag2CO3
AgNO3
先白↓
2、检验Cl
操作:先加入___________溶液,再加_______
现象:________________________
稀HNO3
,后白↓不溶解
硫酸与钡盐的反应:
②稀H2SO4与Ba(NO3)2溶液
H2SO4 + Ba(NO3)2 →
BaSO4 +2HNO3
↓
现象:
白色沉淀
滴加Ba(NO3)2
沉淀不溶解
检验硫酸:
滴加稀HNO3
BaCO3
稀H2SO4与BaCl2溶液
H2SO4 + BaCl2 →BaSO4↓+2HCl
滴加BaCl2
BaCl2/Ba(NO3)2
稀HNO3
先白↓
3、检验SO4
操作:先加入_____________溶液,再加_______
现象: _____________________________________
,后白↓不溶解
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
盐
酸
新盐
新酸
+ → +
AgNO3 + HCl → AgCl↓+HNO3
Ba(NO3)2 + H2SO4 →BaSO4↓+2HNO3
BaCl2 + H2SO4 →BaSO4↓+2HCl
1、下列盐中,不溶于水也不“溶”于稀硝酸的是( )
A、碳酸钙 B、氯化钙
C、碳酸钠 D、氯化银
D
巩固练习一
CaCO3
CaCl2
Na2CO3
AgCl
巩固练习一
2、鉴别稀盐酸和稀硫酸,需加入的试剂为( )
A、硝酸银溶液 B、酚酞试液
C、氯化钡溶液 D、石蕊试液
C
AgNO3
BaCl2
HCl
H2SO4
鉴别稀硫酸和稀盐酸
取样,分别加入BaCl2/Ba(NO3)2 溶液
有白色沉淀的是稀硫酸,无现象的是稀盐酸
巩固练习一
3、稀盐酸中加入下列哪种药品,pH值无明显改变( )
A、澄清石灰水 B、碳酸钠溶液
C、硝酸银溶液 D、大理石
A
Ca(OH)2
Na2CO3
AgNO3
CaCO3
HCl + AgNO3→ AgCl↓+HNO3
CaCO3 + 2HCl→CaCl2 + H2O + CO2↑
巩固练习二
1、在某溶液中,加入氯化钡溶液和稀硝酸,
产生白色沉淀,原溶液一定含有硫酸根
( )
×
SO4
AgCl
BaCl2
AgNO3
BaSO4
巩固练习二
2、盐酸中混有少量硫酸,如何除杂?
加入____量(填过量、适量、少量)
______ (硝酸钡、氯化钡、硝酸银)
适
氯化钡
H2SO4 + BaCl2 →BaSO4↓+2HCl
H2SO4 + Ba(NO3)2 →BaSO4↓+2HNO3
巩固练习二
3、一瓶酸溶液中含有HCl和H2SO4,设计实验证明其溶质
取样,加入足量Ba(NO3)2溶液,有白色沉淀,
说明有H2SO4;
过滤后取滤液,滴加AgNO3,有白色沉淀,
说明有HCl
总结:
1、补充盐的性质:
2、检验盐酸 、
硫酸
3、盐酸中混有硫酸(除杂)
4、混合溶液中硫酸根、盐酸根的检验
根
根
试剂的种类
盐+酸→新盐+新酸
滴加AgNO3,后滴加稀HNO3
滴加Ba(NO3)2,后滴加稀HNO3
BaCl2
加入适量BaCl2
顺序
用量
先SO4,再Cl
Ba(NO3)2
AgNO3
足量/过量
思考:NaCl能否和AgNO3 ,Na2SO4能否和BaCl2反应
盐的化学性质
CaCO3 + 2HCl→CaCl2 + H2O + CO2↑
BaCO3 + 2HCl→BaCl2 + H2O + CO2↑
现象:
白色固体溶解,冒气泡
Na2CO3+ 2HCl→2NaCl + H2O + CO2↑
现象:
冒气泡
1、检验CO3
操作:先加入_______溶液,再通入_______
现象:________________________
盐酸
碳酸盐
新盐
新酸
H2CO3
+ → +
石灰水
盐酸
冒气泡
,石灰水变浑浊
盐酸和硝酸盐的反应:
①稀HCl与AgNO3溶液
HCl + AgNO3→
AgCl + HNO3
↓
现象:
白色沉淀
滴加AgNO3
沉淀不溶解
检验盐酸:
滴加稀HNO3
Ag2CO3
AgNO3
先白↓
2、检验Cl
操作:先加入___________溶液,再加_______
现象:________________________
稀HNO3
,后白↓不溶解
硫酸与钡盐的反应:
②稀H2SO4与Ba(NO3)2溶液
H2SO4 + Ba(NO3)2 →
BaSO4 +2HNO3
↓
现象:
白色沉淀
滴加Ba(NO3)2
沉淀不溶解
检验硫酸:
滴加稀HNO3
BaCO3
稀H2SO4与BaCl2溶液
H2SO4 + BaCl2 →BaSO4↓+2HCl
滴加BaCl2
BaCl2/Ba(NO3)2
稀HNO3
先白↓
3、检验SO4
操作:先加入_____________溶液,再加_______
现象: _____________________________________
,后白↓不溶解
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
BaCO3 + 2HCl → BaCl2 + H2O + CO2↑
Na2CO3 + 2HCl → 2NaCl + H2O + CO2↑
盐
酸
新盐
新酸
+ → +
AgNO3 + HCl → AgCl↓+HNO3
Ba(NO3)2 + H2SO4 →BaSO4↓+2HNO3
BaCl2 + H2SO4 →BaSO4↓+2HCl
1、下列盐中,不溶于水也不“溶”于稀硝酸的是( )
A、碳酸钙 B、氯化钙
C、碳酸钠 D、氯化银
D
巩固练习一
CaCO3
CaCl2
Na2CO3
AgCl
巩固练习一
2、鉴别稀盐酸和稀硫酸,需加入的试剂为( )
A、硝酸银溶液 B、酚酞试液
C、氯化钡溶液 D、石蕊试液
C
AgNO3
BaCl2
HCl
H2SO4
鉴别稀硫酸和稀盐酸
取样,分别加入BaCl2/Ba(NO3)2 溶液
有白色沉淀的是稀硫酸,无现象的是稀盐酸
巩固练习一
3、稀盐酸中加入下列哪种药品,pH值无明显改变( )
A、澄清石灰水 B、碳酸钠溶液
C、硝酸银溶液 D、大理石
A
Ca(OH)2
Na2CO3
AgNO3
CaCO3
HCl + AgNO3→ AgCl↓+HNO3
CaCO3 + 2HCl→CaCl2 + H2O + CO2↑
巩固练习二
1、在某溶液中,加入氯化钡溶液和稀硝酸,
产生白色沉淀,原溶液一定含有硫酸根
( )
×
SO4
AgCl
BaCl2
AgNO3
BaSO4
巩固练习二
2、盐酸中混有少量硫酸,如何除杂?
加入____量(填过量、适量、少量)
______ (硝酸钡、氯化钡、硝酸银)
适
氯化钡
H2SO4 + BaCl2 →BaSO4↓+2HCl
H2SO4 + Ba(NO3)2 →BaSO4↓+2HNO3
巩固练习二
3、一瓶酸溶液中含有HCl和H2SO4,设计实验证明其溶质
取样,加入足量Ba(NO3)2溶液,有白色沉淀,
说明有H2SO4;
过滤后取滤液,滴加AgNO3,有白色沉淀,
说明有HCl
总结:
1、补充盐的性质:
2、检验盐酸 、
硫酸
3、盐酸中混有硫酸(除杂)
4、混合溶液中硫酸根、盐酸根的检验
根
根
试剂的种类
盐+酸→新盐+新酸
滴加AgNO3,后滴加稀HNO3
滴加Ba(NO3)2,后滴加稀HNO3
BaCl2
加入适量BaCl2
顺序
用量
先SO4,再Cl
Ba(NO3)2
AgNO3
足量/过量
思考:NaCl能否和AgNO3 ,Na2SO4能否和BaCl2反应
