2020届中考复习浙教版科学讲义:八年级下册 6 质量守恒定律
文档属性
| 名称 | 2020届中考复习浙教版科学讲义:八年级下册 6 质量守恒定律 |

|
|
| 格式 | zip | ||
| 文件大小 | 387.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-01-14 00:00:00 | ||
图片预览




文档简介
第6课时 质量守恒定律 [学生用书P68]
一、质量守恒定律(b)
1.宏观表现:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
2.微观解释:化学反应前后原子的种类__没有改变__,原子的数目__没有改变__。
3.普遍性:一切化学反应都遵循质量守恒定律。
4.适用性:质量守恒定律对化学反应有意义,对物理变化无意义。
5.质量守恒:质量守恒定律只适用于化学反应前后质量守恒,而不是体积或分子数守恒。
6.质量分析:在反应前的各物质的质量总和,不包括过量的反应物质量。
二、化学方程式(b)
1.书写:
①以__质量守恒定律__和__客观事实__为依据,使化学方程式左、右两边各原子的种类与数目必须__相等__。
②说明反应条件。
③反应前没有气体(或沉淀)的,需在生成的气体(或沉淀)后面标注气体(或沉淀)符号。
2.读法:以C+O2CO2为例,读法为:
①质的读法:碳在氧气中完全燃烧生成二氧化碳。
②量的读法:每12份质量的碳和32份质量的氧气在点燃的条件下完全反应,可生成44份质量的二氧化碳。
③微观读法:每一个碳原子和一个氧气分子在点燃的条件下反应生成一个二氧化碳分子。
三、根据化学方程式计算(c)
理论基础:质量守恒定律。
1.根据化学方程式计算
(1)基本依据:各反应物与生成物之间的质量比等于各反应物和生成物的式量比。
(2)化学计算的一般步骤:
①根据题意假设未知量;
②写出正确的化学方程式;
③求出有关物质间的质量比;
④列出比例式;
⑤求出未知量;
⑥写出答案。
(3)化学计算的基本类型:
①有关纯净物之间的计算;
②有关含杂质的计算;
③有关多步反应的计算;
④有关混合物反应的计算;
⑤有关无数据或少数据的计算;
⑥有关溶液质量分数的综合计算。
2.根据质量守恒定律解题
(1)原理:质量守恒定律。
(2)解答:常结合微观原理解答,化学反应前后原子的种类和数目没有改变。
【知识拓展】
1.解题时应明确有关物质间的转化关系。
2.解答时要规范、完整、正确。
类型一 质量守恒定律的验证
典例1 [2019·绍兴]材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
图6-1
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:__铁丝在氧气中燃烧后质量会增加(合理即可)__。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自__空气__的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是__打开容器前没有称量容器的总质量__。
(4)质量守恒定律的发现过程,给我们的启示是__ACD__。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
跟踪训练1 [淮安中考]质量守恒定律的发现对科学的发展作出了巨大贡献。
图6-2
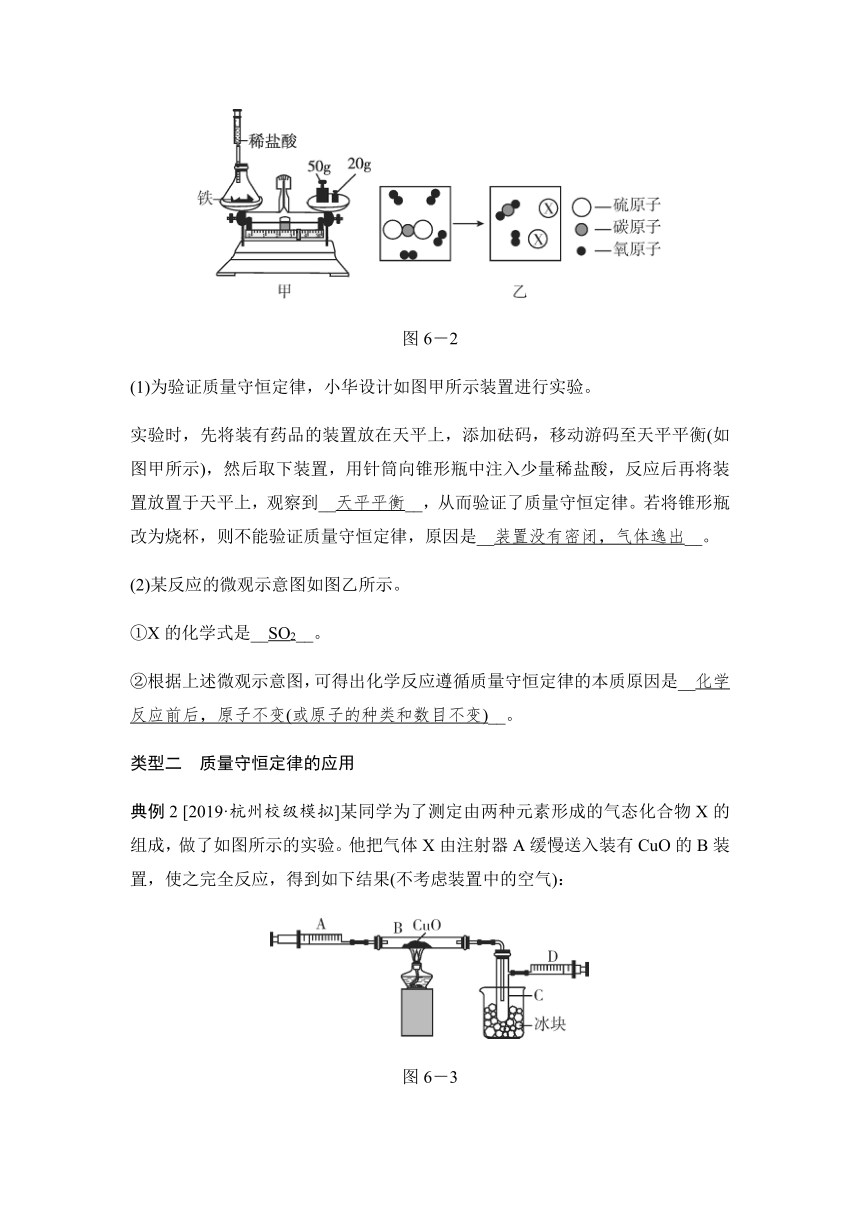
(1)为验证质量守恒定律,小华设计如图甲所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图甲所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到__天平平衡__,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是__装置没有密闭,气体逸出__。
(2)某反应的微观示意图如图乙所示。
①X的化学式是__SO2__。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是__化学反应前后,原子不变(或原子的种类和数目不变)__。
类型二 质量守恒定律的应用
典例2 [2019·杭州校级模拟]某同学为了测定由两种元素形成的气态化合物X的组成,做了如图所示的实验。他把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果(不考虑装置中的空气):
图6-3
①实验前B管及药品的质量为21.32g,实验后为21.16g。
②C管收集到的液体物质经电解后可以得到H2和O2。
③在D中收集到约为0.09g的N2。
根据上述实验结果分析,回答下列问题:
(1)B管反应前后减小了 0.16g,这是__氧化铜中氧元素__的质量,B管中的实验现象为__黑色固体变红色__。
(2)C中收集到的液体名称及质量分别是__水0.18g__。
(3)根据该实验数据,得出气态化合物X中各元素的质量比约为__氮元素∶氢元素=9∶2__。
跟踪训练2 [2019·湖州模拟]一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( C )
图6-4
A.丁是该反应的催化剂
B.该反应的基本类型是分解反应
C.该反应中乙、丙的质量比为3∶17
D.该反应中甲、丙的质量比为7∶10
类型三 化学方程式
典例3 [2019·杭州校级月考]质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:
在催化剂并加热的条件下,A与B反应生成C和D。反应前后分子变化的微观示意图所下所示:
图6-5
(1)下列说法正确的是__cd__(填序号)。
a.该反应中生成物C与D个数比是1∶1
b.4种物质中只有D属于氧化物
c.反应前后,氮元素化合价升高
d.化学反应中分子可以再分,而原子不能
(2)该反应的化学方程式为__4NH3+5O24NO+6H2O__。
跟踪训练3 [2018·昆明]金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
图6-6
(1)反应①的化学方程式为__H2TiO3H2O+TiO2__。
(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12∶71的比例参加反应,相应的化学方程式为__TiO2+2C+2Cl2TiCl4+2CO__。
(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为__2FeSO4Fe2O3+SO2↑+SO3↑__。
【解析】 根据反应物、生成物、反应条件及质量守恒定律与化学方程式的相关书写规则解答。(1)反应①中,H2TiO3分解生成水和二氧化钛,反应的化学方程式为H2TiO3H2O+TiO2。(2)该反应中C和Cl2按质量比为12∶71的比例参加反应,则化学方程式中碳和氯气的系数之比为∶=1∶1,相应的化学方程式为TiO2+2C+2Cl2TiCl4+2CO。
(3)反应②中的红色固体是氧化铁,两种组成元素相同且相对分子质量相差16的气体分别是二氧化硫和三氧化硫,则该反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
类型四 根据化学方程式解答
典例4 [2019·杭州]工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是__N2(或氮气)__。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
【答案】 设需要H2的质量为m。
N2+3H22NH3
6 34
m 8.5万吨
=,m=1.5万吨,
可减少排放CO2的质量为1.5×5.5万吨=8.25万吨。
跟踪训练4 向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示。
图6-7
(1)计算氢氧化钠溶液的溶质质量分数。
(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量。
【答案】 (1)由于加入的氢氧化钠溶液先与未反应完的稀硫酸反应,再与硫酸镁反应,通过图像可知与硫酸镁反应的氢氧化钠溶液的质量=120g-80g=40g;
设与硫酸镁反应消耗NaOH的质量为x
2NaOH+MgSO4===Mg(OH)2↓+Na2SO4
80 58
x 8.7g
=,x=12g
NaOH%=×100%=30%。
(2)与硫酸反应的氢氧化钠溶液中溶质的质量=80g×30%=24g
设硫酸的质量为y,
H2SO4+2NaOH===Na2SO4+2H2O
98 80
y 24g
=,y=29.4g。
1.[2019·宁波]科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如下。下列说法错误的是( A )
图6-8
A.该反应是置换反应
B.甲是氧化物
C.乙是一种大气污染物
D.丙遇到空气中的水会生成硫酸
【解析】 由两种元素组成,其中一种元素为氧元素的化合物称为氧化物,甲是SO2,属于氧化物。大气污染物包括污染性气体(二氧化硫、氮氧化物等)和可吸入颗粒物,乙是NO2,属于其中氮氧化物的一种。丙是SO3,能与水反应能生成硫酸,反应的化学方程式为SO3+H2O===H2SO4。
2.[2019·苍南六校模拟]某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律。则小试管中的液体和烧杯中的固体可选用( A )
图6-9
A.水和氯化钠固体
B.稀盐酸和铁粉
C.氢氧化钙溶液和碳酸钠粉末
D.5%双氧水和二氧化锰粉末
【解析】 根据质量守恒定律,化学反应前后的元素种类不变。反应物是钠和二氧化碳,反应物中有钠、氧、碳元素,所以生成物也有这三种元素,反应后生成炭黑和一种白色固体。炭黑含有碳元素,那白色固体一定含有的是钠和氧元素,可能还有碳元素。而反应前没有硫元素,也没有氢元素,所以不可能是硫酸钠、碳酸氢钠、氢氧化钠,可能是碳酸钠。
3.[2019·温岭校级模拟]利用如下三个实验来探究质量守恒定律。
图6-10
实验1:①取一根用砂纸打磨干净的长镁带放在石棉网上,用托盘天平称量;②取下石棉网,在石棉网上方点燃镁带;③燃烧结束后将所得的物质与石棉网一起再放回托盘天平称量。
实验2:将装有双氧水的试管放入装有少量二氧化锰的锥形瓶中称量,然后将双氧水与二氧化锰接触。
实验3:将装有无色液体1的试管放入盛有无色液体2的烧杯中称量,然后将试管中的无色液体1倒入烧杯中,未见明显现象。
(1)写出实验1中步骤③的实验现象:__指针偏左,天平不平衡__。
(2)有同学认为实验2中锥形瓶口应套上气球防止氧气逸出。但改进后重新实验时,天平仍不能保持平衡,说明理由:__气球会受到空气的浮力,对实验结果造成影响__。
(3)判断实验3是否可以验证质量守恒定律并说明理由:__不能。两种液体不一定发生了化学反应__。
4.[2019·杭州富阳区月考]小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
图6-11
时间(s)
0
20
30
40
装置和药品的总质量(g)
117.9
114
113.5
113.5
(1)反应共生成CO2的质量为__4.4__g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
【答案】 (2)设CaCO3的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 4.4g
=,x=10g
CaCO3%=×100%=80%。
一、质量守恒定律(b)
1.宏观表现:参加化学反应的各物质的质量总和等于反应后生成的各物质的质量总和。
2.微观解释:化学反应前后原子的种类__没有改变__,原子的数目__没有改变__。
3.普遍性:一切化学反应都遵循质量守恒定律。
4.适用性:质量守恒定律对化学反应有意义,对物理变化无意义。
5.质量守恒:质量守恒定律只适用于化学反应前后质量守恒,而不是体积或分子数守恒。
6.质量分析:在反应前的各物质的质量总和,不包括过量的反应物质量。
二、化学方程式(b)
1.书写:
①以__质量守恒定律__和__客观事实__为依据,使化学方程式左、右两边各原子的种类与数目必须__相等__。
②说明反应条件。
③反应前没有气体(或沉淀)的,需在生成的气体(或沉淀)后面标注气体(或沉淀)符号。
2.读法:以C+O2CO2为例,读法为:
①质的读法:碳在氧气中完全燃烧生成二氧化碳。
②量的读法:每12份质量的碳和32份质量的氧气在点燃的条件下完全反应,可生成44份质量的二氧化碳。
③微观读法:每一个碳原子和一个氧气分子在点燃的条件下反应生成一个二氧化碳分子。
三、根据化学方程式计算(c)
理论基础:质量守恒定律。
1.根据化学方程式计算
(1)基本依据:各反应物与生成物之间的质量比等于各反应物和生成物的式量比。
(2)化学计算的一般步骤:
①根据题意假设未知量;
②写出正确的化学方程式;
③求出有关物质间的质量比;
④列出比例式;
⑤求出未知量;
⑥写出答案。
(3)化学计算的基本类型:
①有关纯净物之间的计算;
②有关含杂质的计算;
③有关多步反应的计算;
④有关混合物反应的计算;
⑤有关无数据或少数据的计算;
⑥有关溶液质量分数的综合计算。
2.根据质量守恒定律解题
(1)原理:质量守恒定律。
(2)解答:常结合微观原理解答,化学反应前后原子的种类和数目没有改变。
【知识拓展】
1.解题时应明确有关物质间的转化关系。
2.解答时要规范、完整、正确。
类型一 质量守恒定律的验证
典例1 [2019·绍兴]材料一:1673年,玻义耳曾经做过一个实验:在密闭的曲颈瓶中加热金属时,得到了金属灰,冷却后打开容器,称量金属灰的质量,发现与原来金属相比质量增加了。
图6-1
材料二:1703年,施塔尔提出“燃素学说”,其主要观点有:①燃素是组成物体的一种成分,一般条件下被禁锢在可燃物中;②燃素在可燃物燃烧时会分离出来,且燃素可穿透一切物质。
材料三:1756年,罗蒙诺索夫重做了玻义耳的实验。他将金属铅装入容器后密封、称量。然后把容器放到火上加热,银白色的金属变成了灰黄色,待容器冷却后再次称量,发现容器的总质量没有发生变化。罗蒙诺索夫对此的解释是:“容器里原来有一定量的空气,且容器中的空气质量减少多少,金属灰的质量就比金属增加多少,在化学变化中物质的质量是守恒的。”后来,拉瓦锡等科学家经过大量的定量实验,推翻了“燃素学说”,质量守恒定律得到公认。
(1)由“燃素学说”可知,物质燃烧后质量应该减少。请根据所学知识写出一个可以推翻“燃素学说”的事实:__铁丝在氧气中燃烧后质量会增加(合理即可)__。
(2)罗蒙诺索夫重做了玻义耳的实验是基于金属加热后,增加的质量并非来自燃素而是来自__空气__的假设。
(3)对比材料一和材料三,玻义耳错过了发现质量守恒定律的一个重要原因是__打开容器前没有称量容器的总质量__。
(4)质量守恒定律的发现过程,给我们的启示是__ACD__。
A.分析问题应该全面、严谨
B.实验的成功与否,取决于药品的选择
C.定量方法是科学研究的重要方法
D.科学研究既要尊重事实,也要勇于创新
跟踪训练1 [淮安中考]质量守恒定律的发现对科学的发展作出了巨大贡献。
图6-2
(1)为验证质量守恒定律,小华设计如图甲所示装置进行实验。
实验时,先将装有药品的装置放在天平上,添加砝码,移动游码至天平平衡(如图甲所示),然后取下装置,用针筒向锥形瓶中注入少量稀盐酸,反应后再将装置放置于天平上,观察到__天平平衡__,从而验证了质量守恒定律。若将锥形瓶改为烧杯,则不能验证质量守恒定律,原因是__装置没有密闭,气体逸出__。
(2)某反应的微观示意图如图乙所示。
①X的化学式是__SO2__。
②根据上述微观示意图,可得出化学反应遵循质量守恒定律的本质原因是__化学反应前后,原子不变(或原子的种类和数目不变)__。
类型二 质量守恒定律的应用
典例2 [2019·杭州校级模拟]某同学为了测定由两种元素形成的气态化合物X的组成,做了如图所示的实验。他把气体X由注射器A缓慢送入装有CuO的B装置,使之完全反应,得到如下结果(不考虑装置中的空气):
图6-3
①实验前B管及药品的质量为21.32g,实验后为21.16g。
②C管收集到的液体物质经电解后可以得到H2和O2。
③在D中收集到约为0.09g的N2。
根据上述实验结果分析,回答下列问题:
(1)B管反应前后减小了 0.16g,这是__氧化铜中氧元素__的质量,B管中的实验现象为__黑色固体变红色__。
(2)C中收集到的液体名称及质量分别是__水0.18g__。
(3)根据该实验数据,得出气态化合物X中各元素的质量比约为__氮元素∶氢元素=9∶2__。
跟踪训练2 [2019·湖州模拟]一定条件下,甲、乙、丙、丁四种物质在密闭容器中反应,测得反应前后各物质的质量分数如图所示,下列说法正确的是( C )
图6-4
A.丁是该反应的催化剂
B.该反应的基本类型是分解反应
C.该反应中乙、丙的质量比为3∶17
D.该反应中甲、丙的质量比为7∶10
类型三 化学方程式
典例3 [2019·杭州校级月考]质量守恒定律是化学反应中的重要规律,我能运用此规律解答下列问题:
在催化剂并加热的条件下,A与B反应生成C和D。反应前后分子变化的微观示意图所下所示:
图6-5
(1)下列说法正确的是__cd__(填序号)。
a.该反应中生成物C与D个数比是1∶1
b.4种物质中只有D属于氧化物
c.反应前后,氮元素化合价升高
d.化学反应中分子可以再分,而原子不能
(2)该反应的化学方程式为__4NH3+5O24NO+6H2O__。
跟踪训练3 [2018·昆明]金属钛被用于航空航天工业、化工、医疗等领域。用钛铁矿(主要成分为FeTiO3)制取钛并获得副产品A的主要工艺流程如下:
图6-6
(1)反应①的化学方程式为__H2TiO3H2O+TiO2__。
(2)TiO2与焦炭(C)和Cl2在高温下反应,该反应中C和Cl2按质量比为12∶71的比例参加反应,相应的化学方程式为__TiO2+2C+2Cl2TiCl4+2CO__。
(3)反应②的产物除红色固体A外,还有两种组成元素相同且相对分子质量相差16的气体。则该反应的化学方程式为__2FeSO4Fe2O3+SO2↑+SO3↑__。
【解析】 根据反应物、生成物、反应条件及质量守恒定律与化学方程式的相关书写规则解答。(1)反应①中,H2TiO3分解生成水和二氧化钛,反应的化学方程式为H2TiO3H2O+TiO2。(2)该反应中C和Cl2按质量比为12∶71的比例参加反应,则化学方程式中碳和氯气的系数之比为∶=1∶1,相应的化学方程式为TiO2+2C+2Cl2TiCl4+2CO。
(3)反应②中的红色固体是氧化铁,两种组成元素相同且相对分子质量相差16的气体分别是二氧化硫和三氧化硫,则该反应的化学方程式为2FeSO4Fe2O3+SO2↑+SO3↑。
类型四 根据化学方程式解答
典例4 [2019·杭州]工业合成氨的相关反应式为:N2+3H22NH3
(1)合成氨的原料气中可以通过分离空气直接得到的是__N2(或氮气)__。
(2)当前,原料气H2可用天然气来制取,理论上每生产1吨H2会同时产生5.5吨CO2。有科学家正在研究一种不生成CO2的新方法来制取原料气H2。若需要合成8.5万吨氨,改用新方法制取原料气H2可以减少排放多少万吨CO2?
【答案】 设需要H2的质量为m。
N2+3H22NH3
6 34
m 8.5万吨
=,m=1.5万吨,
可减少排放CO2的质量为1.5×5.5万吨=8.25万吨。
跟踪训练4 向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如图所示。
图6-7
(1)计算氢氧化钠溶液的溶质质量分数。
(2)与氢氧化钠溶液反应所消耗硫酸溶质的质量。
【答案】 (1)由于加入的氢氧化钠溶液先与未反应完的稀硫酸反应,再与硫酸镁反应,通过图像可知与硫酸镁反应的氢氧化钠溶液的质量=120g-80g=40g;
设与硫酸镁反应消耗NaOH的质量为x
2NaOH+MgSO4===Mg(OH)2↓+Na2SO4
80 58
x 8.7g
=,x=12g
NaOH%=×100%=30%。
(2)与硫酸反应的氢氧化钠溶液中溶质的质量=80g×30%=24g
设硫酸的质量为y,
H2SO4+2NaOH===Na2SO4+2H2O
98 80
y 24g
=,y=29.4g。
1.[2019·宁波]科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如下。下列说法错误的是( A )
图6-8
A.该反应是置换反应
B.甲是氧化物
C.乙是一种大气污染物
D.丙遇到空气中的水会生成硫酸
【解析】 由两种元素组成,其中一种元素为氧元素的化合物称为氧化物,甲是SO2,属于氧化物。大气污染物包括污染性气体(二氧化硫、氮氧化物等)和可吸入颗粒物,乙是NO2,属于其中氮氧化物的一种。丙是SO3,能与水反应能生成硫酸,反应的化学方程式为SO3+H2O===H2SO4。
2.[2019·苍南六校模拟]某科学兴趣小组的同学利用如图所示实验装置验证质量守恒定律。则小试管中的液体和烧杯中的固体可选用( A )
图6-9
A.水和氯化钠固体
B.稀盐酸和铁粉
C.氢氧化钙溶液和碳酸钠粉末
D.5%双氧水和二氧化锰粉末
【解析】 根据质量守恒定律,化学反应前后的元素种类不变。反应物是钠和二氧化碳,反应物中有钠、氧、碳元素,所以生成物也有这三种元素,反应后生成炭黑和一种白色固体。炭黑含有碳元素,那白色固体一定含有的是钠和氧元素,可能还有碳元素。而反应前没有硫元素,也没有氢元素,所以不可能是硫酸钠、碳酸氢钠、氢氧化钠,可能是碳酸钠。
3.[2019·温岭校级模拟]利用如下三个实验来探究质量守恒定律。
图6-10
实验1:①取一根用砂纸打磨干净的长镁带放在石棉网上,用托盘天平称量;②取下石棉网,在石棉网上方点燃镁带;③燃烧结束后将所得的物质与石棉网一起再放回托盘天平称量。
实验2:将装有双氧水的试管放入装有少量二氧化锰的锥形瓶中称量,然后将双氧水与二氧化锰接触。
实验3:将装有无色液体1的试管放入盛有无色液体2的烧杯中称量,然后将试管中的无色液体1倒入烧杯中,未见明显现象。
(1)写出实验1中步骤③的实验现象:__指针偏左,天平不平衡__。
(2)有同学认为实验2中锥形瓶口应套上气球防止氧气逸出。但改进后重新实验时,天平仍不能保持平衡,说明理由:__气球会受到空气的浮力,对实验结果造成影响__。
(3)判断实验3是否可以验证质量守恒定律并说明理由:__不能。两种液体不一定发生了化学反应__。
4.[2019·杭州富阳区月考]小乐利用图示实验装置测定某大理石样品的纯度(所含杂质不与盐酸反应,且不溶于水)。她取了该大理石样品12.5g,并加入足量稀盐酸进行实验。实验数据记录如下表:
图6-11
时间(s)
0
20
30
40
装置和药品的总质量(g)
117.9
114
113.5
113.5
(1)反应共生成CO2的质量为__4.4__g。
(2)计算该大理石样品中CaCO3的质量分数。(写出计算过程)
【答案】 (2)设CaCO3的质量为x。
CaCO3+2HCl===CaCl2+H2O+CO2↑
100 44
x 4.4g
=,x=10g
CaCO3%=×100%=80%。
