人教版高中化学选修4教学讲义,复习补习资料(含典例分析,巩固练习):03【提高】《化学反应与能量》全章复习与巩固
文档属性
| 名称 | 人教版高中化学选修4教学讲义,复习补习资料(含典例分析,巩固练习):03【提高】《化学反应与能量》全章复习与巩固 |  | |
| 格式 | zip | ||
| 文件大小 | 273.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-16 20:16:13 | ||
图片预览




文档简介
全章复习与巩固
【学习目标】
1、了解化学反应中能量转化的原因和常见的能量转化形式;
2、掌握热化学方程式的意义并能正确书写热化学方程式;
3、了解中和热、燃烧热的概念,并能进行简单的计算;
4、知道盖斯定律,能用盖斯定律进行反应热的简单计算;了解反应热计算的过程和方法。
【典型例题】
类型一、热化学基本概念
例1 下列说法正确的是
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热;
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热;
C. 燃烧热或中和热是反应热的种类之一;
D. 在稀溶液中,1mol CH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ。
【思路点拨】明确燃烧热、中和热的概念,熟练掌握热化学基本概念的要点。分析问题从基本概念入手。
【答案】C
【解析】本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题。
【总结升华】热化学的基本概念是理解热化学相关问题的关键,只有熟练掌握这些基本概念才能使本部分内容体系化。而准确掌握这些基本概念的要点才能对一些命题进行正确判断。
举一反三:
【变式1】“碘受热升华,破坏的是分子间作用力,未破坏I-I共价键,因此未发生吸热反应”的说法是否正确?
【答案】化学上把有热量放出的化学反应叫做放热反应,把吸收热量的化学反应叫做吸热反应。而碘升华属物理变化未发生化学反应,因此上述说法正确。
【变式2】中和热的测定实验中将50mL 0.5mol/L的盐酸改为60mL 0.5mol/L盐酸所放出的热量与所求中和热与未改前是否相等?怎样判断?
【答案】两者相等;中和热是指酸与碱发生中和反应生成1mol水所放出的热量,与酸碱的用量无关。
【解析】计算放出的热量:Q=m△t·C=(m2-m1)(t2-t1)·C,由于原反应中碱稍过量,现增大盐酸的量,生成的水增多,放出的热量增多,因此放热不等,又由于△H=Q/n(H2O),Q增大,n(H2O)增多,而比值不变,因此中和热值不变。中和热相等也可从概念判断得出。
类型二、热化学方程式
例2(2019 黄冈检测)含有11.2 g KOH的稀溶液与1 L 0.1 moL/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为( )。
A.KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+H2O (l) ΔH=-11.46 kJ/mol
B.2KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+2H2O (l) ΔH=-11.46 kJ/mol
C.2KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+2H2O (l) ΔH=-111.46 kJ/mol
D.KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+H2O (l) ΔH=-57.3 kJ/mol
【思路点拨】本题考查热化学方程式的书写,注意题目中给出的量与放出热量的对应关系。
【答案】D
【解析】根据中和热的定义:在稀溶液中,酸和碱反应生成“1mol水”时的反应热。由,n (H2SO4)=0.1 mol,则二者恰好反应生成0.2 mol H2O,则生成1 mol H2O时放热为:。
【总结升华】热化学方程式的正确书写是学好热化学版块的基本功。书写时注意物质的状态、化学计量数、反应热数值的关系,并且要求准确理解热化学方程式的含义。
举一反三:
【变式1】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。
已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g) △H1=+81.5kJ·mol-1
Al(OH)3(s)=Al2O3(s)+H2O(g) △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_____________
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是____________,原因是_____________。
③常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是______(填代号),理由是_____________。
【解析】①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。
②Mg(OH)2?Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1;Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1?等质量的Mg(OH)2比Al(OH)3吸热多。
③C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。
【总结升华】热化学方程式的书写常见错误?
①未标明物质的聚集状态?
②没有配平
③反应热计算错误
④反应热的值与方程式中的化学计量数不匹配
⑤反应热没有单位
⑥反应热没有带上“+”号或“—”号。
【变式2】(2019 广东高考)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如下图所示的催化剂循环实现,[来
源:
其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(g) △H1
反应②生成1molCl2 (g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
【答案】2HCl(g) + 1/2O2(g) H2O(g)+Cl2(g) △H=△H1+△H2
【解析】根据图像信息,箭头指向的是生成物可写出反应②的热化学方程式:
CuCl2 (g)+1/2 O2 (g)CuO (s)+Cl2 (g) ΔH2,则①+②可得总反应。
类型三、反应热的有关计算
例3 ?(2019 全国新课标II)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
化学键
H—H
C—O
C O
H—O
C—H
E/(kJ·mol-1)
436
343
1076
465
413
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
【思路点拨】反应热等于断键吸收的能量与形成化学键所放出的能量的差值。
【答案】—99;+41
【解析】根据表中数据和反应热的化学方程式CO(g)+2H2(g)CH3OH(g)可知反应热△H1=1076 kJ·mol-1+2×436 kJ·mol-1-3×413 kJ·mol-1-343 kJ·mol-1-465 kJ·mol-1=-99 kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ·mol-1+99 kJ·mol-1=+41 kJ·mol-1。
【总结升华】反应热的计算方法:
(1)利用反应物和生成物键能之和计算,△H = 反应物键能总和—生成物键能总和
(2)利用反应物和生成物的总能量计算,△H = 生成物总能量—反应物总能量。
(3)热化学方程式与数学上的方程式相似,可以移项同时改变正、负号;各项的计量数包括△H的数值可以同时扩大或缩小相同的倍数。
(4)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式。
(5)可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热。
举一反三:
【变式1】(2019 浙江嘉兴一联)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol
下列说法中错误的是( )
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(1) ΔH>-574 kJ/mol
C.4NO2(g)+2N2(g)==8NO(g) ΔH=+586 kJ/mol
D.若用标准状况下4.48 L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6 NA
【答案】B
【解析】A项,反应①②中均有CH4~CO2~8e-,故等物质的量的CH4在反应①②中转移电子数相同;B项,相同条件下,生成液态水比生成气态水放热多,故ΔH<-574 kJ/mol;C项,根据盖斯定律,由①一②可得4NO2(g)+2N2(g)==8NO(g) ΔH=+586 kJ/mol;D项,CH4最终全部转化为CO2,故转移的电子总数为,即1.6 NA。
【变式2】已知:,且ΔH1<ΔH2,若A和D的混合气体1mol完全与B反应,反应热为ΔH3,则A和D的物质的量之比为( )。
A.?
B.?
C.?
D.?
【答案】B
【解析】由题意可知1molA与B完全反应的反应热为ΔH1,1molD与B完全反应的反应热为ΔH2,而1molA和D的混合气体完全与B反应,反应热为ΔH3,运用十字交叉法:
热量的差值之比,即为A和D的物质的量之比。
【变式3】根据热化学方程式(在101kPa时):,分析下列说法中不正确的是( )。
A. S的燃烧热为297.23kJ/mol
B.?放出热量大于297.23kJ
C.?放出热量小于297.23kJ
D. 形成1mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量
【答案】C
【解析】根据题给燃烧热的热化学方程式可知A、D正确。若想确定B与C,需将题设热化学方程式拆分为:
,即放出热量的数值小于297.23kJ。
【巩固练习】
一、选择题
1.煤炭燃烧的过程中会释放大量的SO2,严重破坏生态环境,采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ?mol﹣1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=﹣175.6kJ?mol﹣1(反应Ⅱ)
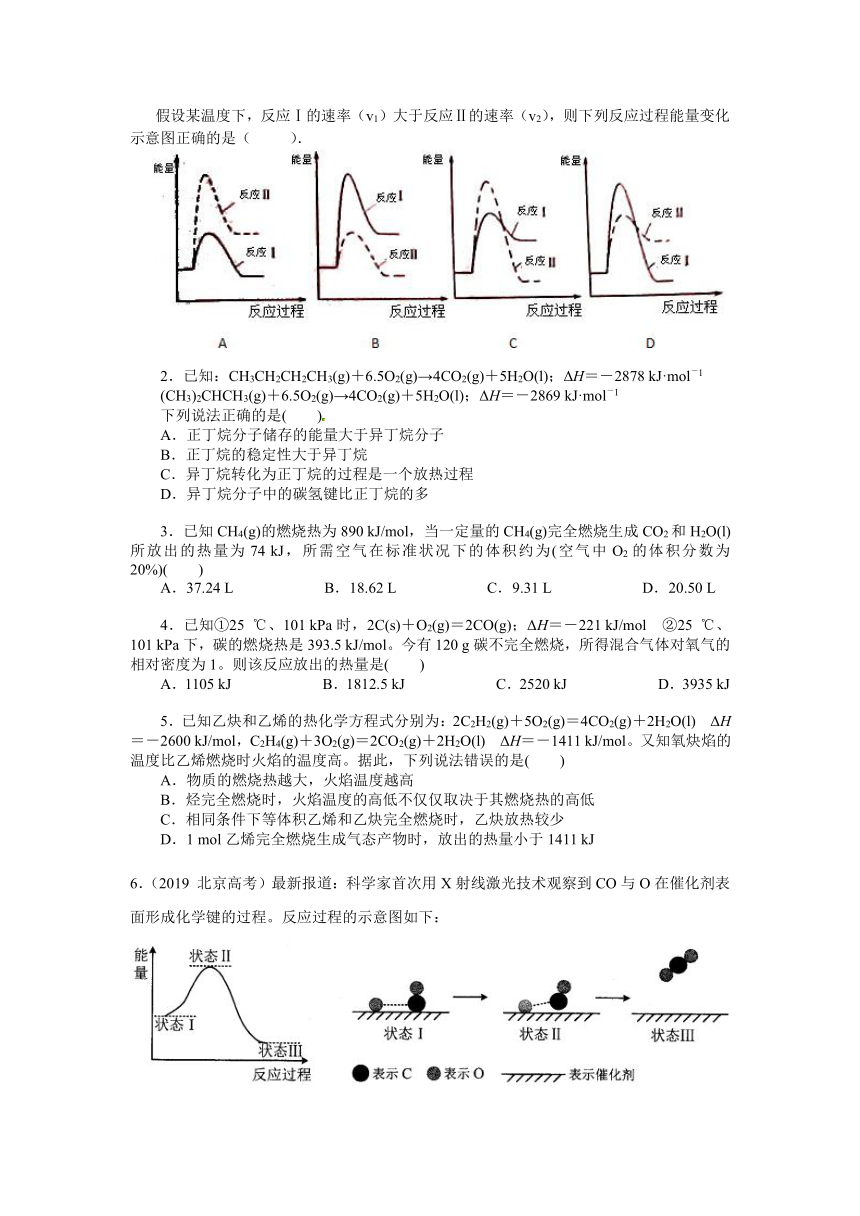
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( ).
2.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);ΔH=-2878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);ΔH=-2869 kJ·mol-1
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
3.已知CH4(g)的燃烧热为890 kJ/mol,当一定量的CH4(g)完全燃烧生成CO2和H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中O2的体积分数为20%)( )
A.37.24 L B.18.62 L C.9.31 L D.20.50 L
4.已知①25 ℃、101 kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 kJ/mol ②25 ℃、101 kPa下,碳的燃烧热是393.5 kJ/mol。今有120 g碳不完全燃烧,所得混合气体对氧气的相对密度为1。则该反应放出的热量是( )
A.1105 kJ B.1812.5 kJ C.2520 kJ D.3935 kJ
5.已知乙炔和乙烯的热化学方程式分别为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol,C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411 kJ/mol。又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是( )
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1 mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
6.(2019 北京高考)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
7.已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol.实验测得4 mol SO2发生上述化学反应时放出314.3 kJ的热量,SO2的转化率最接近于( )
A.40% B.50% C.80% D.90%
8.已知标准状况下5.6 L CO完全燃烧放出的热量能使200 g 15.5 ℃的水温度升高到100 ℃,水的比热容是4.186×10-3 kJ/(g·℃),下列表示CO燃烧的热化学方程式正确的是( )
A.CO(g)+O2(g)=CO2(g) ΔH=-282.97 kJ/mol
B.2CO(g)+O2(g)=2CO2(g) ΔH=-565.9 kJ/mol
C.CO(g)+O2(g)=CO2(g) ΔH=-70.7 kJ/mol
D.CO(g)+O2(g)=CO2(g) ΔH=-565.9 kJ/mol
9.(2019 宜昌检测)已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是( )。
A.CO燃烧的热化学方程式为2CO (g)+O2 (g)==2CO2 (g) ΔH=+282.8 kJ/mol
B.H2燃烧的热化学方程式为2H2 (g)+O2 (g)==2H2O (g) ΔH=-571.6 kJ/mol
C.燃烧前的混合气体中,H2的体积分数为40%
D.混合气体燃烧后与足量的过氧化钠反应,转移电子2 mol
10.(2019 上海高考)已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D.反应物的总能量高于生成物的总能量
11.以NA代表阿伏加德罗常数,则关于热化学方程式2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1299.6 kJ的能量
B.有1NA个水分子生成且为液体时,吸收1299.6 kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1299.6 kJ的能量
D.有4NA个氢氧共用电子对生成时,放出1299.6 kJ的能量
12.(2019 山西四校联考)下列有关说法正确的是( )
A.已知:HI(g)H2(g)+I2(s) ΔH=-26.5 kJ/mol,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.已知:2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-571.6 kJ/mol
C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
2H2O(g)+O2(g)==2H2O2(l) ΔH=+108.3 kJ/mol ①,
N2H4(1)+O2(g)==N2(g)+2H2O(g) ΔH=-534.0 kJ/mol ②
则有:N2H4(1)+2H2O2(l)==N2(g)+4H2O(l) ΔH=-642.3 kJ/mol
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)==CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
13.物质的生成热可定义为:由稳定单质生成1 mol物质所放出的热量。如CO2气体的生成热就是C(s)+O2(g)=CO2(g)的反应热。已知下表中几种化合物的生成热。
化合物
葡萄糖
H2O(l)
CO2(g)
生成热(kJ/mol)
1259.8
285.8
393.5
则1 kg葡萄糖在人体内完全氧化成CO2和液态水最多可提供的能量为( )
A.3225 kJ B.2816 kJ C.69999 kJ D.15644 kJ
14.在一定条件下某反应的热化学方程式为:
2SO2(g)+O2(g) 2SO3(g);ΔH=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所示。
容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以下数据,下列叙述正确的是( )
A.上述条件下每生成1 mol SO3气体放热98.5 kJ
B.上述条件下每摩尔SO2在反应达到平衡时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197
D.2Q2=2Q3<Q1<197
二、非选择题
1.实验室利用如图装置进行中和热的测定。回答下列问题:
(1)该图中有两处未画出,它们是____________、____________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将____________(填“偏大”、“偏小”或“不变”);原因是____________。
2.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是______________________________________________。
上述分解反应是一个可逆反应。T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2____________α1(填“大于”“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________。P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________________________。
3.(2019 北京西城)近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。像电能一样,氢能是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的二次能源;而存在于自然界的可以提供现成形式能量的能源称为一次能源,如煤、石油、太阳能和原子能等。
(1)氢气燃烧时耗氧量小,放热量大。已知:
C (s)+O2 (g)==CO2 (g) ΔH=-393.5 kJ·mol-1
H2 (g)+O2 (g)==H2O (1) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比约是________。
(2)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之问,其组成不固定,通常是非化学计量的,例如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:________。
【参考答案与解析】
一、选择题
1.C
【解析】反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;由方程式可知反应Ⅱ气体较多,则活化能较大,则B错误、C正确。
2.A
【解析】由题目所给热化学方程式可知燃烧等物质的量的正丁烷和异丁烷,前者放热更多,这意味着正丁烷分子储存能量更多,因此稳定性关系为:正丁烷<异丁烷,A项正确,B项错误;由低能量物质向高能量物质的转化过程是一个吸热过程,C项错误;两者分子中的碳氢键一样多,D项错误。
3.B
【解析】设生产74 kJ热量需O2的体积为V,则由甲烷燃烧的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol知,解得,则需空气为5 V==18.62 L。
4.B
5.A
【解析】依据题意,乙炔的燃烧热小于乙烯的燃烧热,A错误;火焰温度还取决于生成水的量的多少,B正确;C正确;水汽化时要吸收热量,D正确。
6.C
【解析】根据能量——反应过程的图像知,状态I的能量高于状态III的能量,故该过程是放热反应,A错误;根据状态I、II、III可以看出整个过程中CO中的C和O形成的化学键没有断裂,故B错误;由图III可知,生成物是CO2,具有极性共价键,故C正确;状态I→状态III表示CO与O反应的过程,故D错误。
7.C
【解析】 4 mol SO2完全反应放出的热量为:4 mol×=393.2 kJ,所以SO2的转化率为:×100%=80%。
8.A
【解析】 Q=mc△t=200 g×4.186 J/(g·℃)×(100 ℃-15.5 ℃)=70743.4 J=70.743 kJ,则1 mol CO燃烧放出的热量为70.743 kJ×=282.97 kJ/mol。
9.C
【解析】A项,1 mol CO燃烧生成1 mol CO2放热282.8 kJ,ΔH<0,错误。B项,由于题目中已知H2的燃烧热,因此生成的H2O应为液态,错误。设56.0 L混合气体中含H2的物质的量为x,CO的物质的量为y,列式 ①,285.8 kJ·mol-1x+282.8 kJ·mol-1y=710.0 kJ ②,联立①②解得x=1 mol,则H2的体积分数为,C项正确。混合气体燃烧后生成H2O、CO2共2.5 mol,与足量的过氧化钠反应能产生O2 1.25 mol,转移电子总数为2.5 mol,D错误。
10.D
【解析】A.加入催化剂,减小了反应的活化能,使反应在较低的温度下发生,但是反应的热效应不变,错误。B.加入催化剂,可提高H2O2的分解的反应速率,该反应不是可逆反应,而且催化剂不能是平衡发生移动,因此不存在平衡转化率的提高与否,错误。C.在书写热化学方程式式,也要符合质量守恒定律,而且要注明与反应的物质多少相对应的能量和物质的存在状态,错误。D.根据图示可知反应物的总能量高于生成物的总能量,该反应是放热反应,正确。
11.A
【解析】 5O2(g)~ΔH=-2599.2 kJ·mol-1,转移电子数n(e-)=5 mol×2e-×2=20 mol e-,即A正确。B中1NA水分子即为1 mol H2O(l),放出1299.6 kJ的能量,故B错。C中4NA个碳氧共用电子对,即为1 mol CO2(O=C=O),故C错。D中4NA个氢氧共用电子对即为2mol H2O,放出2599.2 kJ,故D错。
12.C
【解析】A项,HI(g) 1/2 H2(g)+1/2 I2(s)为可逆反应,1 mol HI在密闭容器中分解后放出的热量小于26.5 kJ,错误;B项,燃烧热是指101 kPa下,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以氢气的燃烧热为285.8 kJ/mol,错误;C项,由②-①可得N2H4(l)+2H2O2(l)==N2(g)+4H2O(l) ΔH=-642.3 kJ/mol,正确;D项,醋酸为弱酸,其电离会吸热,故稀醋酸和稀NaOH溶液反应的中和热应小于57.4 kJ/mol,错误。
13.D
【解析】 本题考查的是生成热的有关计算。由题意知:①6C(s)+6H2(g)+3O2(g)=C6H12O6(s) ΔH1=-1259.8 kJ/mol;
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol;
③C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol-1。
由②×+③×6-1①得:
C6H12O6(s)+6O2(g)=6H2O(l)+6CO2(g) ΔH4=-2816 kJ/mol
故1 kg葡萄糖放出的热量为:。故正确答案为D。
14.AD
【解析】 本题考查的是反应热与化学平衡的综合应用。本题将化学平衡知识与反应热有机地结合在一起,很有创意。因为题给反应是可逆反应,转化率不可能为100%,而反应热是完全转化时放出的热量,所以每生成1 mol SO3时,放出的热量为98.5 kJ,故A正确;B中不是反应达到平衡,而是2 mol SO2完全反应放出的热量为197 kJ;C中Q1>2Q2,丙容器与乙容器处于相同的平衡状态,不影响热量的变化,故Q2=Q3,C错误。故正确答案为AD。
二、非选择题
1.(1)环形玻璃搅拌棒 烧杯上方的泡沫塑料板或硬纸板
(2)提高装置的保温效果
(3)偏大 固体NaOH溶于水放热
【解析】 (1)由装置图可知,该装置中缺少搅拌使用的环形玻璃搅拌棒和保温使用的泡沫塑料板或硬纸板。
(2)该实验的关键是温度的测定,在操作正确的前提下提高中和热测定的准确性的关键是提高装置的保温效果。
(3)因为固体NaOH溶于水放热,所以如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将偏大。
2.(1)Cl2(g)+P(s)=PCl3(g);ΔH=-306 kJ·mol-1
(2)PCl5(g)=PCl3(g)+Cl2(g);ΔH=+93 kJ·mol-1 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1 等于
(5)PCl5+4H2O=H3PO4+5HCl
【解析】(1)由图象知P和Cl2反应生成PCl3的热化学方程式是P(s)+Cl2(g)=PCl3(g);ΔH=-306 kJ·mol-1。
(2)ΔH=生成物总能量-反应物总能量,反应PCl3(g)+Cl2(g)=PCl5(g);ΔH=-93 kJ·mol-1,故反应PCl5(g)=PCl3(g)+Cl2(g);ΔH=+93 kJ·mol-1。
。
由于反应PCl5PCl3+Cl2是吸热反应,升高温度,平衡向正反应方向转移,分解率增大,即a2大于a1。
(3)3Cl2+2P=2PCl3、PCl3+Cl2PCl5两个反应均为放热反应,降低温度,有利于平衡向正向移动,提高了PCl3的转化率,同时防止PCl5分解。
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的ΔH应该是相等的。
(5)PCl5与H2O反应生成的酸可能是H3PO4、HCl和HClO,但PCl5→H3PO4,P元素化合价没变,则Cl元素化合价也不变,即该反应生成的两种酸是H3PO4和HCl。所以该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl。
3.(1)4.36∶1 (2)PdH0.8
【解析】(1)由热化学方程式可知,相同质量的氢气和碳完全燃烧时放出的热量之比为:
。
(2)由题意可知,1 cm3钯粉可吸收896 cm3的氢气,故:
。
所以钯(Pd)的氢化物的化学式为PdH0.8。
【学习目标】
1、了解化学反应中能量转化的原因和常见的能量转化形式;
2、掌握热化学方程式的意义并能正确书写热化学方程式;
3、了解中和热、燃烧热的概念,并能进行简单的计算;
4、知道盖斯定律,能用盖斯定律进行反应热的简单计算;了解反应热计算的过程和方法。
【典型例题】
类型一、热化学基本概念
例1 下列说法正确的是
A. 在101kPa时,1mol物质完全燃烧时所放出的热量,叫做该物质的燃烧热;
B. 酸和碱发生中和反应生成1mol水,这时的反应热叫中和热;
C. 燃烧热或中和热是反应热的种类之一;
D. 在稀溶液中,1mol CH3COOH和1mol NaOH完全中和时放出的热量为57.3kJ。
【思路点拨】明确燃烧热、中和热的概念,熟练掌握热化学基本概念的要点。分析问题从基本概念入手。
【答案】C
【解析】本题旨在考查对燃烧热、中和热的定义的理解,特别是两概念中应注意的问题。
【总结升华】热化学的基本概念是理解热化学相关问题的关键,只有熟练掌握这些基本概念才能使本部分内容体系化。而准确掌握这些基本概念的要点才能对一些命题进行正确判断。
举一反三:
【变式1】“碘受热升华,破坏的是分子间作用力,未破坏I-I共价键,因此未发生吸热反应”的说法是否正确?
【答案】化学上把有热量放出的化学反应叫做放热反应,把吸收热量的化学反应叫做吸热反应。而碘升华属物理变化未发生化学反应,因此上述说法正确。
【变式2】中和热的测定实验中将50mL 0.5mol/L的盐酸改为60mL 0.5mol/L盐酸所放出的热量与所求中和热与未改前是否相等?怎样判断?
【答案】两者相等;中和热是指酸与碱发生中和反应生成1mol水所放出的热量,与酸碱的用量无关。
【解析】计算放出的热量:Q=m△t·C=(m2-m1)(t2-t1)·C,由于原反应中碱稍过量,现增大盐酸的量,生成的水增多,放出的热量增多,因此放热不等,又由于△H=Q/n(H2O),Q增大,n(H2O)增多,而比值不变,因此中和热值不变。中和热相等也可从概念判断得出。
类型二、热化学方程式
例2(2019 黄冈检测)含有11.2 g KOH的稀溶液与1 L 0.1 moL/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为( )。
A.KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+H2O (l) ΔH=-11.46 kJ/mol
B.2KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+2H2O (l) ΔH=-11.46 kJ/mol
C.2KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+2H2O (l) ΔH=-111.46 kJ/mol
D.KOH (aq)+H2SO4 (aq)==K2SO4 (aq)+H2O (l) ΔH=-57.3 kJ/mol
【思路点拨】本题考查热化学方程式的书写,注意题目中给出的量与放出热量的对应关系。
【答案】D
【解析】根据中和热的定义:在稀溶液中,酸和碱反应生成“1mol水”时的反应热。由,n (H2SO4)=0.1 mol,则二者恰好反应生成0.2 mol H2O,则生成1 mol H2O时放热为:。
【总结升华】热化学方程式的正确书写是学好热化学版块的基本功。书写时注意物质的状态、化学计量数、反应热数值的关系,并且要求准确理解热化学方程式的含义。
举一反三:
【变式1】往有机聚合物中添加阻燃剂,可增加聚合物的使用安全性,扩大其应用范围。例如,在某聚乙烯树脂中加入等质量由特殊工艺制备的阻燃型Mg(OH)2,树脂可燃性大大降低。
已知热化学方程式:
Mg(OH)2(s)==MgO(s)+H2O(g) △H1=+81.5kJ·mol-1
Al(OH)3(s)=Al2O3(s)+H2O(g) △H2=+87.7kJ·mol-1
①Mg(OH)2和Al(OH)3起阻燃作用的主要原因是_____________
②等质量Mg(OH)2和Al(OH)3相比,阻燃效果较好的是____________,原因是_____________。
③常用阻燃剂主要有三类:A.卤系,如四溴乙烷;B.磷系,如磷酸三苯酯;C.无机类,主要是Mg(OH)2和Al(OH)3。从环保的角度考虑,应用时较理想的阻燃剂是______(填代号),理由是_____________。
【解析】①Mg(OH)2和Al(OH)3受热分解时吸收大量的热,使环境温度下降;同时生成的耐高温、稳定性好的MgO、Al2O3覆盖在可燃物表面,阻燃效果更佳。
②Mg(OH)2?Mg(OH)2的吸热效率为:81.5kJ·mol-1/58g·mol-1=1.41 kJ·g-1;Al(OH)3的吸热效率为:87.7kJ·mol-1/78g·mol-1=1.12 kJ·g-1?等质量的Mg(OH)2比Al(OH)3吸热多。
③C 四溴乙烷、磷酸三苯酯沸点低,高温时有烟生成,且高温时受热分解产生有毒、有害的污染物。无机类阻燃剂Mg(OH)2和Al(OH)3无烟、无毒、腐蚀性小。
【总结升华】热化学方程式的书写常见错误?
①未标明物质的聚集状态?
②没有配平
③反应热计算错误
④反应热的值与方程式中的化学计量数不匹配
⑤反应热没有单位
⑥反应热没有带上“+”号或“—”号。
【变式2】(2019 广东高考)用O2将HCl转化为Cl2,可提高效益,减少污染,传统上该转化通过如下图所示的催化剂循环实现,[来
源:
其中,反应①为:2HCl(g) + CuO(s) H2O(g)+CuCl2(g) △H1
反应②生成1molCl2 (g)的反应热为△H2,则总反应的热化学方程式为 , (反应热用△H1和△H2表示)。
【答案】2HCl(g) + 1/2O2(g) H2O(g)+Cl2(g) △H=△H1+△H2
【解析】根据图像信息,箭头指向的是生成物可写出反应②的热化学方程式:
CuCl2 (g)+1/2 O2 (g)CuO (s)+Cl2 (g) ΔH2,则①+②可得总反应。
类型三、反应热的有关计算
例3 ?(2019 全国新课标II)甲醇是重要的化工原料,又可称为燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
化学键
H—H
C—O
C O
H—O
C—H
E/(kJ·mol-1)
436
343
1076
465
413
由此计算△H1= kJ·mol-1,已知△H2=-58kJ·mol-1,则△H3= kJ·mol-1。
【思路点拨】反应热等于断键吸收的能量与形成化学键所放出的能量的差值。
【答案】—99;+41
【解析】根据表中数据和反应热的化学方程式CO(g)+2H2(g)CH3OH(g)可知反应热△H1=1076 kJ·mol-1+2×436 kJ·mol-1-3×413 kJ·mol-1-343 kJ·mol-1-465 kJ·mol-1=-99 kJ·mol-1。根据盖斯定律可知②-①即可得到反应③,则△H3=-58 kJ·mol-1+99 kJ·mol-1=+41 kJ·mol-1。
【总结升华】反应热的计算方法:
(1)利用反应物和生成物键能之和计算,△H = 反应物键能总和—生成物键能总和
(2)利用反应物和生成物的总能量计算,△H = 生成物总能量—反应物总能量。
(3)热化学方程式与数学上的方程式相似,可以移项同时改变正、负号;各项的计量数包括△H的数值可以同时扩大或缩小相同的倍数。
(4)根据盖斯定律,可以将两个或两个以上的热化学方程式包括其△H相加或相减,得到一个新的热化学方程式。
(5)可燃物完全燃烧产生的热量=可燃物的物质的量×其燃烧热。
举一反三:
【变式1】(2019 浙江嘉兴一联)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(g) ΔH=-574 kJ/mol
②CH4(g)+4NO(g)==2N2(g)+CO2(g)+2H2O(g) ΔH=-1160 kJ/mol
下列说法中错误的是( )
A.等物质的量的CH4在反应①、②中转移电子数相同
B.由反应①可推知:CH4(g)+4NO2(g)==4NO(g)+CO2(g)+2H2O(1) ΔH>-574 kJ/mol
C.4NO2(g)+2N2(g)==8NO(g) ΔH=+586 kJ/mol
D.若用标准状况下4.48 L CH4把NO2还原为N2,整个过程中转移的电子总数为1.6 NA
【答案】B
【解析】A项,反应①②中均有CH4~CO2~8e-,故等物质的量的CH4在反应①②中转移电子数相同;B项,相同条件下,生成液态水比生成气态水放热多,故ΔH<-574 kJ/mol;C项,根据盖斯定律,由①一②可得4NO2(g)+2N2(g)==8NO(g) ΔH=+586 kJ/mol;D项,CH4最终全部转化为CO2,故转移的电子总数为,即1.6 NA。
【变式2】已知:,且ΔH1<ΔH2,若A和D的混合气体1mol完全与B反应,反应热为ΔH3,则A和D的物质的量之比为( )。
A.?
B.?
C.?
D.?
【答案】B
【解析】由题意可知1molA与B完全反应的反应热为ΔH1,1molD与B完全反应的反应热为ΔH2,而1molA和D的混合气体完全与B反应,反应热为ΔH3,运用十字交叉法:
热量的差值之比,即为A和D的物质的量之比。
【变式3】根据热化学方程式(在101kPa时):,分析下列说法中不正确的是( )。
A. S的燃烧热为297.23kJ/mol
B.?放出热量大于297.23kJ
C.?放出热量小于297.23kJ
D. 形成1mol SO2的化学键所释放的总能量大于断裂1mol S(s)和1mol O2(g)的化学键所吸收的总能量
【答案】C
【解析】根据题给燃烧热的热化学方程式可知A、D正确。若想确定B与C,需将题设热化学方程式拆分为:
,即放出热量的数值小于297.23kJ。
【巩固练习】
一、选择题
1.煤炭燃烧的过程中会释放大量的SO2,严重破坏生态环境,采用一定的脱硫技术可以把硫元素以CaSO4的形式固定,从而降低SO2的排放,但是煤炭燃烧过程中产生的CO又会与CaSO4发生化学反应,降低了脱硫效率,相关反应的热化学方程式如下:
CaSO4(s)+CO(g)?CaO(s)+SO2(g)+CO2(g)△H1=218.4kJ?mol﹣1(反应Ⅰ)
CaSO4(s)+4CO(g)?CaS(s)+4CO2(g)△H2=﹣175.6kJ?mol﹣1(反应Ⅱ)
假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是( ).
2.已知:CH3CH2CH2CH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);ΔH=-2878 kJ·mol-1
(CH3)2CHCH3(g)+6.5O2(g)→4CO2(g)+5H2O(l);ΔH=-2869 kJ·mol-1
下列说法正确的是( )
A.正丁烷分子储存的能量大于异丁烷分子
B.正丁烷的稳定性大于异丁烷
C.异丁烷转化为正丁烷的过程是一个放热过程
D.异丁烷分子中的碳氢键比正丁烷的多
3.已知CH4(g)的燃烧热为890 kJ/mol,当一定量的CH4(g)完全燃烧生成CO2和H2O(l)所放出的热量为74 kJ,所需空气在标准状况下的体积约为(空气中O2的体积分数为20%)( )
A.37.24 L B.18.62 L C.9.31 L D.20.50 L
4.已知①25 ℃、101 kPa时,2C(s)+O2(g)=2CO(g);ΔH=-221 kJ/mol ②25 ℃、101 kPa下,碳的燃烧热是393.5 kJ/mol。今有120 g碳不完全燃烧,所得混合气体对氧气的相对密度为1。则该反应放出的热量是( )
A.1105 kJ B.1812.5 kJ C.2520 kJ D.3935 kJ
5.已知乙炔和乙烯的热化学方程式分别为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2600 kJ/mol,C2H4(g)+3O2(g)=2CO2(g)+2H2O(l) ΔH=-1411 kJ/mol。又知氧炔焰的温度比乙烯燃烧时火焰的温度高。据此,下列说法错误的是( )
A.物质的燃烧热越大,火焰温度越高
B.烃完全燃烧时,火焰温度的高低不仅仅取决于其燃烧热的高低
C.相同条件下等体积乙烯和乙炔完全燃烧时,乙炔放热较少
D.1 mol乙烯完全燃烧生成气态产物时,放出的热量小于1411 kJ
6.(2019 北京高考)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有极性共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
7.已知:2SO2(g)+O2(g)=2SO3(g) ΔH=-196.6 kJ/mol.实验测得4 mol SO2发生上述化学反应时放出314.3 kJ的热量,SO2的转化率最接近于( )
A.40% B.50% C.80% D.90%
8.已知标准状况下5.6 L CO完全燃烧放出的热量能使200 g 15.5 ℃的水温度升高到100 ℃,水的比热容是4.186×10-3 kJ/(g·℃),下列表示CO燃烧的热化学方程式正确的是( )
A.CO(g)+O2(g)=CO2(g) ΔH=-282.97 kJ/mol
B.2CO(g)+O2(g)=2CO2(g) ΔH=-565.9 kJ/mol
C.CO(g)+O2(g)=CO2(g) ΔH=-70.7 kJ/mol
D.CO(g)+O2(g)=CO2(g) ΔH=-565.9 kJ/mol
9.(2019 宜昌检测)已知H2的燃烧热为285.8 kJ/mol,CO的燃烧热为282.8 kJ/mol。现有H2和CO组成的混合气体56.0 L(标准状况),充分燃烧后,放出热量710.0 kJ,并生成液态水。下列说法正确的是( )。
A.CO燃烧的热化学方程式为2CO (g)+O2 (g)==2CO2 (g) ΔH=+282.8 kJ/mol
B.H2燃烧的热化学方程式为2H2 (g)+O2 (g)==2H2O (g) ΔH=-571.6 kJ/mol
C.燃烧前的混合气体中,H2的体积分数为40%
D.混合气体燃烧后与足量的过氧化钠反应,转移电子2 mol
10.(2019 上海高考)已知H2O2在催化剂作用下分解速率加快,其能量随反应进程的变化如下图所示。下列说法正确的是( )
A.加入催化剂,减小了反应的热效应
B.加入催化剂,可提高H2O2的平衡转化率
C.H2O2分解的热化学方程式:H2O2 → H2O + O2 + Q
D.反应物的总能量高于生成物的总能量
11.以NA代表阿伏加德罗常数,则关于热化学方程式2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) ΔH=-2599.2 kJ·mol-1的说法中,正确的是( )
A.有10NA个电子转移时,该反应放出1299.6 kJ的能量
B.有1NA个水分子生成且为液体时,吸收1299.6 kJ的能量
C.有4NA个碳氧共用电子对生成时,放出1299.6 kJ的能量
D.有4NA个氢氧共用电子对生成时,放出1299.6 kJ的能量
12.(2019 山西四校联考)下列有关说法正确的是( )
A.已知:HI(g)H2(g)+I2(s) ΔH=-26.5 kJ/mol,由此可知1 mol HI气体在密闭容器中充分分解后可以放出26.5 kJ的热量
B.已知:2H2(g)+O2(g)==2H2O(l) ΔH=-571.6 kJ/mol,则氢气的燃烧热为ΔH=-571.6 kJ/mol
C.肼(N2H4)是一种用于火箭或燃料电池的原料,已知:
2H2O(g)+O2(g)==2H2O2(l) ΔH=+108.3 kJ/mol ①,
N2H4(1)+O2(g)==N2(g)+2H2O(g) ΔH=-534.0 kJ/mol ②
则有:N2H4(1)+2H2O2(l)==N2(g)+4H2O(l) ΔH=-642.3 kJ/mol
D.含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,则稀醋酸和稀NaOH溶液反应的热化学方程式为:NaOH(aq)+CH3COOH(aq)==CH3COONa(aq)+H2O(l) ΔH=-57.4 kJ/mol
13.物质的生成热可定义为:由稳定单质生成1 mol物质所放出的热量。如CO2气体的生成热就是C(s)+O2(g)=CO2(g)的反应热。已知下表中几种化合物的生成热。
化合物
葡萄糖
H2O(l)
CO2(g)
生成热(kJ/mol)
1259.8
285.8
393.5
则1 kg葡萄糖在人体内完全氧化成CO2和液态水最多可提供的能量为( )
A.3225 kJ B.2816 kJ C.69999 kJ D.15644 kJ
14.在一定条件下某反应的热化学方程式为:
2SO2(g)+O2(g) 2SO3(g);ΔH=-197 kJ/mol
现有容积相同的甲、乙、丙三个容器,在上述条件下分别充入的气体和反应放出的热量(Q)如下表所示。
容器
SO2(mol)
O2(mol)
N2(mol)
Q(kJ)
甲
2
1
0
Q1
乙
1
0.5
0
Q2
丙
1
0.5
1
Q3
根据以下数据,下列叙述正确的是( )
A.上述条件下每生成1 mol SO3气体放热98.5 kJ
B.上述条件下每摩尔SO2在反应达到平衡时放出的热量为197 kJ
C.Q1=2Q2=2Q3=197
D.2Q2=2Q3<Q1<197
二、非选择题
1.实验室利用如图装置进行中和热的测定。回答下列问题:
(1)该图中有两处未画出,它们是____________、____________。
(2)在操作正确的前提下提高中和热测定的准确性的关键是____________。
(3)如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将____________(填“偏大”、“偏小”或“不变”);原因是____________。
2.红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的ΔH表示生成1 mol产物的数据)。
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是______________________________。
(2)PCl5分解成PCl3和Cl2的热化学方程式是______________________________________________。
上述分解反应是一个可逆反应。T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于____________;若反应温度由T1升高到T2,平衡时PCl5的分解率为α2,α2____________α1(填“大于”“小于”或“等于”)。
(3)工业上制备PCl5通常分两步进行,先将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是____________________________________________。
(4)P和Cl2分两步反应生成1 mol PCl5的ΔH3=____________。P和Cl2一步反应生成1 mol PCl5的ΔH4____________ΔH3(填“大于”“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________________________。
3.(2019 北京西城)近20年来,对以氢气作为未来的动力燃料氢能源的研究获得了迅速发展。像电能一样,氢能是一种需要依靠其他能源如石油、煤、原子能等的能量来制取的二次能源;而存在于自然界的可以提供现成形式能量的能源称为一次能源,如煤、石油、太阳能和原子能等。
(1)氢气燃烧时耗氧量小,放热量大。已知:
C (s)+O2 (g)==CO2 (g) ΔH=-393.5 kJ·mol-1
H2 (g)+O2 (g)==H2O (1) ΔH=-285.8 kJ·mol-1
试通过计算说明等质量的氢气和碳燃烧时产生热量的比约是________。
(2)氢能源有可能实现能源的贮存,也有可能实现经济、高效的输送。研究表明过渡金属型氢化物(又称间充氢化物)中,氢原子填充在金属的晶格间隙之问,其组成不固定,通常是非化学计量的,例如:LaH2.76、TiH1.73、CeH2.69、ZrH1.98、PrH2.85、TaH0.78。已知标准状况下,1体积的钯粉大约可吸附896体积的氢气(钯粉的密度为10.64 g·cm-3相对原子质量为106.4),试写出钯(Pd)的氢化物的化学式:________。
【参考答案与解析】
一、选择题
1.C
【解析】反应Ⅰ为吸热反应,反应Ⅱ为放热反应,则A、D错误;由方程式可知反应Ⅱ气体较多,则活化能较大,则B错误、C正确。
2.A
【解析】由题目所给热化学方程式可知燃烧等物质的量的正丁烷和异丁烷,前者放热更多,这意味着正丁烷分子储存能量更多,因此稳定性关系为:正丁烷<异丁烷,A项正确,B项错误;由低能量物质向高能量物质的转化过程是一个吸热过程,C项错误;两者分子中的碳氢键一样多,D项错误。
3.B
【解析】设生产74 kJ热量需O2的体积为V,则由甲烷燃烧的热化学方程式:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH=-890 kJ/mol知,解得,则需空气为5 V==18.62 L。
4.B
5.A
【解析】依据题意,乙炔的燃烧热小于乙烯的燃烧热,A错误;火焰温度还取决于生成水的量的多少,B正确;C正确;水汽化时要吸收热量,D正确。
6.C
【解析】根据能量——反应过程的图像知,状态I的能量高于状态III的能量,故该过程是放热反应,A错误;根据状态I、II、III可以看出整个过程中CO中的C和O形成的化学键没有断裂,故B错误;由图III可知,生成物是CO2,具有极性共价键,故C正确;状态I→状态III表示CO与O反应的过程,故D错误。
7.C
【解析】 4 mol SO2完全反应放出的热量为:4 mol×=393.2 kJ,所以SO2的转化率为:×100%=80%。
8.A
【解析】 Q=mc△t=200 g×4.186 J/(g·℃)×(100 ℃-15.5 ℃)=70743.4 J=70.743 kJ,则1 mol CO燃烧放出的热量为70.743 kJ×=282.97 kJ/mol。
9.C
【解析】A项,1 mol CO燃烧生成1 mol CO2放热282.8 kJ,ΔH<0,错误。B项,由于题目中已知H2的燃烧热,因此生成的H2O应为液态,错误。设56.0 L混合气体中含H2的物质的量为x,CO的物质的量为y,列式 ①,285.8 kJ·mol-1x+282.8 kJ·mol-1y=710.0 kJ ②,联立①②解得x=1 mol,则H2的体积分数为,C项正确。混合气体燃烧后生成H2O、CO2共2.5 mol,与足量的过氧化钠反应能产生O2 1.25 mol,转移电子总数为2.5 mol,D错误。
10.D
【解析】A.加入催化剂,减小了反应的活化能,使反应在较低的温度下发生,但是反应的热效应不变,错误。B.加入催化剂,可提高H2O2的分解的反应速率,该反应不是可逆反应,而且催化剂不能是平衡发生移动,因此不存在平衡转化率的提高与否,错误。C.在书写热化学方程式式,也要符合质量守恒定律,而且要注明与反应的物质多少相对应的能量和物质的存在状态,错误。D.根据图示可知反应物的总能量高于生成物的总能量,该反应是放热反应,正确。
11.A
【解析】 5O2(g)~ΔH=-2599.2 kJ·mol-1,转移电子数n(e-)=5 mol×2e-×2=20 mol e-,即A正确。B中1NA水分子即为1 mol H2O(l),放出1299.6 kJ的能量,故B错。C中4NA个碳氧共用电子对,即为1 mol CO2(O=C=O),故C错。D中4NA个氢氧共用电子对即为2mol H2O,放出2599.2 kJ,故D错。
12.C
【解析】A项,HI(g) 1/2 H2(g)+1/2 I2(s)为可逆反应,1 mol HI在密闭容器中分解后放出的热量小于26.5 kJ,错误;B项,燃烧热是指101 kPa下,1 mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以氢气的燃烧热为285.8 kJ/mol,错误;C项,由②-①可得N2H4(l)+2H2O2(l)==N2(g)+4H2O(l) ΔH=-642.3 kJ/mol,正确;D项,醋酸为弱酸,其电离会吸热,故稀醋酸和稀NaOH溶液反应的中和热应小于57.4 kJ/mol,错误。
13.D
【解析】 本题考查的是生成热的有关计算。由题意知:①6C(s)+6H2(g)+3O2(g)=C6H12O6(s) ΔH1=-1259.8 kJ/mol;
②2H2(g)+O2(g)=2H2O(l) ΔH2=-571.6 kJ/mol;
③C(s)+O2(g)=CO2(g) ΔH3=-393.5 kJ/mol-1。
由②×+③×6-1①得:
C6H12O6(s)+6O2(g)=6H2O(l)+6CO2(g) ΔH4=-2816 kJ/mol
故1 kg葡萄糖放出的热量为:。故正确答案为D。
14.AD
【解析】 本题考查的是反应热与化学平衡的综合应用。本题将化学平衡知识与反应热有机地结合在一起,很有创意。因为题给反应是可逆反应,转化率不可能为100%,而反应热是完全转化时放出的热量,所以每生成1 mol SO3时,放出的热量为98.5 kJ,故A正确;B中不是反应达到平衡,而是2 mol SO2完全反应放出的热量为197 kJ;C中Q1>2Q2,丙容器与乙容器处于相同的平衡状态,不影响热量的变化,故Q2=Q3,C错误。故正确答案为AD。
二、非选择题
1.(1)环形玻璃搅拌棒 烧杯上方的泡沫塑料板或硬纸板
(2)提高装置的保温效果
(3)偏大 固体NaOH溶于水放热
【解析】 (1)由装置图可知,该装置中缺少搅拌使用的环形玻璃搅拌棒和保温使用的泡沫塑料板或硬纸板。
(2)该实验的关键是温度的测定,在操作正确的前提下提高中和热测定的准确性的关键是提高装置的保温效果。
(3)因为固体NaOH溶于水放热,所以如果用0.50 mol/L的盐酸和氢氧化钠固体进行实验,则实验中所测出的“中和热”将偏大。
2.(1)Cl2(g)+P(s)=PCl3(g);ΔH=-306 kJ·mol-1
(2)PCl5(g)=PCl3(g)+Cl2(g);ΔH=+93 kJ·mol-1 25% 大于
(3)两步反应均为放热反应,降温有利于提高产率,防止产物分解
(4)-399 kJ·mol-1 等于
(5)PCl5+4H2O=H3PO4+5HCl
【解析】(1)由图象知P和Cl2反应生成PCl3的热化学方程式是P(s)+Cl2(g)=PCl3(g);ΔH=-306 kJ·mol-1。
(2)ΔH=生成物总能量-反应物总能量,反应PCl3(g)+Cl2(g)=PCl5(g);ΔH=-93 kJ·mol-1,故反应PCl5(g)=PCl3(g)+Cl2(g);ΔH=+93 kJ·mol-1。
。
由于反应PCl5PCl3+Cl2是吸热反应,升高温度,平衡向正反应方向转移,分解率增大,即a2大于a1。
(3)3Cl2+2P=2PCl3、PCl3+Cl2PCl5两个反应均为放热反应,降低温度,有利于平衡向正向移动,提高了PCl3的转化率,同时防止PCl5分解。
(4)根据盖斯定律,P和Cl2分两步反应和一步反应生成PCl5的ΔH应该是相等的。
(5)PCl5与H2O反应生成的酸可能是H3PO4、HCl和HClO,但PCl5→H3PO4,P元素化合价没变,则Cl元素化合价也不变,即该反应生成的两种酸是H3PO4和HCl。所以该反应的化学方程式是PCl5+4H2O=H3PO4+5HCl。
3.(1)4.36∶1 (2)PdH0.8
【解析】(1)由热化学方程式可知,相同质量的氢气和碳完全燃烧时放出的热量之比为:
。
(2)由题意可知,1 cm3钯粉可吸收896 cm3的氢气,故:
。
所以钯(Pd)的氢化物的化学式为PdH0.8。
