高中化学人教版选修3第二章第三节-分子的性质(共23张PPT)
文档属性
| 名称 | 高中化学人教版选修3第二章第三节-分子的性质(共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-17 20:13:26 | ||
图片预览






文档简介
(共23张PPT)
学习目标:
1、复习掌握极性共价键和非极性共价键;
2、结合常见物质分子立体结构,学会判断极性分子和
非极性分子;
3、引导学生运用“物质结构决定物质性质,性质反映
结构”的观念来理解解释分子的性质;
4、学会用所学的化学知识来解决生活中的问题。
共价键:
原子间通过共用电子对形成的相互作用
温故
化学键
离子键
共价键
共用电子对
是否偏移
极性键
非极性键
个人工作总结分析-地税政风行风建设总结
个人工作总结:地税政风行风建设总结
xxx县地税局以纳税服务为着力点,注重将政风行风建设与其它工作相结合,赋予政风行风建设新内容,进一步加强政风行风建设。
一是与深入学习实践科学发展观和“讲党性修养、树良好作风、促科学发展”等教育活动相结合,提高科学化税收、精细化管理水平,增强规范税收执法、改进税收服务的自觉性。该局严格按照“党员干部受教育、科学发展上水平、人民群众得实惠”的总体要求,紧密结合地税实际,把政风行风建设融入其中,查摆近年来影响地税行风建设的问题,增强忧患意识、大局意识、责任意识。
二是与“企业服务年”活动相结合,提高服务水平。该局在活动中,确定重点走访企业6家,由班子成员定期上门走访,提供国家政策咨询、纳税辅导等服务,同企业负责人及财务人员进行座谈,随时掌握企业生产经营状况,帮助企业解决生产经营过程中面临的困难和问题。活动开展以来,该局班子成员走访了蓝天化工、天瑞集团、白鲨针布等市、县重点企业,税务部门务实的工作作风深受企业好评。
三是与“公开评议机关”活动相结合,树立机关形象。该局从加强制度建设着手,简化纳税人办税程序。认真落实党
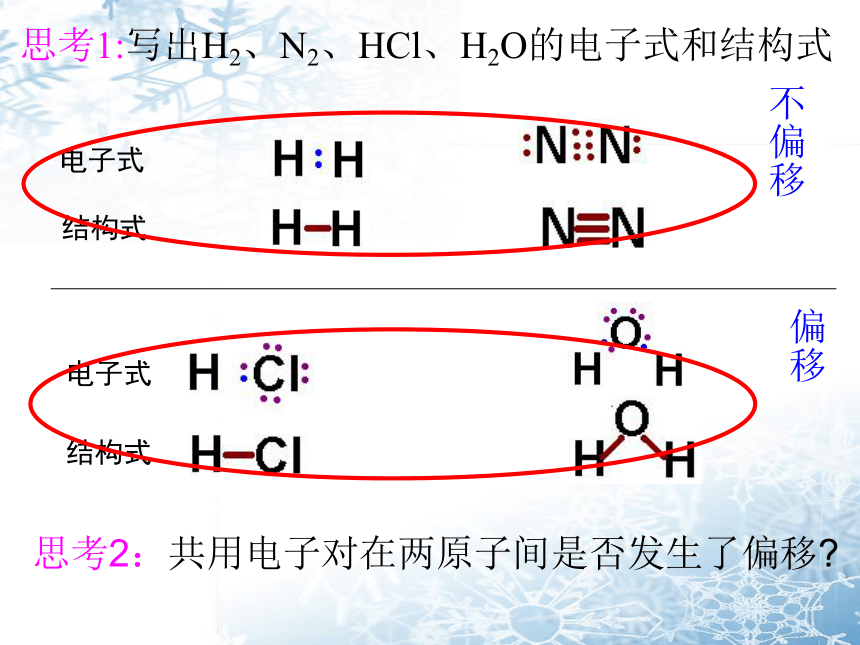
思考1:写出H2、N2、HCl、H2O的电子式和结构式
思考2:共用电子对在两原子间是否发生了偏移?
电子式
结构式
电子式
结构式
不偏移
偏移
极性共价键 非极性共价键
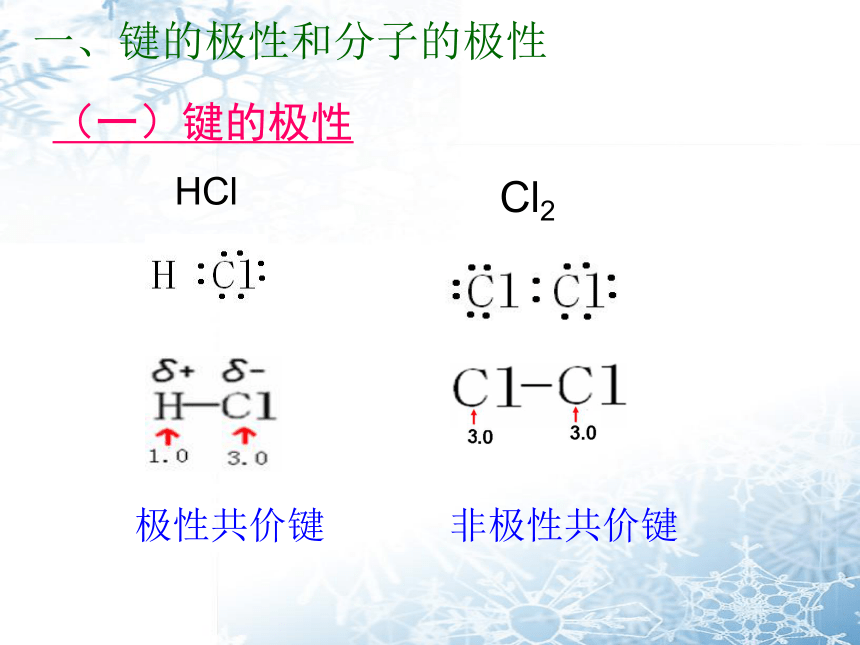
一、键的极性和分子的极性
HCl
Cl2
(一)键的极性
非极性键和极性键的比较:
同种非金属元素原子形成的共价键
不同种非金属元素原子形成的共价键
相同
不同
不
偏
移
偏
移
电
中
性
显
电
性
不同种非金属元素原子
同种非
金属元
素原子
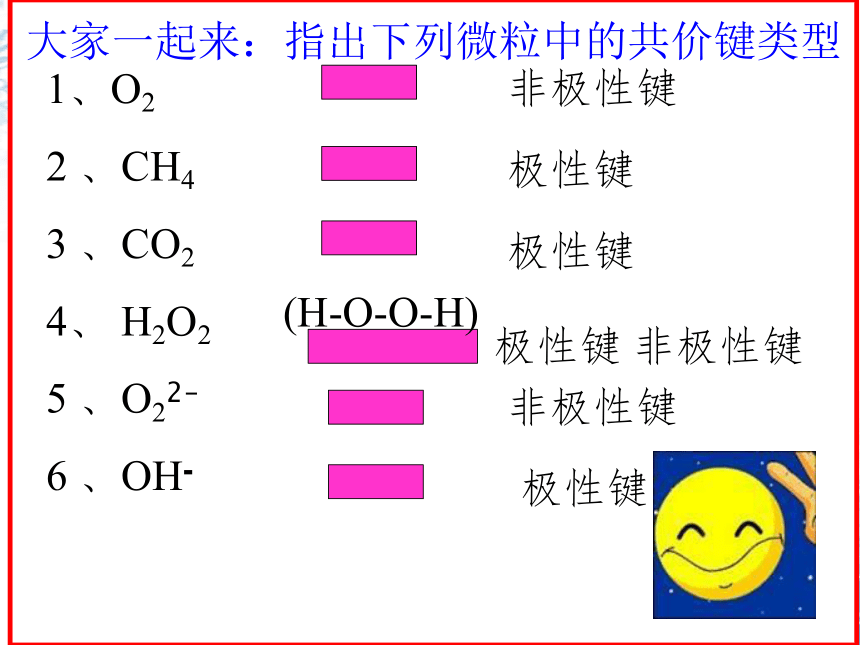
大家一起来:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
新知
【实验】证明水分子极性
现象:H2O细流方向改变,CCI4细流方向不改变
结论:H2O是极性分子,CCI4是非极性分子。
说明分子有极性分子和非极性分子。
非极性分子:整个分子正电中心和负电中心重合
极性分子:整个分子正电中心和负电中心不重合
1、概念
(二)分子的极性
讨论解释为什么H2O 是极性分子、 CCl4是非极性分子。
①正电中心和负电中心是否重合(本质)
③化学键的极性的向量和是否等于零(定量)
②看键的极性和分子的空间构型
2、分子极性判断思路:
3、判断方法:
双原子分子
ABn型多原子分子
双原子分子
多原子分子
第一类:全部由非极性键
组成的分子
第二类:全部由极性键
组成的分子
Cl2分子中,共用电子对不偏移,Cl原子都不显电性,整个分子正负电荷中心重合,为非极性分子
结论1:以非极性键形成的双原子分子均
为非极性分子
从键的极性,讨论H2、N2、CI2是极性分子还是非极性分子?
3、判断方法:
——非极性分子
P4、C60、S8 等
H2 N2 O2等
第一类:
全部由非极性键
组成的分子
双原子分子
多原子分子
——一般为非极性分子
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子正负电荷中心不重合,∴为极性分子
δ+
δ-
结论2:以极性键结合的双原子分子为
极性分子
从键的极性,判断HCI、CO是极性分子还是非极性分子?
3、判断方法:
HX、CO、NO等
①物理模型法
在ABn 分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)。
从力学的角度分析分子中各键极性的向量和
双原子分子
第二类:全部由极性键
组成的分子
——极性分子
C=O键是极性键,CO2分子是直线形分子, F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,∴是非极性分子
180?
F1
F2
F合=0
CO2:
H2O:
105?
F1
F2
F合≠0
O-H键是极性键,是V形分子,共用电子对偏O原子,F合≠0,两个O-H键的极性不能抵消,整个分子正负电荷中心不重合,不对称。∴是极性分子
BF3
NH3
120?
107?
三角锥形,
F合≠0, 键的极性不能抵消,整个分子正负电荷中心,不重合,不对称,是极性分子
F1
F2
F3
F合=0
F合≠0
CH4
F合=0
平面三角形,F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,是非极性分子
正四面体形 ,F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,是非极性分子
109?28'
V形
三角
锥形
直线形
平面三
角形
正四面体形
不对称
对称
为零
不为零
非极性
极性
不对称
对称
对称
不为零
为零
为零
非极性
非极性
极性
0
0
0
1
2
在ABn型分子中
若中心原子A无孤电子对,则是非极性分子;
若中心原子A有孤电子对,则是极性分子。
空间结构对称——非极性分子。
如:CO2(直线形)、BF3(平面三角形)、CH4(正四面体)等 ;
空间结构不对称——极性分子、
如:H2O(V形)、NH3(三角锥形)等。
②根据分子的空间构型判断:
③孤电子法判断:
对于ABn型多原子分子极性判别方法
ABn型多原子分子,当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
3 4 4 2 3
3 4 4 6 5
对于ABn型多原子分子极性判别方法
④化合价法:
非极性
极性
非极性
非极性
极性
非极性分子
思考与交流
小结:键的极性与分子的极性的关系
非极性键形成分子(H2、Cl2、P4等)
极性键形成,空间结构不对称,键的极性不抵消(HCl、H2O、NH3等)
极性键形成,空间结构对称,键的极性抵消(CH4、CO2等)
小结:
总结:
谢 谢
学习目标:
1、复习掌握极性共价键和非极性共价键;
2、结合常见物质分子立体结构,学会判断极性分子和
非极性分子;
3、引导学生运用“物质结构决定物质性质,性质反映
结构”的观念来理解解释分子的性质;
4、学会用所学的化学知识来解决生活中的问题。
共价键:
原子间通过共用电子对形成的相互作用
温故
化学键
离子键
共价键
共用电子对
是否偏移
极性键
非极性键
个人工作总结分析-地税政风行风建设总结
个人工作总结:地税政风行风建设总结
xxx县地税局以纳税服务为着力点,注重将政风行风建设与其它工作相结合,赋予政风行风建设新内容,进一步加强政风行风建设。
一是与深入学习实践科学发展观和“讲党性修养、树良好作风、促科学发展”等教育活动相结合,提高科学化税收、精细化管理水平,增强规范税收执法、改进税收服务的自觉性。该局严格按照“党员干部受教育、科学发展上水平、人民群众得实惠”的总体要求,紧密结合地税实际,把政风行风建设融入其中,查摆近年来影响地税行风建设的问题,增强忧患意识、大局意识、责任意识。
二是与“企业服务年”活动相结合,提高服务水平。该局在活动中,确定重点走访企业6家,由班子成员定期上门走访,提供国家政策咨询、纳税辅导等服务,同企业负责人及财务人员进行座谈,随时掌握企业生产经营状况,帮助企业解决生产经营过程中面临的困难和问题。活动开展以来,该局班子成员走访了蓝天化工、天瑞集团、白鲨针布等市、县重点企业,税务部门务实的工作作风深受企业好评。
三是与“公开评议机关”活动相结合,树立机关形象。该局从加强制度建设着手,简化纳税人办税程序。认真落实党
思考1:写出H2、N2、HCl、H2O的电子式和结构式
思考2:共用电子对在两原子间是否发生了偏移?
电子式
结构式
电子式
结构式
不偏移
偏移
极性共价键 非极性共价键
一、键的极性和分子的极性
HCl
Cl2
(一)键的极性
非极性键和极性键的比较:
同种非金属元素原子形成的共价键
不同种非金属元素原子形成的共价键
相同
不同
不
偏
移
偏
移
电
中
性
显
电
性
不同种非金属元素原子
同种非
金属元
素原子
大家一起来:指出下列微粒中的共价键类型
1、O2
2 、CH4
3 、CO2
4、 H2O2
5 、O22-
6 、OH-
非极性键
极性键
极性键
(H-O-O-H)
极性键 非极性键
非极性键
极性键
根据电荷分布是否均匀,共价键有极性、非极性之分,以共价键结合的分子是否也有极性、非极性之分呢?
新知
【实验】证明水分子极性
现象:H2O细流方向改变,CCI4细流方向不改变
结论:H2O是极性分子,CCI4是非极性分子。
说明分子有极性分子和非极性分子。
非极性分子:整个分子正电中心和负电中心重合
极性分子:整个分子正电中心和负电中心不重合
1、概念
(二)分子的极性
讨论解释为什么H2O 是极性分子、 CCl4是非极性分子。
①正电中心和负电中心是否重合(本质)
③化学键的极性的向量和是否等于零(定量)
②看键的极性和分子的空间构型
2、分子极性判断思路:
3、判断方法:
双原子分子
ABn型多原子分子
双原子分子
多原子分子
第一类:全部由非极性键
组成的分子
第二类:全部由极性键
组成的分子
Cl2分子中,共用电子对不偏移,Cl原子都不显电性,整个分子正负电荷中心重合,为非极性分子
结论1:以非极性键形成的双原子分子均
为非极性分子
从键的极性,讨论H2、N2、CI2是极性分子还是非极性分子?
3、判断方法:
——非极性分子
P4、C60、S8 等
H2 N2 O2等
第一类:
全部由非极性键
组成的分子
双原子分子
多原子分子
——一般为非极性分子
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子正负电荷中心不重合,∴为极性分子
δ+
δ-
结论2:以极性键结合的双原子分子为
极性分子
从键的极性,判断HCI、CO是极性分子还是非极性分子?
3、判断方法:
HX、CO、NO等
①物理模型法
在ABn 分子中,A-B键看作AB原子间的相互作用力,根据中心原子A所受合力是否为零来判断,F合=0,为非极性分子(极性抵消),F合≠0,为极性分子(极性不抵消)。
从力学的角度分析分子中各键极性的向量和
双原子分子
第二类:全部由极性键
组成的分子
——极性分子
C=O键是极性键,CO2分子是直线形分子, F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,∴是非极性分子
180?
F1
F2
F合=0
CO2:
H2O:
105?
F1
F2
F合≠0
O-H键是极性键,是V形分子,共用电子对偏O原子,F合≠0,两个O-H键的极性不能抵消,整个分子正负电荷中心不重合,不对称。∴是极性分子
BF3
NH3
120?
107?
三角锥形,
F合≠0, 键的极性不能抵消,整个分子正负电荷中心,不重合,不对称,是极性分子
F1
F2
F3
F合=0
F合≠0
CH4
F合=0
平面三角形,F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,是非极性分子
正四面体形 ,F合=0,键的极性互相抵消,整个分子正负电荷中心重合,对称,是非极性分子
109?28'
V形
三角
锥形
直线形
平面三
角形
正四面体形
不对称
对称
为零
不为零
非极性
极性
不对称
对称
对称
不为零
为零
为零
非极性
非极性
极性
0
0
0
1
2
在ABn型分子中
若中心原子A无孤电子对,则是非极性分子;
若中心原子A有孤电子对,则是极性分子。
空间结构对称——非极性分子。
如:CO2(直线形)、BF3(平面三角形)、CH4(正四面体)等 ;
空间结构不对称——极性分子、
如:H2O(V形)、NH3(三角锥形)等。
②根据分子的空间构型判断:
③孤电子法判断:
对于ABn型多原子分子极性判别方法
ABn型多原子分子,当中心原子的化合价的绝对值等于该元素的价电子数时,该分子一般为非极性分子;否则为极性分子。
3 4 4 2 3
3 4 4 6 5
对于ABn型多原子分子极性判别方法
④化合价法:
非极性
极性
非极性
非极性
极性
非极性分子
思考与交流
小结:键的极性与分子的极性的关系
非极性键形成分子(H2、Cl2、P4等)
极性键形成,空间结构不对称,键的极性不抵消(HCl、H2O、NH3等)
极性键形成,空间结构对称,键的极性抵消(CH4、CO2等)
小结:
总结:
谢 谢
