生物:2.1.1《减数分裂》学案(新人教版必修2)
文档属性
| 名称 | 生物:2.1.1《减数分裂》学案(新人教版必修2) |

|
|
| 格式 | rar | ||
| 文件大小 | 107.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 生物学 | ||
| 更新时间 | 2009-07-13 00:00:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
重庆市育才中学2009届高考前化学模拟试题
重庆市育才中学:王茂峰
.下列说法中,不正确的是Dw.w.w.k.s.5.u.c.o.m
A.除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液,振荡后分液
B.用渗析(透析)的方法可除去肾病患者血液中的毒素物质
C.用重结晶法可分离NaCl和KNO3的混合物
D.除去FeCl3溶液中少量的CuCl2,可加入足量的铁粉充分反应后过滤
.设阿伏加德罗常数为NA,下列说法正确的是B
A.1 molCl2与足量Fe反应,转移的电子数为3NA
B.常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol NO2与足量H2O反应,转移的电子数为NA
D.常温下,l L l mol/LCH3COONH4溶液中含量NH4+的数目为NA
.如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g) 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( D )
A.反应开始时,A容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率小
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
.某无色溶液中可能存在Na+、Mg2+、Al3+、Br―、I―、CO32―、SO32―等七种离子中的几种。现取该溶液进行下列实验:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子是( A )
A.Mg2+、Al3+、I―、SO32― B.Mg2+、I―、CO32―、SO32―
C.Mg2+、Al3+、Br―、I― D.Mg2+、Al3+、I―、CO32―
.下列离子方程式中,表达正确的是B
A.向澄清石灰水中加入少量小苏打溶液:Ca2+ +2OH- +2HCO3- = CaCO3↓+ CO32- +2H2O
B.向氨水中通入过量的SO2:NH3·H2O+SO2=NH4++HSO3-
C.氢氧化铁与足量氢碘酸反应: Fe(OH)3+3H+=Fe3++3H2O
D.苯酚钠溶液与二氧化碳反应:2+CO2+H2O 2C6H5OH +
.X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示。若X原子的最外层电子是内层电子数的2倍。下列说法中,正确的是( A )
A.X与Q的化合物中含有共价键
B.最高价氧化物对应水化物的酸性:Q比Z弱
C.氢化物稳定性:Z比Y强
D.Q与Fe反应生成的化合物中,铁元素显+3价
.下列叙述中,正确的是B
A.10ml0.1mol/L醋酸中加入几滴1mol/L H2SO4后,c(CH3COOH)/c(H+)变大
B.将0.2mol/L HCN和0.1mol/L NaOH等体积混合后:c(HCN)+c(CN-)=2c(Na+)
C.将20 ml 0.4mol/L硝酸铵溶液跟50 ml 0.1 mol/L氢氧化钡溶液混合:c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
D.0.5mol/L的下列溶液中 ①NH3·H2O ②NH4Cl ③NH4HCO3 ④(NH4)2SO4,c(NH4+):④>③>②>①
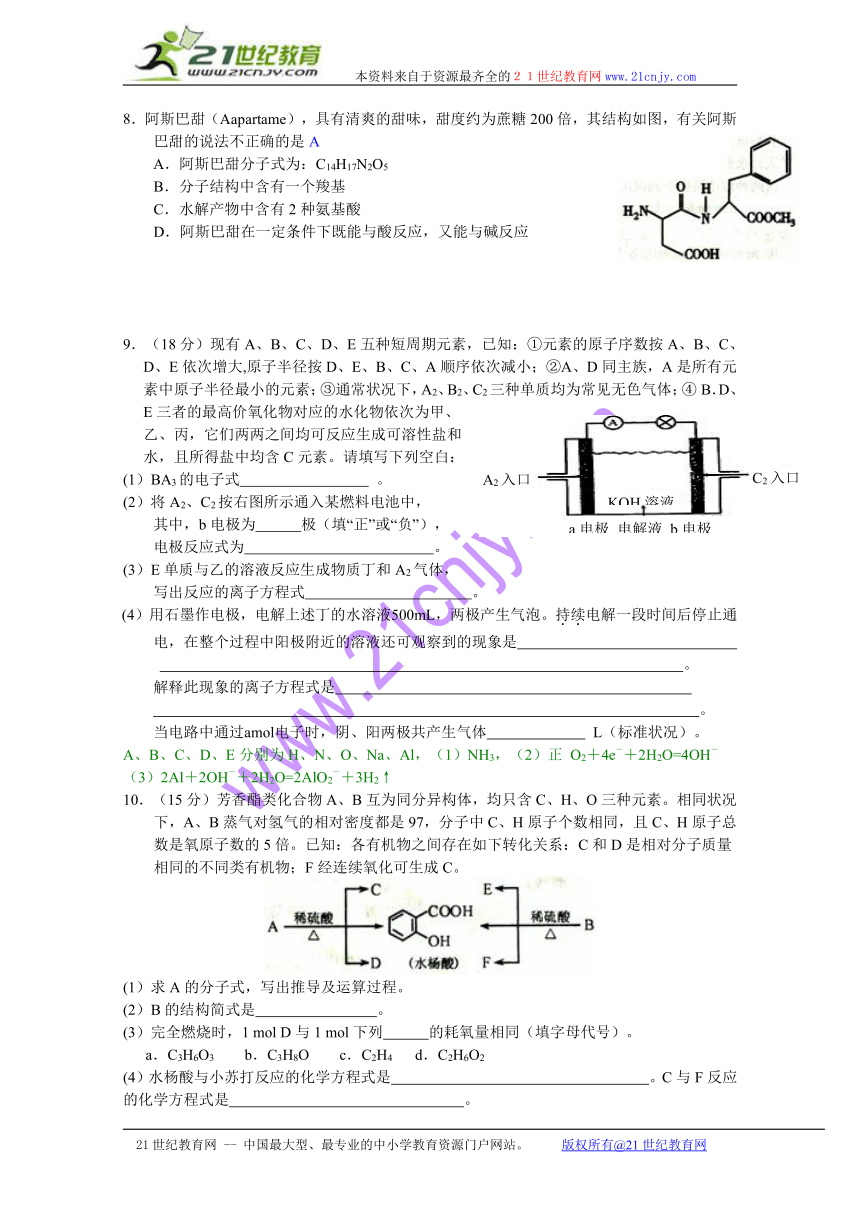
.阿斯巴甜(Aapartame),具有清爽的甜味,甜度约为蔗糖200倍,其结构如图,有关阿斯巴甜的说法不正确的是A
A.阿斯巴甜分子式为:C14H17N2O5
B.分子结构中含有一个羧基
C.水解产物中含有2种氨基酸
D.阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
.(18分)现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④ B.D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。请填写下列空白:
(1)BA3的电子式 。
(2)将A2、C2按右图所示通入某燃料电池中,
其中,b电极为 极(填“正”或“负”),
电极反应式为 。
(3)E单质与乙的溶液反应生成物质丁和A2气体,
写出反应的离子方程式 。
(4)用石墨作电极,电解上述丁的水溶液500mL,两极产生气泡。持续电解一段时间后停止通电,在整个过程中阳极附近的溶液还可观察到的现象是
。
解释此现象的离子方程式是
。
当电路中通过amol电子时,阴、阳两极共产生气体 L(标准状况)。
A、B、C、D、E分别为H、N、O、Na、Al,(1)NH3,(2)正 O2+4e-+2H2O=4OH-
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑
.(15分)芳香酯类化合物A、B互为同分异构体,均只含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度都是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。已知:各有机物之间存在如下转化关系:C和D是相对分子质量相同的不同类有机物;F经连续氧化可生成C。
(1)求A的分子式,写出推导及运算过程。
(2)B的结构简式是 。
(3)完全燃烧时,1 mol D与1 mol下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)水杨酸与小苏打反应的化学方程式是 。C与F反应的化学方程式是 。
(5)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体;②可以水解;③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(6)1 mol上述(5)中的一种有机物X,能与含4 mol NaOH的溶液恰好完全反应,写出此反应的化学方程式 。
(1)依题意有:,设A的分子式为(CH)5nO2n
则有13n +5n+32n = 194 n=2 ,故A的分子式为C10H10O4 (3分)
(2) (2分)
(3)a、c (2分)
(4)+NaHCO3 +CO2↑+H2O (2分)
HCOOH+CH3OHHCOOCH3+H2O (2分)
(5)3
(6)+4NaOH+2CH3COONa+2H2O(2分)
.(19分)A~G为中学常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下D为无色无味气体,B为黑色粉末,E能发生银镜反应。21世纪教育网
( http: / / www. / )
请回答:
(1)D跟G反应的化学方程式为_____________________________________;
(2)F中一定含有的官能团的名称为_______________________;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
( http: / / www. / )
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是____________________________________________;
丙装置中药品的名称为________________,实验时,该药品未见明显变化,证明____________________________________________;
③ 如何判断A已完全分解?
____________________________________________________________________
____________________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):________________________。Cu3(OH)4CO3
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右下图所示的实验。
①可通过观察
的现象来定性地得出结论。
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是 。
若不采用A同学的改进方案,你认为还可以如何改进?
。
.(8分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa
pH 8.8 9.7 11.6 10.3 11.1 11.3
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HclO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +C6H5ONaNaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONaNa2CO3+2C6H5OH
E、Na2CO3+C6H5OHNaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:
;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式:______________________________________________。
(1)A、D (2分,只选一个且正确给1分,只要错选给0分)
(2)⑤;1;①(各1分,共3分)
(3)复分解反应能够向生成更难溶(溶解度更小)物质的方向进行。 (1分)
白色固体变成黄色 (1分) I-+AgCl===AgI+Cl- (1分)
21世纪教育网
www.
C2入口
A2入口
a电极 电解液 b电极
KOH溶液
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
重庆市育才中学2009届高考前化学模拟试题
重庆市育才中学:王茂峰
.下列说法中,不正确的是Dw.w.w.k.s.5.u.c.o.m
A.除去乙酸乙酯中的少量乙酸,可加入饱和碳酸钠溶液,振荡后分液
B.用渗析(透析)的方法可除去肾病患者血液中的毒素物质
C.用重结晶法可分离NaCl和KNO3的混合物
D.除去FeCl3溶液中少量的CuCl2,可加入足量的铁粉充分反应后过滤
.设阿伏加德罗常数为NA,下列说法正确的是B
A.1 molCl2与足量Fe反应,转移的电子数为3NA
B.常温常压下,46 g NO2和N2O4混合气体中含有的原子数为3NA
C.1 mol NO2与足量H2O反应,转移的电子数为NA
D.常温下,l L l mol/LCH3COONH4溶液中含量NH4+的数目为NA
.如图所示,向A中充入1molX和1molY,向B中充入2molX和2molY,起始VA=VB=aL,在相同温度和有催化剂的条件下,两容器中各自发生下列反应 X(g)+Y(g) 2Z(g)+W(g)达到平衡时,VA=1.2aL,则下列说法正确的是( D )
A.反应开始时,A容器中化学反应速率快
B.A容器中X的转化率为40%,且比B容器中X的转化率小
C.打开K一段时间达平衡时,A的体积为1.6aL(连通管中气体体积不计)
D.打开K达新平衡后,升高B容器温度,A容器体积一定增大
.某无色溶液中可能存在Na+、Mg2+、Al3+、Br―、I―、CO32―、SO32―等七种离子中的几种。现取该溶液进行下列实验:①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成,向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。据此可以推断,该溶液中肯定不存在的离子是( A )
A.Mg2+、Al3+、I―、SO32― B.Mg2+、I―、CO32―、SO32―
C.Mg2+、Al3+、Br―、I― D.Mg2+、Al3+、I―、CO32―
.下列离子方程式中,表达正确的是B
A.向澄清石灰水中加入少量小苏打溶液:Ca2+ +2OH- +2HCO3- = CaCO3↓+ CO32- +2H2O
B.向氨水中通入过量的SO2:NH3·H2O+SO2=NH4++HSO3-
C.氢氧化铁与足量氢碘酸反应: Fe(OH)3+3H+=Fe3++3H2O
D.苯酚钠溶液与二氧化碳反应:2+CO2+H2O 2C6H5OH +
.X、Y、Z、Q均为短周期元素,它们在周期表中相对位置如图所示。若X原子的最外层电子是内层电子数的2倍。下列说法中,正确的是( A )
A.X与Q的化合物中含有共价键
B.最高价氧化物对应水化物的酸性:Q比Z弱
C.氢化物稳定性:Z比Y强
D.Q与Fe反应生成的化合物中,铁元素显+3价
.下列叙述中,正确的是B
A.10ml0.1mol/L醋酸中加入几滴1mol/L H2SO4后,c(CH3COOH)/c(H+)变大
B.将0.2mol/L HCN和0.1mol/L NaOH等体积混合后:c(HCN)+c(CN-)=2c(Na+)
C.将20 ml 0.4mol/L硝酸铵溶液跟50 ml 0.1 mol/L氢氧化钡溶液混合:c(NO3-)>c(OH-)>c(NH4+)>c(Ba2+)
D.0.5mol/L的下列溶液中 ①NH3·H2O ②NH4Cl ③NH4HCO3 ④(NH4)2SO4,c(NH4+):④>③>②>①
.阿斯巴甜(Aapartame),具有清爽的甜味,甜度约为蔗糖200倍,其结构如图,有关阿斯巴甜的说法不正确的是A
A.阿斯巴甜分子式为:C14H17N2O5
B.分子结构中含有一个羧基
C.水解产物中含有2种氨基酸
D.阿斯巴甜在一定条件下既能与酸反应,又能与碱反应
.(18分)现有A、B、C、D、E五种短周期元素,已知:①元素的原子序数按A、B、C、D、E依次增大,原子半径按D、E、B、C、A顺序依次减小;②A、D同主族,A是所有元素中原子半径最小的元素;③通常状况下,A2、B2、C2三种单质均为常见无色气体;④ B.D、E三者的最高价氧化物对应的水化物依次为甲、乙、丙,它们两两之间均可反应生成可溶性盐和水,且所得盐中均含C元素。请填写下列空白:
(1)BA3的电子式 。
(2)将A2、C2按右图所示通入某燃料电池中,
其中,b电极为 极(填“正”或“负”),
电极反应式为 。
(3)E单质与乙的溶液反应生成物质丁和A2气体,
写出反应的离子方程式 。
(4)用石墨作电极,电解上述丁的水溶液500mL,两极产生气泡。持续电解一段时间后停止通电,在整个过程中阳极附近的溶液还可观察到的现象是
。
解释此现象的离子方程式是
。
当电路中通过amol电子时,阴、阳两极共产生气体 L(标准状况)。
A、B、C、D、E分别为H、N、O、Na、Al,(1)NH3,(2)正 O2+4e-+2H2O=4OH-
(3)2Al+2OH-+2H2O=2AlO2-+3H2↑
.(15分)芳香酯类化合物A、B互为同分异构体,均只含C、H、O三种元素。相同状况下,A、B蒸气对氢气的相对密度都是97,分子中C、H原子个数相同,且C、H原子总数是氧原子数的5倍。已知:各有机物之间存在如下转化关系:C和D是相对分子质量相同的不同类有机物;F经连续氧化可生成C。
(1)求A的分子式,写出推导及运算过程。
(2)B的结构简式是 。
(3)完全燃烧时,1 mol D与1 mol下列 的耗氧量相同(填字母代号)。
a.C3H6O3 b.C3H8O c.C2H4 d.C2H6O2
(4)水杨酸与小苏打反应的化学方程式是 。C与F反应的化学方程式是 。
(5)同时符合下列要求的同分异构体有 种。
①与A互为同分异构体;②可以水解;③苯环上有两个取代基,且苯环上的一氯代物只有1种。
(6)1 mol上述(5)中的一种有机物X,能与含4 mol NaOH的溶液恰好完全反应,写出此反应的化学方程式 。
(1)依题意有:,设A的分子式为(CH)5nO2n
则有13n +5n+32n = 194 n=2 ,故A的分子式为C10H10O4 (3分)
(2) (2分)
(3)a、c (2分)
(4)+NaHCO3 +CO2↑+H2O (2分)
HCOOH+CH3OHHCOOCH3+H2O (2分)
(5)3
(6)+4NaOH+2CH3COONa+2H2O(2分)
.(19分)A~G为中学常见的化合物,它们之间有如图所示的转化关系(反应条件及部分产物已略去)。A为绿色粉末,含H、C、O、Cu四种元素。常温下D为无色无味气体,B为黑色粉末,E能发生银镜反应。21世纪教育网
( http: / / www. / )
请回答:
(1)D跟G反应的化学方程式为_____________________________________;
(2)F中一定含有的官能团的名称为_______________________;
(3)某课外小组同学设计了下列实验装置,通过测定某些装置中试剂的质量变化,探究A中各元素的质量关系。
( http: / / www. / )
① 为使数据准确,还需补充装置,请你在方框内绘出装置图并写出试剂名称;
② 向装置中鼓入空气的目的是____________________________________________;
丙装置中药品的名称为________________,实验时,该药品未见明显变化,证明____________________________________________;
③ 如何判断A已完全分解?
____________________________________________________________________
____________________________________________________________________。
④ 更精确的测定得出如下数据:A受热后完全分解,固体由8.0 g变为6.0 g,装置乙增重0.90 g。写出A的化学式(表示为碱式盐):________________________。Cu3(OH)4CO3
(5)为比较Fe3+和Cu2+对H2O2分解的催化效果,某同学设计了右下图所示的实验。
①可通过观察
的现象来定性地得出结论。
②有A同学提出将CuSO4改为CuCl2更为合理,其理由是 。
若不采用A同学的改进方案,你认为还可以如何改进?
。
.(8分)复分解反应是中学化学中常见的一种反应类型。
(1)已知在常温下测得浓度均为0.1mol/L的下列6种溶液的pH值:
溶质 CH3COONa NaHCO3 Na2CO3 NaClO NaCN C6H5ONa
pH 8.8 9.7 11.6 10.3 11.1 11.3
复分解存在这样一个规律:一种较强酸与另一种较弱酸的盐可以自发地反应,生成较弱酸和较强酸的盐,如:2CH3COOH+Na2CO3===2CH3COONa+CO2↑+H2O 若换个角度看,它同时揭示出另一条规律,即碱性较强的物质发生类似反应可以生成碱性较弱的物质。依照该规律,请判断下列反应不能成立的是_______________________(填编号)。
A.CO2+H2O +2NaClO===Na2CO3+2HclO
B.CO2+H2O +NaClO===NaHCO3+HClO
C.CO2 +H2O +C6H5ONaNaHCO3+C6H5OH
D.CO2 +H2O +2C6H5ONaNa2CO3+2C6H5OH
E、Na2CO3+C6H5OHNaHCO3+C6H5ONa
F、CH3COOH+NaCN===CH3COONa+HCN
(2)根据前述信息判断,浓度均为0.05 mol/L的下列六种物质的溶液中,pH最小的是______(填编号);其pH为___________(填数值);pH最大的是_________(填编号)。
①C6H5OH ②CH3COOH ③HCN ④HClO ⑤H2SO4 ⑥HClO4
(3)一些复分解反应的发生还遵循其它的规律。下列转化都属于复分解反应:
①工业上将石灰乳与纯碱溶液混合可制得苛性钠溶液
②侯氏制碱法中,向饱和碳酸氢铵溶液中加入饱和食盐水可获得小苏打晶体
③蒸发KCl和NaNO3混合溶液,首先析出NaCl晶体
根据上述反应,总结出复分解反应发生的另一规律:
;
将KI溶液和AgCl固体混合搅拌,会观察到的现象是 ,
请写出反应的离子方程式:______________________________________________。
(1)A、D (2分,只选一个且正确给1分,只要错选给0分)
(2)⑤;1;①(各1分,共3分)
(3)复分解反应能够向生成更难溶(溶解度更小)物质的方向进行。 (1分)
白色固体变成黄色 (1分) I-+AgCl===AgI+Cl- (1分)
21世纪教育网
www.
C2入口
A2入口
a电极 电解液 b电极
KOH溶液
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
同课章节目录
- 第一章 遗传因子的发现
- 第1节 盂德尔的豌豆杂交实验(一)
- 第2节 孟德尔的豌豆杂交实验(二)
- 第二章 基因和染色体的关系
- 第1节 减数分裂和受精作用
- 第2节 基因在染色体上
- 第3节 伴性遗传
- 第三章 基因的本质
- 第1节 DNA是主要的遗传物质
- 第2节 DNA分子的结构
- 第3节 DNA的复制
- 第4节 基因是有遗传效应的DNA片段
- 第四章 基因的表达
- 第1节 基因指导蛋白质的合成
- 第2节 基因对性状的控制
- 第3节 遗传密码的破译(选学)
- 第五章 基因突变及其他变异
- 第1节 基因突变和基因重组
- 第2节 染色体变异
- 第3节 人类遗传病
- 第六章 从杂交育种到基因工程
- 第1节 杂交育种与诱变育种
- 第2节 基因工程及其应用
- 第七章 现代生物进化理论
- 第1节 现代生物进化理论的由来
- 第2节 现代生物进化理论的主要内容
