鲁科版化学物质与结构 性质(选修)第三章第二节金属晶体与离子晶体24ppt
文档属性
| 名称 | 鲁科版化学物质与结构 性质(选修)第三章第二节金属晶体与离子晶体24ppt |
|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-19 00:00:00 | ||
图片预览


文档简介
(共24张PPT)
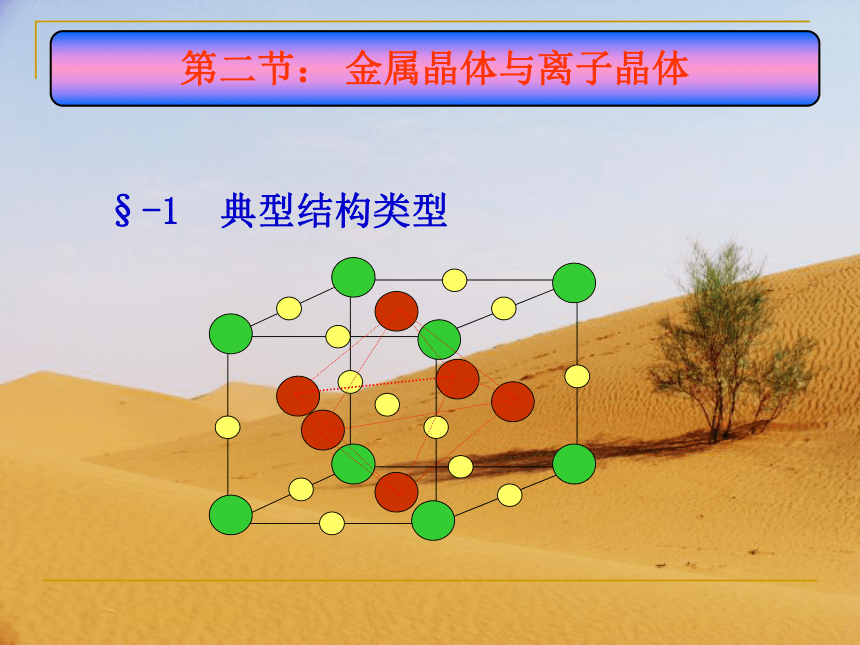
§-1 典型结构类型
第二节: 金属晶体与离子晶体
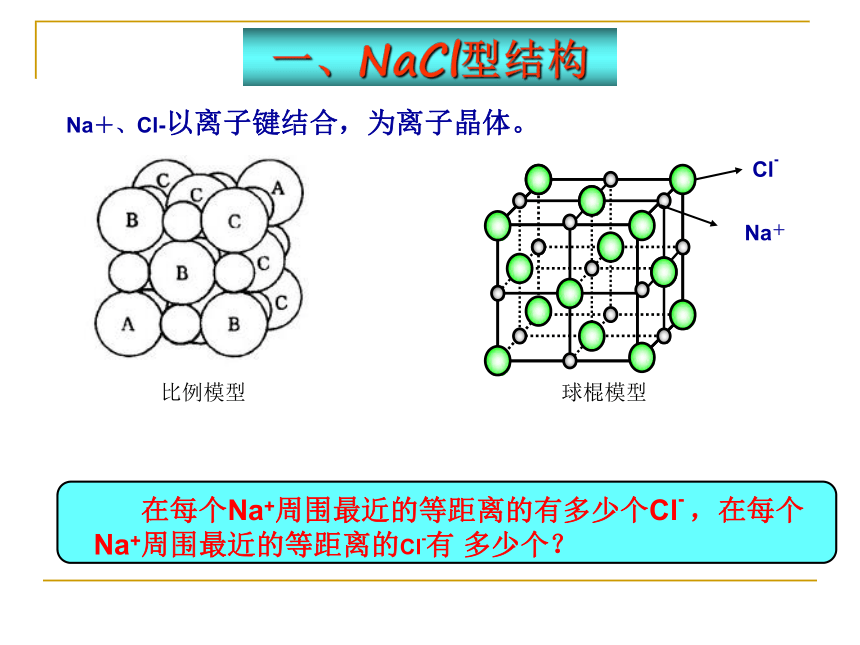
一、NaCl型结构
Na+、Cl-以离子键结合,为离子晶体。
比例模型
球棍模型
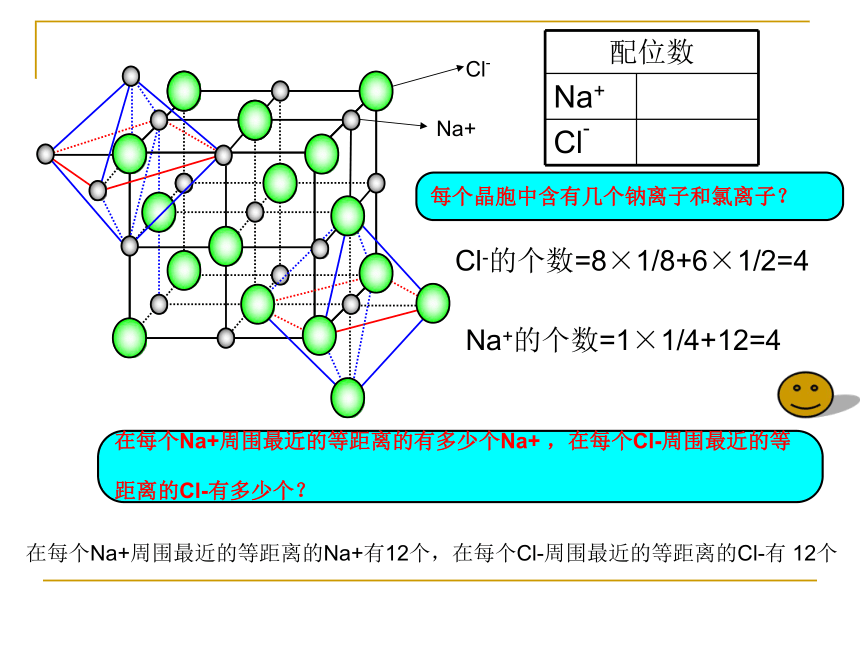
Cl-的个数=8×1/8+6×1/2=4
在每个Na+周围最近的等距离的Na+有12个,在每个Cl-周围最近的等距离的Cl-有 12个
每个晶胞中含有几个钠离子和氯离子?
在每个Na+周围最近的等距离的有多少个Na+ ,在每个Cl-周围最近的等
距离的Cl-有多少个?
Na+的个数=1×1/4+12=4
配位数
Na+
Cl-
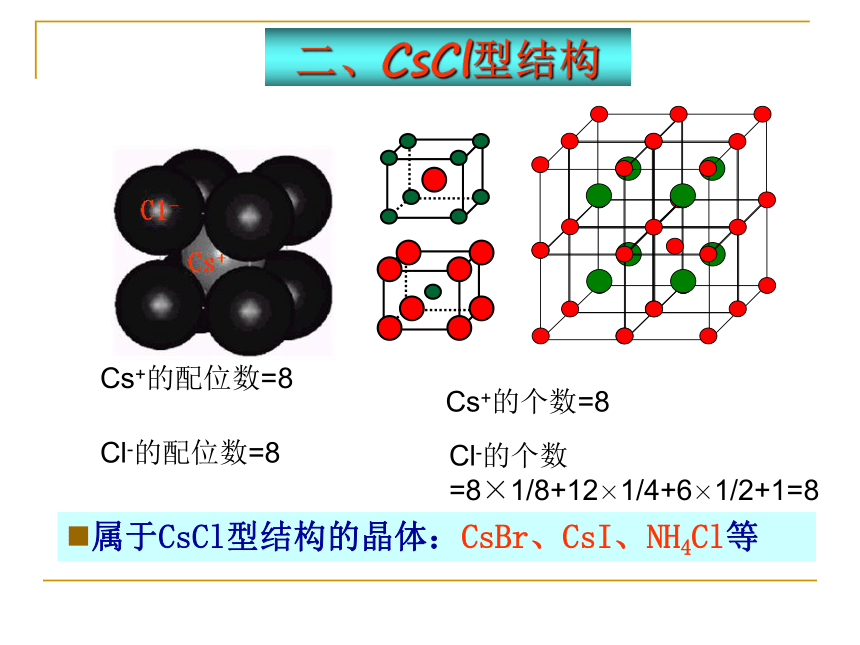
二、CsCl型结构
属于CsCl型结构的晶体:CsBr、CsI、NH4Cl等
Cs+的配位数=8
Cl-的配位数=8
Cl-的个数=8×1/8+12×1/4+6×1/2+1=8
Cs+的个数=8
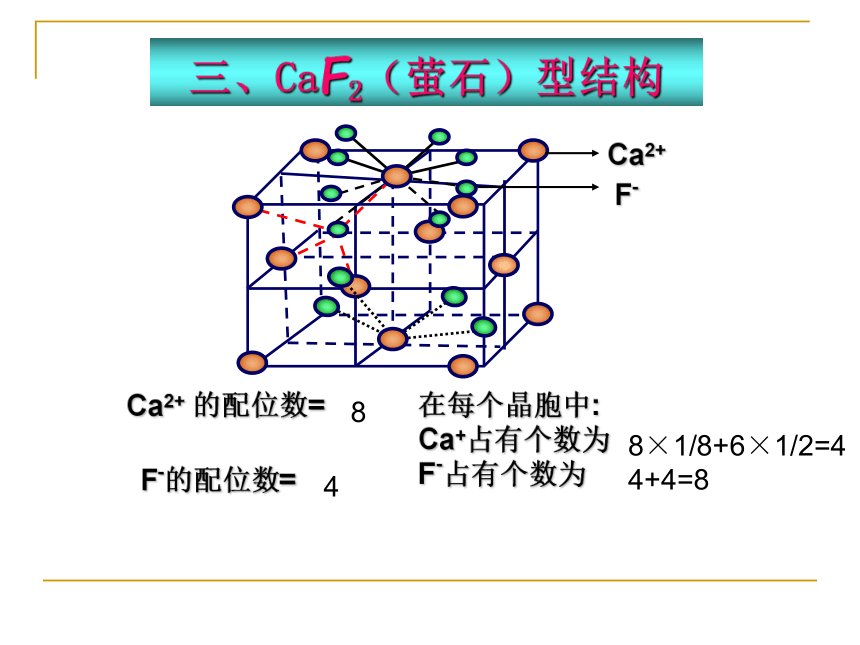
三、CaF2(萤石)型结构
Ca2+ 的配位数=
F-的配位数=
在每个晶胞中:
Ca+占有个数为
F-占有个数为
8
4
8×1/8+6×1/2=4
4+4=8
立方体晶胞中各位置上原子总数的计算方法分别是:
顶角上的原子总数
=1/8×顶角原子数
棱上的原子总数
面心上的原子总数
=1/4×棱上的原子数
=1/2×面心上的原子数
体心上的原子总数
=1×体心原子数
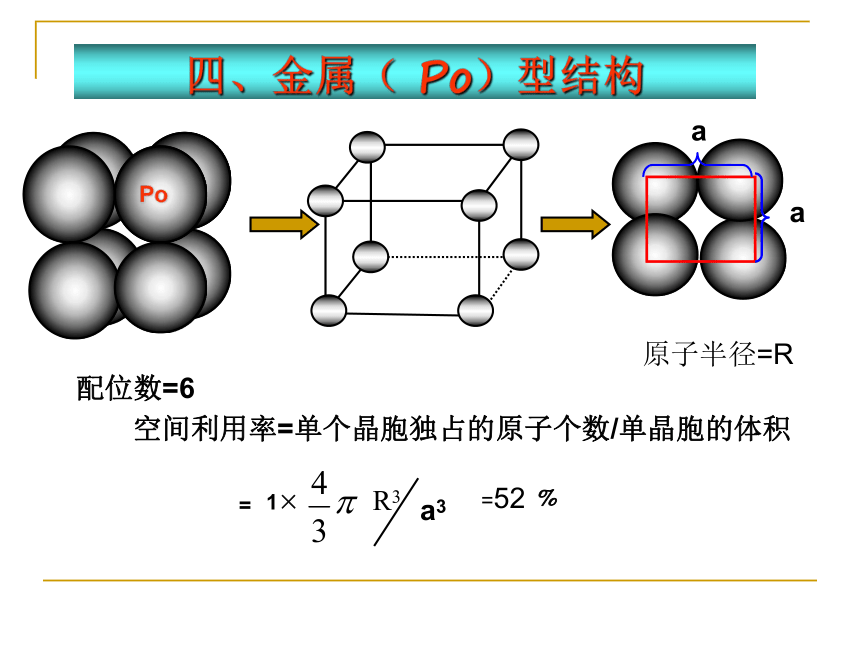
配位数=6
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
四、金属( Po)型结构
a
a
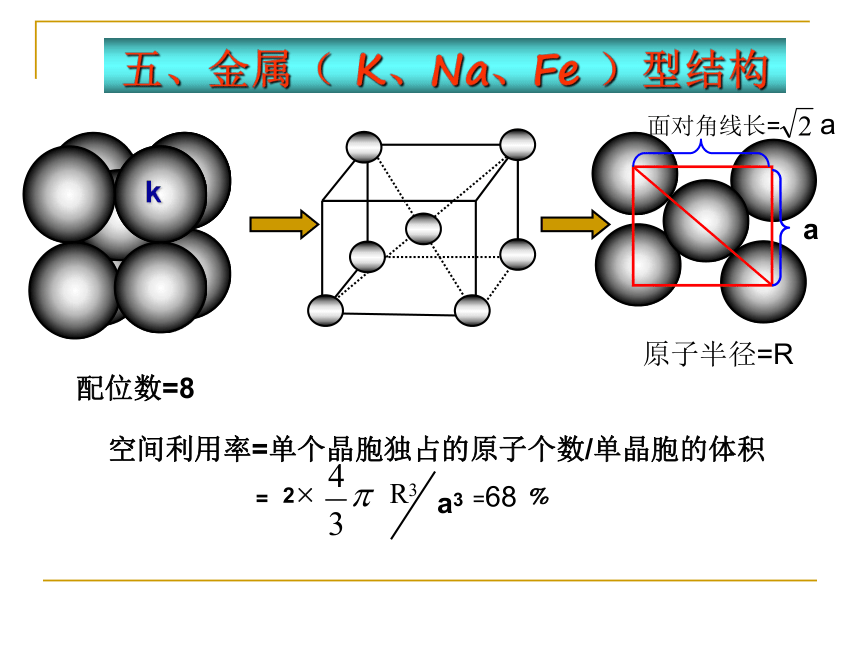
配位数=8
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
面对角线长= a
a
五、金属( K、Na、Fe )型结构
平行六面体
回顾镁型的晶胞
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
六、金属( Mg、Zn、Ti)型结构
a
a
a
找铜型的晶胞
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
七、金属( Cu、Ag、Au)型结构
a
单个晶胞独占的原子个数=8*1/8+6*1/2=4
原子在晶胞的顶点处:
原子在晶胞的棱上:
原子在晶胞的面上:
体心:1
原子在晶胞的体心处:
§-1 典型结构类型
第二节: 金属晶体与离子晶体
一、NaCl型结构
Na+、Cl-以离子键结合,为离子晶体。
比例模型
球棍模型
Cl-的个数=8×1/8+6×1/2=4
在每个Na+周围最近的等距离的Na+有12个,在每个Cl-周围最近的等距离的Cl-有 12个
每个晶胞中含有几个钠离子和氯离子?
在每个Na+周围最近的等距离的有多少个Na+ ,在每个Cl-周围最近的等
距离的Cl-有多少个?
Na+的个数=1×1/4+12=4
配位数
Na+
Cl-
二、CsCl型结构
属于CsCl型结构的晶体:CsBr、CsI、NH4Cl等
Cs+的配位数=8
Cl-的配位数=8
Cl-的个数=8×1/8+12×1/4+6×1/2+1=8
Cs+的个数=8
三、CaF2(萤石)型结构
Ca2+ 的配位数=
F-的配位数=
在每个晶胞中:
Ca+占有个数为
F-占有个数为
8
4
8×1/8+6×1/2=4
4+4=8
立方体晶胞中各位置上原子总数的计算方法分别是:
顶角上的原子总数
=1/8×顶角原子数
棱上的原子总数
面心上的原子总数
=1/4×棱上的原子数
=1/2×面心上的原子数
体心上的原子总数
=1×体心原子数
配位数=6
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
四、金属( Po)型结构
a
a
配位数=8
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
面对角线长= a
a
五、金属( K、Na、Fe )型结构
平行六面体
回顾镁型的晶胞
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
六、金属( Mg、Zn、Ti)型结构
a
a
a
找铜型的晶胞
配位数=12
空间利用率=单个晶胞独占的原子个数/单晶胞的体积
原子半径=R
七、金属( Cu、Ag、Au)型结构
a
单个晶胞独占的原子个数=8*1/8+6*1/2=4
原子在晶胞的顶点处:
原子在晶胞的棱上:
原子在晶胞的面上:
体心:1
原子在晶胞的体心处:
