课题2 酸和碱的中和反应第一课时 中和反应及其应用(共18张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应第一课时 中和反应及其应用(共18张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 3.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-19 16:24:22 | ||
图片预览



文档简介
(共21张PPT)
课题2 酸和碱的中和反应
第一课时
中和反应及其应用
唐山市第七十五中学
试设计对比实验对你的猜想或观点加以验证(证实或证伪)。
探究:你能确定氢氧化钠与
盐酸发生了反应?
仪器:试管(4支)、滴管(2支)、烧杯
药品:NaOH溶液、稀盐酸(HCl)、
酚酞试液、石蕊试液、蒸馏水。
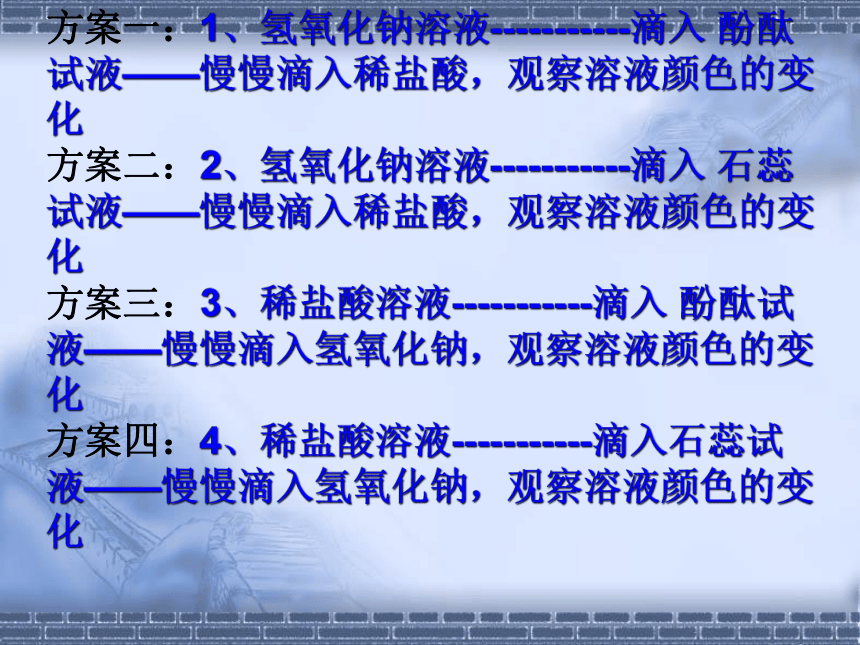
方案一:1、氢氧化钠溶液-----------滴入 酚酞试液——慢慢滴入稀盐酸,观察溶液颜色的变化
方案二:2、氢氧化钠溶液-----------滴入 石蕊试液——慢慢滴入稀盐酸,观察溶液颜色的变化
方案三:3、稀盐酸溶液-----------滴入 酚酞试液——慢慢滴入氢氧化钠,观察溶液颜色的变化
方案四:4、稀盐酸溶液-----------滴入石蕊试液——慢慢滴入氢氧化钠,观察溶液颜色的变化
探究方案:1、在试管中加入 约少量氢氧化钠溶液,滴入 2滴酚酞试液,观察现象。
2、用滴管慢慢滴入稀盐酸,并不断振荡,注意观察溶液颜色的变化
结论:氢氧化钠与盐酸 发生
反应。
可以
NaOH+HCl=NaCl+H2O
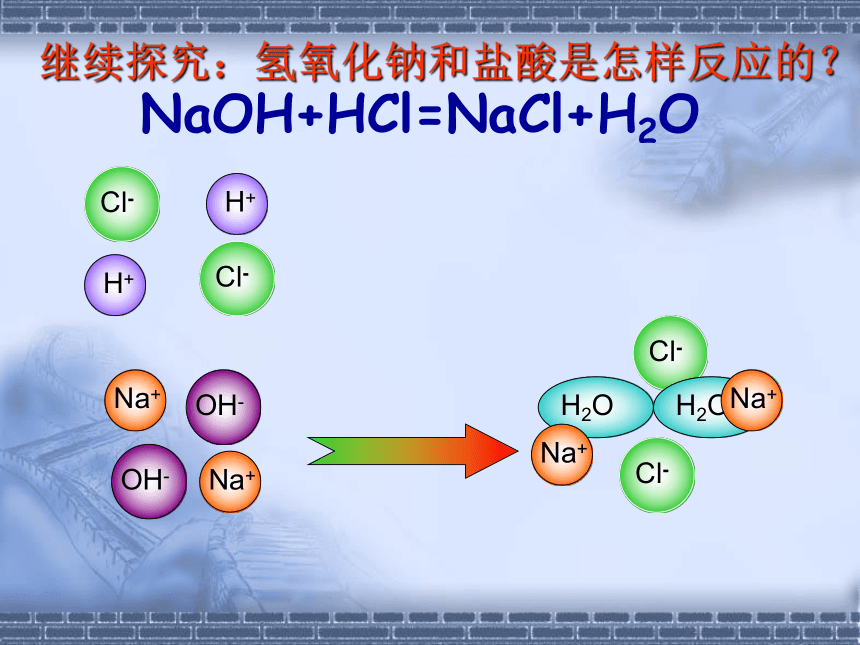
继续探究:氢氧化钠和盐酸是怎样反应的?
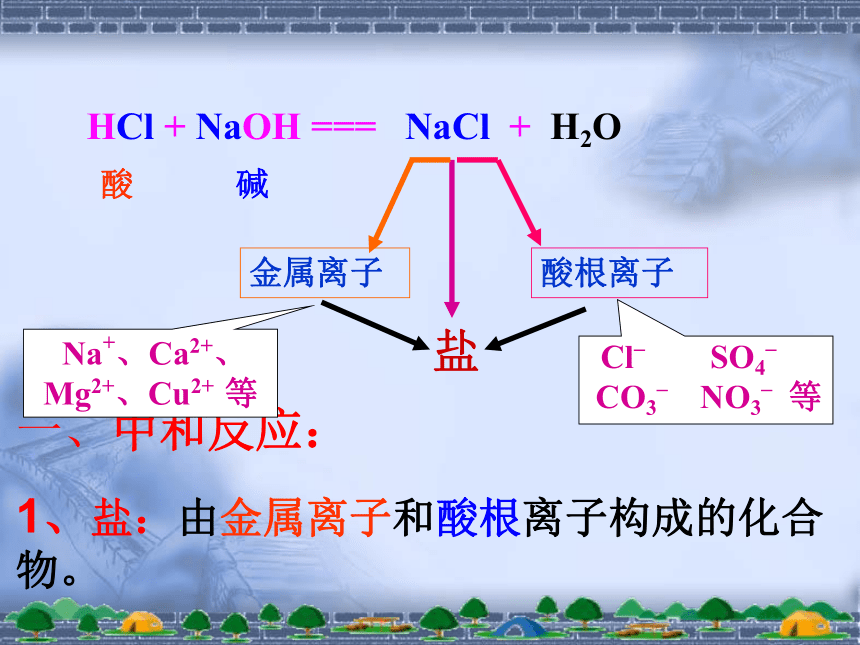
HCl + NaOH === NaCl + H2O
碱
酸
金属离子
酸根离子
Cl_ SO4_
CO3_ NO3_ 等
一、中和反应:
1、盐:由金属离子和酸根离子构成的化合物。
Na+、Ca2+、Mg2+、Cu2+ 等
其他酸和碱的反应
2NaOH+H2SO4=Na2SO4+2H2O
2HCl + Mg(OH)2= MgCl2 + 2H2O
Cu(OH)2 + H2 SO4 === CuSO4 + 2H2O
总结这三个反应的共同点
你明白了没有?
练一练
1、下列反应中属于中和反应的是( )
A.Zn + 2HCl ZnCl2 +H2↑
B.CuO + 2HCl CuCl2+ H2O
C.Cu(OH)2+ H2SO4 CuSO4 + 2H2O
D. CO2+Ca(OH)2 CaCO3 +H2O
C
思考:你认为判断一个反应是不是中和反应的关键是什么?
关键:反应物必须是酸和碱
酸与金属氧化物,而不是酸和碱
碱和非金属氧化物,
也不是酸和碱
中和反应的实质
+
1 :1 :1
2HCl + Ca(OH)2 == CaCl2 +2 H2O
完成下列中和反应的化学方程式:
① 2Al(OH)3 + 3H2SO4 === +
② KOH + === K2SO4 +
Al2(SO4)3 3H2O
2 H2SO4 2H2O
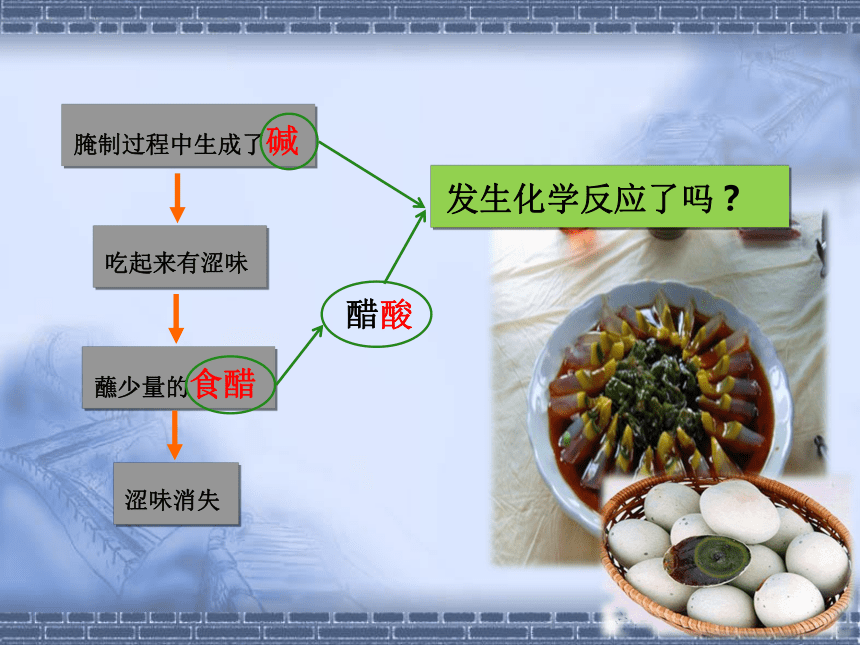
那通过我们上边的学习,你能解释为什么醋酸能除去皮蛋中的涩味吗?
1.改变土壤的酸碱性
因NaOH碱性太强,价格贵,所以用熟石灰
小问题:为何不用NaOH呢?
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
3HCl+Al(OH)3=AlCl3+3H2O
3. 用于医药
盐酸
氢氧化铝
反应方程式
1. 下列物质属于盐的是 ( )
A ﹒HNO3 B﹒Fe2O3
C﹒Ca(OH)2 D﹒Na2CO3
2. 在滴有石蕊试液的氢氧化钠溶液中加入过量盐酸,加盐酸前后溶液的颜色依次为( )
A﹒ 紫色、红色 B﹒红色、蓝色
C﹒ 蓝色、红色 D﹒红色、无色
练习巩固
D
C
学完本节课你知道了什么?
一、中和反应:
1、盐:由金属离子和酸根离子构成的化合物。
2、中和反应:
酸和碱作用生成盐和水的反应。
二、中和反应的应用:
1、农业 2、工业 3、生活
再见
课题2 酸和碱的中和反应
第一课时
中和反应及其应用
唐山市第七十五中学
试设计对比实验对你的猜想或观点加以验证(证实或证伪)。
探究:你能确定氢氧化钠与
盐酸发生了反应?
仪器:试管(4支)、滴管(2支)、烧杯
药品:NaOH溶液、稀盐酸(HCl)、
酚酞试液、石蕊试液、蒸馏水。
方案一:1、氢氧化钠溶液-----------滴入 酚酞试液——慢慢滴入稀盐酸,观察溶液颜色的变化
方案二:2、氢氧化钠溶液-----------滴入 石蕊试液——慢慢滴入稀盐酸,观察溶液颜色的变化
方案三:3、稀盐酸溶液-----------滴入 酚酞试液——慢慢滴入氢氧化钠,观察溶液颜色的变化
方案四:4、稀盐酸溶液-----------滴入石蕊试液——慢慢滴入氢氧化钠,观察溶液颜色的变化
探究方案:1、在试管中加入 约少量氢氧化钠溶液,滴入 2滴酚酞试液,观察现象。
2、用滴管慢慢滴入稀盐酸,并不断振荡,注意观察溶液颜色的变化
结论:氢氧化钠与盐酸 发生
反应。
可以
NaOH+HCl=NaCl+H2O
继续探究:氢氧化钠和盐酸是怎样反应的?
HCl + NaOH === NaCl + H2O
碱
酸
金属离子
酸根离子
Cl_ SO4_
CO3_ NO3_ 等
一、中和反应:
1、盐:由金属离子和酸根离子构成的化合物。
Na+、Ca2+、Mg2+、Cu2+ 等
其他酸和碱的反应
2NaOH+H2SO4=Na2SO4+2H2O
2HCl + Mg(OH)2= MgCl2 + 2H2O
Cu(OH)2 + H2 SO4 === CuSO4 + 2H2O
总结这三个反应的共同点
你明白了没有?
练一练
1、下列反应中属于中和反应的是( )
A.Zn + 2HCl ZnCl2 +H2↑
B.CuO + 2HCl CuCl2+ H2O
C.Cu(OH)2+ H2SO4 CuSO4 + 2H2O
D. CO2+Ca(OH)2 CaCO3 +H2O
C
思考:你认为判断一个反应是不是中和反应的关键是什么?
关键:反应物必须是酸和碱
酸与金属氧化物,而不是酸和碱
碱和非金属氧化物,
也不是酸和碱
中和反应的实质
+
1 :1 :1
2HCl + Ca(OH)2 == CaCl2 +2 H2O
完成下列中和反应的化学方程式:
① 2Al(OH)3 + 3H2SO4 === +
② KOH + === K2SO4 +
Al2(SO4)3 3H2O
2 H2SO4 2H2O
那通过我们上边的学习,你能解释为什么醋酸能除去皮蛋中的涩味吗?
1.改变土壤的酸碱性
因NaOH碱性太强,价格贵,所以用熟石灰
小问题:为何不用NaOH呢?
某硫酸厂排出的废水中含有硫酸等杂质,严重危害当地的生态环境,你会怎样处理这些废水呢?
用碱性物质(例如熟石灰)进行中和处理。
Ca(OH)2 + H2 SO4 == CaSO4 + 2H2O
3HCl+Al(OH)3=AlCl3+3H2O
3. 用于医药
盐酸
氢氧化铝
反应方程式
1. 下列物质属于盐的是 ( )
A ﹒HNO3 B﹒Fe2O3
C﹒Ca(OH)2 D﹒Na2CO3
2. 在滴有石蕊试液的氢氧化钠溶液中加入过量盐酸,加盐酸前后溶液的颜色依次为( )
A﹒ 紫色、红色 B﹒红色、蓝色
C﹒ 蓝色、红色 D﹒红色、无色
练习巩固
D
C
学完本节课你知道了什么?
一、中和反应:
1、盐:由金属离子和酸根离子构成的化合物。
2、中和反应:
酸和碱作用生成盐和水的反应。
二、中和反应的应用:
1、农业 2、工业 3、生活
再见
同课章节目录
