人教版高中化学选修4教学讲义,复习补习资料(含典例分析,巩固练习):20【提高】电解原理
文档属性
| 名称 | 人教版高中化学选修4教学讲义,复习补习资料(含典例分析,巩固练习):20【提高】电解原理 |

|
|
| 格式 | zip | ||
| 文件大小 | 564.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-21 00:00:00 | ||
图片预览



文档简介
电解原理
【学习目标】
1、了解电解池的工作原理;
2、初步掌握一般电解反应产物的判断方法。
【典型例题】
类型一、电化学中电极及电极反应的判断
例1 蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生蓄电池分别在充电和放电时发生的反应: 下列有关爱迪生蓄电池的推断错误的是: A.放电时,Fe是负极,NiO2是正极 B.蓄电池的电极可以浸入某中酸性电解质溶液中 C.充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- D.放电时,电解质溶液中的阴离子向正极方向移动 【答案】B、D。
【解析】蓄电池放电时起原电池作用,原电池的负极是较活泼的金属,A正确。放电时,Fe是原电池的负极,Fe失电子被氧化成Fe2+离子。由于负极——Fe的附近聚集较多的Fe2+离子,电解质溶液中的阴离子向负极移动,D不正确。充电时蓄电池起电解池作用,充电时电源的负极应与蓄电池的负极(Fe,此时作为电解池的阴极)相连接,发生还原反应:Fe(OH)2+2e-=Fe+2OH-。C正确。该蓄电池的放电和充电时的电极反应分别是: 放电:负极 ??Fe-2e-+ 2OH-=Fe(OH)2 正极 NiO2+2e-+2H2O=Ni(OH)2+2OH- 充电:阴极 ?Fe(OH)2+2e-=Fe+2OH- 阳极 Ni(OH)2-2e-+2OH-=NiO2+2H2O 可见反应是在碱性溶液中进行的,B不正确。
举一反三:
【变式1】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )?
A.逸出气体的体积:a电极的小于b电极的
B.电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【答案】D
【解析】Na2SO4=2Na++SO42-,H2OH++OH-,SO42-和OH-移向b电极,Na+和H+移向a电极,在b电极 上:4OH--4e-?= 2H2O+O2↑,在a电极上:4H++4e-?= 2H2↑,所以a电极产生的气体体积大于b电极;两种气体均为无色无味的气体;由于a电极上H+放电,所以a电极附近的c(OH-)>c(H+),滴加石蕊试液a电极附近变蓝色,同理,b电极附近变红色。
例2镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH
已知:6NiOOH+NH3+H2O+OH﹣=6 Ni(OH)2+NO2﹣
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣
B.充电过程中OH﹣离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e﹣=MH+OH﹣,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
【思路点拨】做对本题的关键是根据充电过程的总反应方程式能正确书写充电、放电时的电极反应式。
【答案】A
【解析】镍氢电池中主要为KOH作电解液。
充电时,阳极反应:Ni(OH)2+OH﹣=NiOOH+H2O+e﹣、阴极反应:M+H2O+e﹣=MH+OH﹣,总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣,负极:MH+OH﹣=M+H2O+e﹣,总反应:MH+NiOOH=M+Ni(OH)2
以上式中M为储氢合金,MH为吸附了氢原子的储氢合金。
A.正极的电极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣,故A正确;
B.电解时阴离子向阳极移动,阳离子向阴极移动,所以OH﹣离子从阴极向阳极迁移,故B错误;
C.H2O中的H得电子,不是被M还原,故C错误;
D.不能用氨水做电解质溶液,根据已知有氨气时容易发生副反应生成亚硝酸根,故D错误;
故选A。 【总结升华】书写电极反应式的3个原则:
(1)共存原则
因为物质得失电子后在不同介质中的存在形式不同,所以电极反应式的书写必须考虑介质环境。当电解质溶液呈酸性时,不可能有OH-参加反应;碱性溶液中CO2不可能存在,也不可能有H+参加反应。
(2)得氧失氧原则
得氧时,在反应物中加H2O(电解质为酸性时)或OH-(电解质溶液为碱性或中性时);失氧时,在反应物中加H2O(电解质为碱性或中性时)或H+(电解质为酸性时)。
(3)中性吸氧反应成碱原则
在中性电解质溶液中,通过金属吸氧所建立起来的原电池反应,其反应的最后产物是碱。
举一反三:
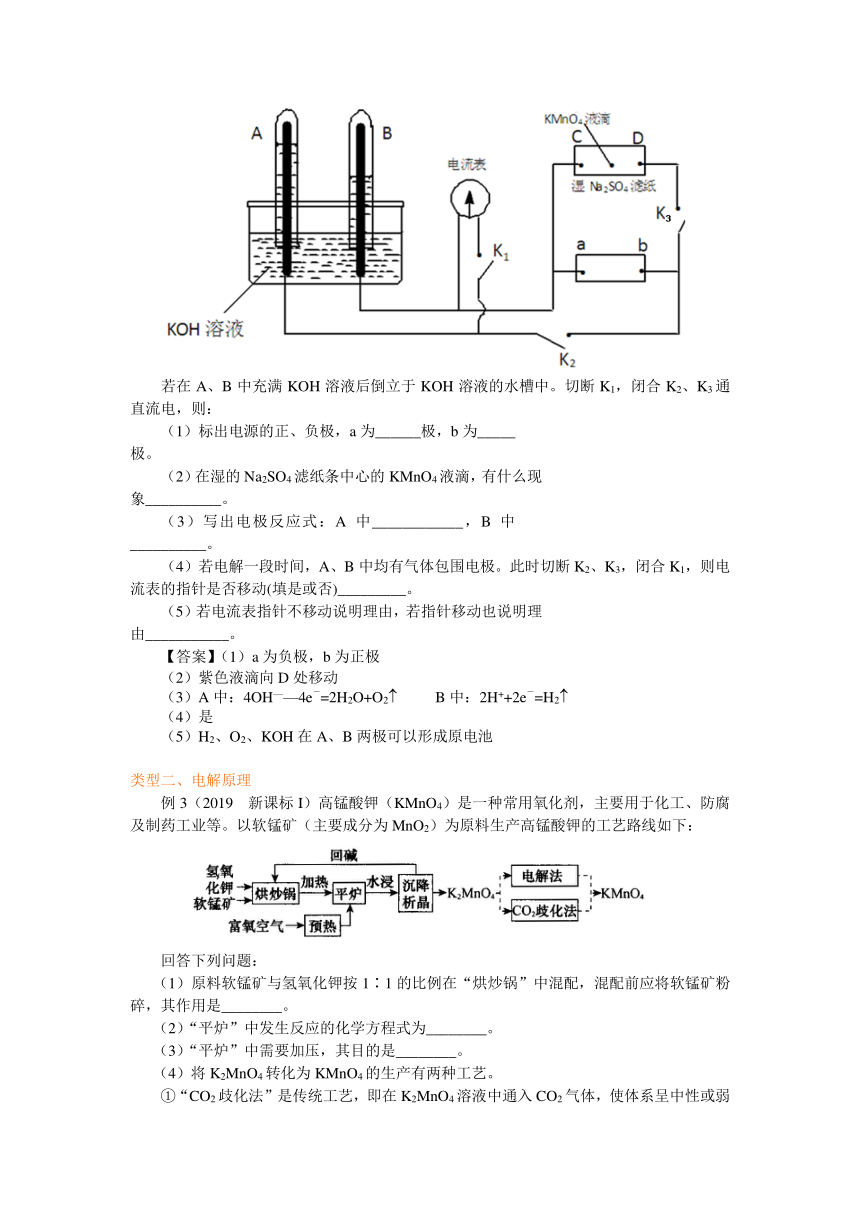
【变式1】如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。
若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电,则:
(1)标出电源的正、负极,a为______极,b为_____极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象__________。
(3)写出电极反应式:A中____________,B中__________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针是否移动(填是或否)_________。
(5)若电流表指针不移动说明理由,若指针移动也说明理由___________。
【答案】(1)a为负极,b为正极
(2)紫色液滴向D处移动
(3)A中:4OH——4e-=2H2O+O2( B中:2H++2e-=H2(
(4)是
(5)H2、O2、KOH在A、B两极可以形成原电池
类型二、电解原理
例3(2019 新课标I)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是________。
(2)“平炉”中发生反应的化学方程式为________。
(3)“平炉”中需要加压,其目的是________。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应。反应中生成KMnO4、MnO2和________(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液。电解槽中阳极发生的电极反应为________,阴极逸出的气体是________。
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为________。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L-1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL。该样品的纯度为________(列出计算式即可,已知2MnO4-+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O)。
【思路点拨】本题结合化学工艺流程考查氧化还原反应、电解原理、滴定的相关计算等。工艺路线比较简单,难度不大,做计算的时候要格外小心。
【答案】(1)增大反应物接触面积,加快反应速率,提高原料利用率
(2)2MnO2+O2+4KOH2K2MnO4+2H2O
(3)提高氧气的压强,加快反应速率,增加软锰矿转化率
(4)①KHCO3 ②MnO42--e-==MnO4- H2 ③3∶2
(5)
【解析】(1)将软锰矿粉碎可以增大反应物间的接触面积,加快反应速率,提高原料利用率。(2)从平炉中出来的物质经水浸、沉降析出K2MnO4,说明平炉中的MnO2被富氧空气氧化为K2MnO4,根据氧化还原反应规律和电子得失守恒完成反应的化学方程式为2MnO2+O2+4KOH2K2MnO4+2H2O。(3)平炉加压,可以增大富氧空气的浓度,加快反应速率,提高MnO2的转化率。(4)①该反应为歧化反应,变价元素只有Mn,根据电子守恒可知生成的KMnO4与MnO2的物质的量之比为2∶1,配平反应方程式得3K2MnO4+4CO2+2H2O=2KMnO4+MnO2+4KHCO3,故另一产物为KHCO3。②电解时阳极发生氧化反应,即MnO42-转化为MnO4-;MnO42--e-==MnO4-,放电顺序:H+>K+,故阴极H+放电生成H2。③由以上分析可知,“CO2歧化法”中,K2MnO4只有2/3转化为KMnO4,而“电解法”中K2MnO4的转化率为100%;,故理论上两种方法K2MnO4的利用率之比为2∶3。(5)根据题给反应的离子方程式可知:2KMnO4~5H2C2O4,则样品的纯度为。
【总结升华】电解池与原电池最根本的区别是有无外加电源,有外加电源的装置是电解池。电解池中两极名称为阴、阳极,阴极发生还原反应,阳极发生氧化反应;而原电池中的两极名称为正、负极,一般不称为阴、阳极。
举一反三:
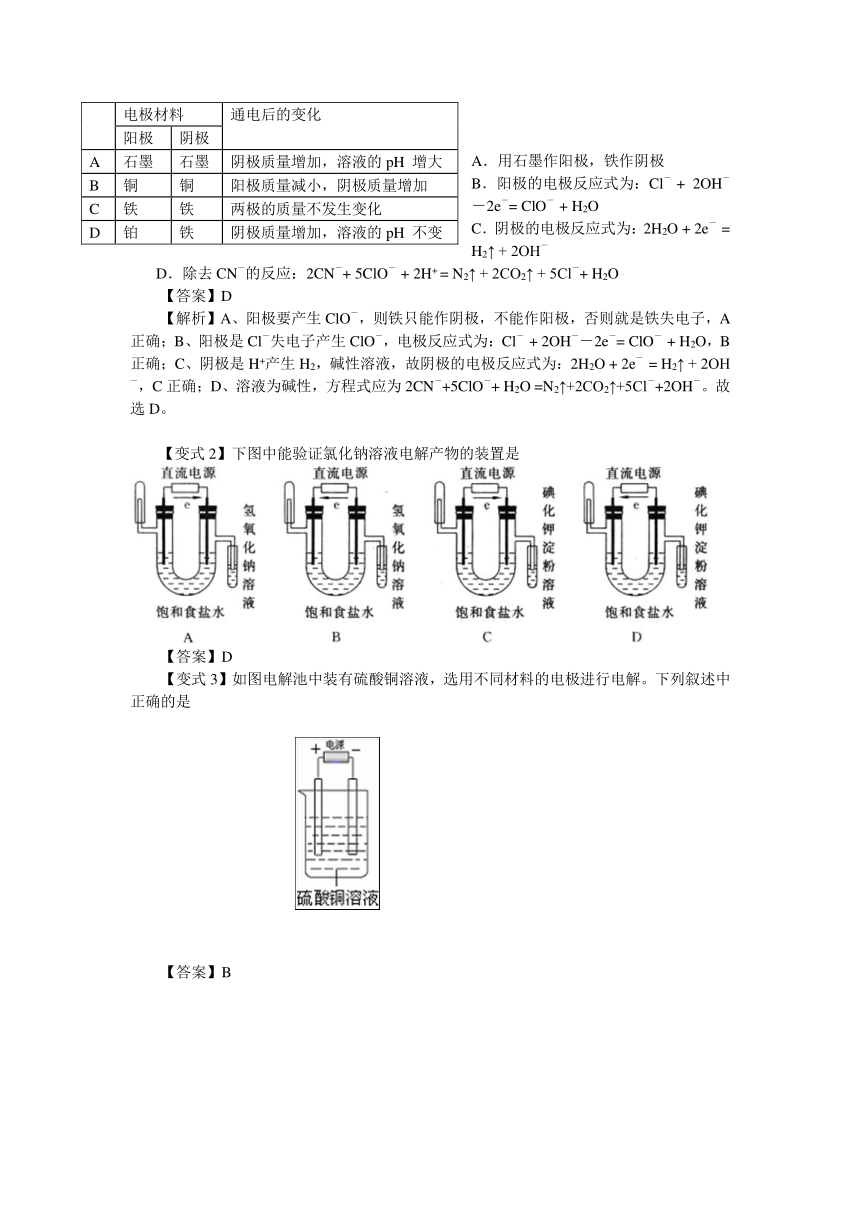
【变式1】(2019 四川高考)用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
【答案】D
【解析】A、阳极要产生ClO-,则铁只能作阴极,不能作阳极,否则就是铁失电子,A正确;B、阳极是Cl-失电子产生ClO-,电极反应式为:Cl- + 2OH--2e-= ClO- + H2O,B正确;C、阴极是H+产生H2,碱性溶液,故阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-,C正确;D、溶液为碱性,方程式应为2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2OH-。故选D。
【变式2】下图中能验证氯化钠溶液电解产物的装置是
【答案】D
【变式3】如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下列叙述中正确的是
电极材料
通电后的变化
阳极
阴极
A
石墨
石墨
阴极质量增加,溶液的pH 增大
B
铜
铜
阳极质量减小,阴极质量增加
C
铁
铁
两极的质量不发生变化
D
铂
铁
阴极质量增加,溶液的pH 不变
【答案】B
【巩固练习】
一、选择题
1.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )。 ①CuSO4 ②BaCl2 ③AgNO3 ④H2SO4
A.①② B.①③
C.①④ D.②④
2.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )。
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
3.下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b选项
X
Y
A
MgSO4
CuSO4
B
AgNO3
Pb(NO3)2
C
FeSO4
Al2?(SO4)3
D
CuSO4
AgNO3
4.(2019 江西遂川县模拟)关于如图电解池工作时的相关叙述正确的是(???)。
A.Fe电极作阳极,发生氧化反应
B.Cl-向石墨极作定向运动
?C.石墨电极反应:Fe3++3e-=Fe3+
D. 电解池发生总反应:2Cl-+2Fe3+ Cl2↑+2Fe2+
5.如图所示是电解CuCl2溶液装置,其中c、d为石墨电极,已知溶液中Cl-向c极移动,则下列有关判断正确的是( )。
A.a为负极,b为正极
B.c为阳极,d为阴极
C.电解过程中,d极质量减小
D.电解过程中,Cl-浓度不变
6.关于电解NaCl水溶液,下列叙述正确的是( )。
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7.在水中加入等物质的量Ag+,Pb2+,K+,SO42-,Cl-,NO3-,再用惰性电极电解片刻,则氧化产物和还原产物的质量之比为( )。
A.35.5∶108 B.16∶207
C.8∶1 D.35.5∶1
8.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )。
A.CuCl2 [CuO] B.NaOH [NaOH] C.NaCl [HCl] D.Na2SO4 [NaOH]
9.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )。
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
10.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈为浅红色。则下列说法错误的是( )。
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
11.关于右图所示装置的判断,叙述正确的是( )。
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
12.某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:(1)阳极质量不变;(2)阴极质量增加;(3)电解液pH减小,则应选用的电极是( ) A.阴阳两极都用石墨 B.铜作阳极铁作阴极 C.铁作阳极铜作阴极 D.铂作阳极铜作阴极 13.常温时,将500 mL pH=5的CuSO4?溶液用石墨电极电解一段时间,测得溶液的pH变为2,若使溶液的浓度、pH与电解前相同,可采用的方法( )。? A.向溶液中加入0.245g Cu(OH)2? B.向溶液中加0.31g CuSO4 C.向溶液中加0.0025 mol H2SO4并加热 D.向溶液中加0.2g CuO
二、非选择题
1.从H+、Cu2+、Ba2+、Na+、Cl-、SO42- 6种离子中两两恰当地组成电解质,按下列要求进行电解,请填空:
(1)以碳棒为电极,使电解质的质量减少,水量不变,进行电解,则采用的电解质是________。
(2)以碳棒为电极,使电解质的质量不变,水量减少,进行电解,则采用的电解质是________。
(3)以铂为电极,使电解质和水量都减少,进行电解,则采用的电解质是________。
2.工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生反应的电极反应式 阳极:________;阴极:________。
(2)写出Cr2O72-变为Cr3+的离子方程式:________。
(3)工业废水由酸性变为碱性的原因是________。
(4)________(填“能”或“不能”)改用石墨作电极,原因是________。
3.(2019 北京丰台二模)低浓度SO2废气的处理是工业难题,目前常用的两种方法如下:
方法Ⅰ:
(1)反应器中发生反应:3H2(g) + SO2 (g) H2S(g) + 2H2O(g)
①H2S的稳定性比H2O (填“强”或“弱”),
原因是 ,元素的非金属性减弱。
②SO2的平衡转化率随温度(T)、压强(P)的变化如右图所示,
随温度升高,化学平衡常数K的变化趋势是 。
比较P1和P2的大小关系 ,请简述理由 。
(2)工业上先用二乙醇胺吸收H2S,然后在再生塔中加热分解重新获得H2S,主要目的是 。
(3)燃烧室内,1mol H2S气体完全燃烧生成固态硫磺及气态水,释放a kJ能量,其热化学方程式为 。
方法Ⅱ:
(4)Na2SO3溶液吸收SO2的化学方程式是 。
(5)通过电解法可分离NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
简述分离NaHSO3与Na2SO3混合物的原理 。
【答案与解析】
一、选择题
1.B
【解析】阴极质量增加,说明溶液中含有不活泼金属的阳离子;电解液的pH下降,说明在阳极上是OH-离子放电,而金属离子相应的阴离子应是含氧酸的酸根,故本题的答案应为不活泼金属的含氧酸盐,选B。
2.A
【解析】由a极板质量增加,知溶液中阳离子在a极板析出。则a为阴极,X为负极;B中a极板不析出金属,B错;C中X为正极,C错;又由b极板有无色、无臭气体放出,D错。
3.D
【解析】电解过程中,Pt电极为惰性电极,电极b和d均为阴极,电极上没有气体逸出,但质量均增大,说明金属阳离子放电析出,要使增重b4.A
【解析】由电子转移方向可知石墨为阴极,铁为阳极。A项电子流出的一极是电源的负极,故Fe连接电源的正极,为阳极,故A正确;B项电解质溶液中,阴离子向阳极移动,Fe连接电源的正极,为阳极,故Cl-向Fe极作定向运动,故B错误;C项石墨是电解池的阴极,发生还原反应,电极反应为Fe3++e-=Fe2+,故C错误;D项Fe连接电源的正极,为阳极,是活性电极,Fe反应氧化反应生成Fe2+,石墨是电解池的阴极,发生还原反应,Fe3+放电生成Fe2+,故电解池发生总反应Fe+2Fe3+ 3Fe2+,故D错误。故选A。
5.B
【解析】电解质溶液中Cl-向c极移动,说明电解质溶液中电流的方向由c指向d,则电源内部电流方向由b指向a,因此b为电源负极,a为电源正极(电源内部电流由负极到正极),c、d分别为阳极和阴极;电解过程中Cu2+在阴极(d极)放电析出,d极质量增加,Cl-在阳极(c极)放电而消耗。
6.B
【解析】用惰性电极电解NaCl水溶液时,阴极是H2O电解出H+放电产生H2,从而阴极随之产生了大量的OH-,加酚酞,阴极呈红色,故A项、C项错;阳极是Cl-放电产生Cl2,因此,在阳极处加入KI溶液,会有I2产生,溶液呈棕色,故B项对;由于Cl2在水中的溶解度小,大部分逸出,因此,电解一段时间后,充分搅拌,溶液中仍有一定量的NaOH,溶液显碱性,故D项错。
7.C?
【解析】加入的离子两者之间可反应的有:Ag+与Cl-,Pb2+与SO42-,故溶液中剩余的离子为K+和NO3-,故用惰性电极电解时,是电解水,即,所以氧化产物与还原产物的质量比为8∶1。
8.C
【解析】C中阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,损失的是HCl,因此需要补充适量的HCl。
9.A
【解析】由a极板质量增加,知溶液中阳离子在a极板析出。则a为阴极,X为负极;B中a极板不析出金属,B错;C中X为正极,C错;又由b极板有无色、无臭气体放出,D错。
10.D
【解析】本题考查了电化学基础知识。由a极内圈为白色,外圈呈现浅红色说明a极生成的氯气与水反应生成具有漂白性的HClO,则a极为阳极,与电源的正极相连,b极为阴极,发生还原反应,消耗氢离子,所以pH变大。在此反应中水为氧化剂。
11.C
【解析】根据图中所给的信息,我们可以判断出左边是氢氧燃料电池,右边是电解池,所以A项错;根据入口中所标的氧气和氢气的位置,可以知道a作正极,b作负极;并且Zn和b相连,所以是阴极,而Cu是阳极,故B项错误;Cu片上的电极反应式为:Cu-2e-=Cu2+,当铜片的质量变化为12.8 g时,电路中转移电子的物质的量为:。a极上的电极反应式为:O2+4e-+2H2O=4OH-,因为各个电极转移电子的物质的量相等,所以a极上消耗V (O2)=22.4 L·mol-1×n (O2)=22.4 L·mol-1× =2.24 L,故C项正确;装置中电子的流向为:b→Zn→CuSO4溶液→Cu→a,所以D项错误。
12.AD 【解析】根据题目要求:阳极选择惰性电极、溶液中有不活泼金属的阳离子,电解实质是放氧生酸。
13.D
二、非选择题
1.(1)HCl、CuCl2 (2)Na2SO4、H2SO4 (3)NaCl、BaCl2、CuSO4
【解析】(1)以碳棒为电极,使电解质的质量减少,水量不变,则采用的电解质是无氧酸、不活泼金属的无氧酸盐。
(2)以碳棒为电极,使电解质的质量不变,水量减少,进行电解,则采用的电解质是含氧酸、活泼金属的含氧酸盐。
(3)以铂为电极,使电解质和水量都减少,进行电解,则采用的电解质是活泼金属的无氧酸盐、不活泼金属的含氧酸盐。
2.(1)Fe-2e-=Fe2+ 2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)H+不断放电,Cr2O72-与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中c (OH-)>c (H+)
(4)不能 用石墨作电极,阳极产生Cl2或O2,得不到Fe2+,缺少还原剂,不能使Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀而除去
3.(1)① 弱 氧和硫元素处于同主族,从上到下,原子半径逐渐增大,得电子能力减弱。
② 减小 P2 > P1 当温度一定时,增大压强3H2(g) + SO2 (g) H2S(g) + 2H2O(g)平衡正向移动,SO2的转化率增大。
(2)富集H2S(获得高浓度H2S)
(3)2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-2a kJ/mol
(4)Na2SO3+SO2+H2O=2NaHSO3
(5)阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3。阴极2H+-2e-=H2↑,导致HSO3- H++ SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3。
【解析】(1)①氧和硫元素处于同主族,从上到下,原子半径逐渐增大,得电子能力减弱,非金属性减弱,所以稳定性:H2O>H2S;
②3H2 (g)+SO2 (g)H2S (g)+2H2O (g),二氧化硫为反应物,图示压强一定,随温度升高,二氧化硫的平衡转率减小,所以化学平衡常数K的变化趋势是减小,当温度一定时,增大压强3H2 (g)+SO2 (g)H2S (g)+2H2O (g)平衡正向移动,SO2的转化率增大,从图示可知,同温度下,P2的SO2的转化率增大,所以P2>P1;
(2)生成的硫化氢气体中含有水蒸气,二乙醇胺能吸收H2S,不吸收水蒸气,然后在再生塔中加热分解重新获得H2S,主要目的是富集H2S(获得高浓度H2S);
(3)1 mol H2S气体完全燃烧生成固态硫磺及气态水,释放a kJ能量,2 mol H2S气体完全燃烧生成固态硫碘及气态水,释放2a kJ能量,放热,ΔH<0,所以其热化学方程式为2H2S (g)+O2 (g)=2S (s)+2H2O (g) ΔH=-2a kJ/mol;
(4)Na2SO3水溶液吸收SO2生成NaHSO3,反应为Na2SO3+SO2+H2O=2NaHSO3;
(5)通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3。阴极2H+-2e-=H2↑,导致HSO3-H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用。
【学习目标】
1、了解电解池的工作原理;
2、初步掌握一般电解反应产物的判断方法。
【典型例题】
类型一、电化学中电极及电极反应的判断
例1 蓄电池在放电时起原电池的作用,在充电时起电解池的作用。下面是爱迪生蓄电池分别在充电和放电时发生的反应: 下列有关爱迪生蓄电池的推断错误的是: A.放电时,Fe是负极,NiO2是正极 B.蓄电池的电极可以浸入某中酸性电解质溶液中 C.充电时,阴极上的电极反应为:Fe(OH)2+2e-=Fe+2OH- D.放电时,电解质溶液中的阴离子向正极方向移动 【答案】B、D。
【解析】蓄电池放电时起原电池作用,原电池的负极是较活泼的金属,A正确。放电时,Fe是原电池的负极,Fe失电子被氧化成Fe2+离子。由于负极——Fe的附近聚集较多的Fe2+离子,电解质溶液中的阴离子向负极移动,D不正确。充电时蓄电池起电解池作用,充电时电源的负极应与蓄电池的负极(Fe,此时作为电解池的阴极)相连接,发生还原反应:Fe(OH)2+2e-=Fe+2OH-。C正确。该蓄电池的放电和充电时的电极反应分别是: 放电:负极 ??Fe-2e-+ 2OH-=Fe(OH)2 正极 NiO2+2e-+2H2O=Ni(OH)2+2OH- 充电:阴极 ?Fe(OH)2+2e-=Fe+2OH- 阳极 Ni(OH)2-2e-+2OH-=NiO2+2H2O 可见反应是在碱性溶液中进行的,B不正确。
举一反三:
【变式1】右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )?
A.逸出气体的体积:a电极的小于b电极的
B.电极逸出无味气体,另一电极逸出刺激性气味气体
C.a电极附近呈红色,b电极附近呈蓝色
D.a电极附近呈蓝色,b电极附近呈红色
【答案】D
【解析】Na2SO4=2Na++SO42-,H2OH++OH-,SO42-和OH-移向b电极,Na+和H+移向a电极,在b电极 上:4OH--4e-?= 2H2O+O2↑,在a电极上:4H++4e-?= 2H2↑,所以a电极产生的气体体积大于b电极;两种气体均为无色无味的气体;由于a电极上H+放电,所以a电极附近的c(OH-)>c(H+),滴加石蕊试液a电极附近变蓝色,同理,b电极附近变红色。
例2镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型,NiMH中的M表示金属或合金,该电池在充电过程中的总反应方程式是:Ni(OH)2+M=NiOOH+MH
已知:6NiOOH+NH3+H2O+OH﹣=6 Ni(OH)2+NO2﹣
下列说法正确的是( )
A.NiMH电池放电过程中,正极的电极反应式为:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣
B.充电过程中OH﹣离子从阳极向阴极迁移
C.充电过程中阴极的电极反应式:H2O+M+e﹣=MH+OH﹣,H2O中的H被M还原
D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液
【思路点拨】做对本题的关键是根据充电过程的总反应方程式能正确书写充电、放电时的电极反应式。
【答案】A
【解析】镍氢电池中主要为KOH作电解液。
充电时,阳极反应:Ni(OH)2+OH﹣=NiOOH+H2O+e﹣、阴极反应:M+H2O+e﹣=MH+OH﹣,总反应:M+Ni(OH)2=MH+NiOOH;
放电时,正极:NiOOH+H2O+e﹣=Ni(OH)2+OH﹣,负极:MH+OH﹣=M+H2O+e﹣,总反应:MH+NiOOH=M+Ni(OH)2
以上式中M为储氢合金,MH为吸附了氢原子的储氢合金。
A.正极的电极反应式为:NiOOH+H2O+e﹣═Ni(OH)2+OH﹣,故A正确;
B.电解时阴离子向阳极移动,阳离子向阴极移动,所以OH﹣离子从阴极向阳极迁移,故B错误;
C.H2O中的H得电子,不是被M还原,故C错误;
D.不能用氨水做电解质溶液,根据已知有氨气时容易发生副反应生成亚硝酸根,故D错误;
故选A。 【总结升华】书写电极反应式的3个原则:
(1)共存原则
因为物质得失电子后在不同介质中的存在形式不同,所以电极反应式的书写必须考虑介质环境。当电解质溶液呈酸性时,不可能有OH-参加反应;碱性溶液中CO2不可能存在,也不可能有H+参加反应。
(2)得氧失氧原则
得氧时,在反应物中加H2O(电解质为酸性时)或OH-(电解质溶液为碱性或中性时);失氧时,在反应物中加H2O(电解质为碱性或中性时)或H+(电解质为酸性时)。
(3)中性吸氧反应成碱原则
在中性电解质溶液中,通过金属吸氧所建立起来的原电池反应,其反应的最后产物是碱。
举一反三:
【变式1】如下图装置,A、B中电极为多孔的惰性电极;C、D为夹在湿的Na2SO4滤纸条上的铂夹;电源有a、b两极。
若在A、B中充满KOH溶液后倒立于KOH溶液的水槽中。切断K1,闭合K2、K3通直流电,则:
(1)标出电源的正、负极,a为______极,b为_____极。
(2)在湿的Na2SO4滤纸条中心的KMnO4液滴,有什么现象__________。
(3)写出电极反应式:A中____________,B中__________。
(4)若电解一段时间,A、B中均有气体包围电极。此时切断K2、K3,闭合K1,则电流表的指针是否移动(填是或否)_________。
(5)若电流表指针不移动说明理由,若指针移动也说明理由___________。
【答案】(1)a为负极,b为正极
(2)紫色液滴向D处移动
(3)A中:4OH——4e-=2H2O+O2( B中:2H++2e-=H2(
(4)是
(5)H2、O2、KOH在A、B两极可以形成原电池
类型二、电解原理
例3(2019 新课标I)高锰酸钾(KMnO4)是一种常用氧化剂,主要用于化工、防腐及制药工业等。以软锰矿(主要成分为MnO2)为原料生产高锰酸钾的工艺路线如下:
回答下列问题:
(1)原料软锰矿与氢氧化钾按1∶1的比例在“烘炒锅”中混配,混配前应将软锰矿粉碎,其作用是________。
(2)“平炉”中发生反应的化学方程式为________。
(3)“平炉”中需要加压,其目的是________。
(4)将K2MnO4转化为KMnO4的生产有两种工艺。
①“CO2歧化法”是传统工艺,即在K2MnO4溶液中通入CO2气体,使体系呈中性或弱酸性,K2MnO4发生歧化反应。反应中生成KMnO4、MnO2和________(写化学式)。
②“电解法”为现代工艺,即电解K2MnO4水溶液。电解槽中阳极发生的电极反应为________,阴极逸出的气体是________。
③“电解法”和“CO2歧化法”中,K2MnO4的理论利用率之比为________。
(5)高锰酸钾纯度的测定:称取1.0800 g样品,溶解后定容于100 mL容量瓶中,摇匀。取浓度为0.2000 mol·L-1的H2C2O4标准溶液20.00 mL,加入稀硫酸酸化,用KMnO4溶液平行滴定三次,平均消耗的体积为24.48 mL。该样品的纯度为________(列出计算式即可,已知2MnO4-+5H2C2O4+6H+==2Mn2++10CO2↑+8H2O)。
【思路点拨】本题结合化学工艺流程考查氧化还原反应、电解原理、滴定的相关计算等。工艺路线比较简单,难度不大,做计算的时候要格外小心。
【答案】(1)增大反应物接触面积,加快反应速率,提高原料利用率
(2)2MnO2+O2+4KOH2K2MnO4+2H2O
(3)提高氧气的压强,加快反应速率,增加软锰矿转化率
(4)①KHCO3 ②MnO42--e-==MnO4- H2 ③3∶2
(5)
【解析】(1)将软锰矿粉碎可以增大反应物间的接触面积,加快反应速率,提高原料利用率。(2)从平炉中出来的物质经水浸、沉降析出K2MnO4,说明平炉中的MnO2被富氧空气氧化为K2MnO4,根据氧化还原反应规律和电子得失守恒完成反应的化学方程式为2MnO2+O2+4KOH2K2MnO4+2H2O。(3)平炉加压,可以增大富氧空气的浓度,加快反应速率,提高MnO2的转化率。(4)①该反应为歧化反应,变价元素只有Mn,根据电子守恒可知生成的KMnO4与MnO2的物质的量之比为2∶1,配平反应方程式得3K2MnO4+4CO2+2H2O=2KMnO4+MnO2+4KHCO3,故另一产物为KHCO3。②电解时阳极发生氧化反应,即MnO42-转化为MnO4-;MnO42--e-==MnO4-,放电顺序:H+>K+,故阴极H+放电生成H2。③由以上分析可知,“CO2歧化法”中,K2MnO4只有2/3转化为KMnO4,而“电解法”中K2MnO4的转化率为100%;,故理论上两种方法K2MnO4的利用率之比为2∶3。(5)根据题给反应的离子方程式可知:2KMnO4~5H2C2O4,则样品的纯度为。
【总结升华】电解池与原电池最根本的区别是有无外加电源,有外加电源的装置是电解池。电解池中两极名称为阴、阳极,阴极发生还原反应,阳极发生氧化反应;而原电池中的两极名称为正、负极,一般不称为阴、阳极。
举一反三:
【变式1】(2019 四川高考)用右图所示装置除去含CN-、Cl-废水中的CN-时,控制溶液pH为9~10,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是( )
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
【答案】D
【解析】A、阳极要产生ClO-,则铁只能作阴极,不能作阳极,否则就是铁失电子,A正确;B、阳极是Cl-失电子产生ClO-,电极反应式为:Cl- + 2OH--2e-= ClO- + H2O,B正确;C、阴极是H+产生H2,碱性溶液,故阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-,C正确;D、溶液为碱性,方程式应为2CN-+5ClO-+ H2O =N2↑+2CO2↑+5Cl-+2OH-。故选D。
【变式2】下图中能验证氯化钠溶液电解产物的装置是
【答案】D
【变式3】如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下列叙述中正确的是
电极材料
通电后的变化
阳极
阴极
A
石墨
石墨
阴极质量增加,溶液的pH 增大
B
铜
铜
阳极质量减小,阴极质量增加
C
铁
铁
两极的质量不发生变化
D
铂
铁
阴极质量增加,溶液的pH 不变
【答案】B
【巩固练习】
一、选择题
1.用惰性电极电解下列溶液,电解一段时间后,阴极质量增加,电解液的pH下降的是( )。 ①CuSO4 ②BaCl2 ③AgNO3 ④H2SO4
A.①② B.①③
C.①④ D.②④
2.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )。
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
3.下图所示的电解池I和II中,a、b、c和d均为Pt电极。电解过程中,电极b和d上没有气体逸出,但质量均增大,且增重b
X
Y
A
MgSO4
CuSO4
B
AgNO3
Pb(NO3)2
C
FeSO4
Al2?(SO4)3
D
CuSO4
AgNO3
4.(2019 江西遂川县模拟)关于如图电解池工作时的相关叙述正确的是(???)。
A.Fe电极作阳极,发生氧化反应
B.Cl-向石墨极作定向运动
?C.石墨电极反应:Fe3++3e-=Fe3+
D. 电解池发生总反应:2Cl-+2Fe3+ Cl2↑+2Fe2+
5.如图所示是电解CuCl2溶液装置,其中c、d为石墨电极,已知溶液中Cl-向c极移动,则下列有关判断正确的是( )。
A.a为负极,b为正极
B.c为阳极,d为阴极
C.电解过程中,d极质量减小
D.电解过程中,Cl-浓度不变
6.关于电解NaCl水溶液,下列叙述正确的是( )。
A.电解时在阳极得到氯气,在阴极得到金属钠
B.若在阳极附近的溶液中滴入KI溶液,溶液呈棕色
C.若在阴极附近的溶液中滴入酚酞试液,溶液呈无色
D.电解一段时间后,将全部电解液转移到烧杯中,充分搅拌后溶液呈中性
7.在水中加入等物质的量Ag+,Pb2+,K+,SO42-,Cl-,NO3-,再用惰性电极电解片刻,则氧化产物和还原产物的质量之比为( )。
A.35.5∶108 B.16∶207
C.8∶1 D.35.5∶1
8.用惰性电极电解下列溶液,一段时间后,再加入一定质量的另一种物质(中括号内),溶液能与原来溶液完全一样的是( )。
A.CuCl2 [CuO] B.NaOH [NaOH] C.NaCl [HCl] D.Na2SO4 [NaOH]
9.如图所示,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出。符合这一情况的是下表中的( )。
a极板
b极板
X电极
Z溶液
A
锌
石墨
负极
CuSO4
B
石墨
石墨
负极
NaOH
C
银
铁
正极
AgNO3
D
铜
石墨
负极
CuCl2
10.取一张用饱和NaCl溶液浸湿的pH试纸,两根铅笔芯作电极,接通直流电源,一段时间后,发现a电极与试纸接触处出现一个双色同心圆,内圈为白色,外圈为浅红色。则下列说法错误的是( )。
A.b电极是阴极
B.a电极与电源的正极相连接
C.电解过程中,水是氧化剂
D.b电极附近溶液的pH变小
11.关于右图所示装置的判断,叙述正确的是( )。
A.左边的装置是电解池,右边的装置是原电池
B.该装置中铜为正极,锌为负极
C.当铜片的质量变化为12.8 g时,a极上消耗的O2在标准状况下的体积为2.24 L
D.装置中电子的流向是:a→Cu→经过CuSO4溶液→Zn→b
12.某电解池内盛有Cu(NO3)2溶液,插入两根电极,接通直流电源后,欲达到如下要求:(1)阳极质量不变;(2)阴极质量增加;(3)电解液pH减小,则应选用的电极是( ) A.阴阳两极都用石墨 B.铜作阳极铁作阴极 C.铁作阳极铜作阴极 D.铂作阳极铜作阴极 13.常温时,将500 mL pH=5的CuSO4?溶液用石墨电极电解一段时间,测得溶液的pH变为2,若使溶液的浓度、pH与电解前相同,可采用的方法( )。? A.向溶液中加入0.245g Cu(OH)2? B.向溶液中加0.31g CuSO4 C.向溶液中加0.0025 mol H2SO4并加热 D.向溶液中加0.2g CuO
二、非选择题
1.从H+、Cu2+、Ba2+、Na+、Cl-、SO42- 6种离子中两两恰当地组成电解质,按下列要求进行电解,请填空:
(1)以碳棒为电极,使电解质的质量减少,水量不变,进行电解,则采用的电解质是________。
(2)以碳棒为电极,使电解质的质量不变,水量减少,进行电解,则采用的电解质是________。
(3)以铂为电极,使电解质和水量都减少,进行电解,则采用的电解质是________。
2.工业上为了处理含有Cr2O72-的酸性工业废水,采用下面的处理方法:往工业废水中加入适量NaCl,以Fe为电极进行电解,经过一段时间,有Cr(OH)3和Fe(OH)3沉淀生成,工业废水中铬的含量已低于排放标准。请回答下列问题:
(1)两极发生反应的电极反应式 阳极:________;阴极:________。
(2)写出Cr2O72-变为Cr3+的离子方程式:________。
(3)工业废水由酸性变为碱性的原因是________。
(4)________(填“能”或“不能”)改用石墨作电极,原因是________。
3.(2019 北京丰台二模)低浓度SO2废气的处理是工业难题,目前常用的两种方法如下:
方法Ⅰ:
(1)反应器中发生反应:3H2(g) + SO2 (g) H2S(g) + 2H2O(g)
①H2S的稳定性比H2O (填“强”或“弱”),
原因是 ,元素的非金属性减弱。
②SO2的平衡转化率随温度(T)、压强(P)的变化如右图所示,
随温度升高,化学平衡常数K的变化趋势是 。
比较P1和P2的大小关系 ,请简述理由 。
(2)工业上先用二乙醇胺吸收H2S,然后在再生塔中加热分解重新获得H2S,主要目的是 。
(3)燃烧室内,1mol H2S气体完全燃烧生成固态硫磺及气态水,释放a kJ能量,其热化学方程式为 。
方法Ⅱ:
(4)Na2SO3溶液吸收SO2的化学方程式是 。
(5)通过电解法可分离NaHSO3与Na2SO3混合物,实现Na2SO3的循环利用,示意图如下:
简述分离NaHSO3与Na2SO3混合物的原理 。
【答案与解析】
一、选择题
1.B
【解析】阴极质量增加,说明溶液中含有不活泼金属的阳离子;电解液的pH下降,说明在阳极上是OH-离子放电,而金属离子相应的阴离子应是含氧酸的酸根,故本题的答案应为不活泼金属的含氧酸盐,选B。
2.A
【解析】由a极板质量增加,知溶液中阳离子在a极板析出。则a为阴极,X为负极;B中a极板不析出金属,B错;C中X为正极,C错;又由b极板有无色、无臭气体放出,D错。
3.D
【解析】电解过程中,Pt电极为惰性电极,电极b和d均为阴极,电极上没有气体逸出,但质量均增大,说明金属阳离子放电析出,要使增重b
5.B
【解析】电解质溶液中Cl-向c极移动,说明电解质溶液中电流的方向由c指向d,则电源内部电流方向由b指向a,因此b为电源负极,a为电源正极(电源内部电流由负极到正极),c、d分别为阳极和阴极;电解过程中Cu2+在阴极(d极)放电析出,d极质量增加,Cl-在阳极(c极)放电而消耗。
6.B
【解析】用惰性电极电解NaCl水溶液时,阴极是H2O电解出H+放电产生H2,从而阴极随之产生了大量的OH-,加酚酞,阴极呈红色,故A项、C项错;阳极是Cl-放电产生Cl2,因此,在阳极处加入KI溶液,会有I2产生,溶液呈棕色,故B项对;由于Cl2在水中的溶解度小,大部分逸出,因此,电解一段时间后,充分搅拌,溶液中仍有一定量的NaOH,溶液显碱性,故D项错。
7.C?
【解析】加入的离子两者之间可反应的有:Ag+与Cl-,Pb2+与SO42-,故溶液中剩余的离子为K+和NO3-,故用惰性电极电解时,是电解水,即,所以氧化产物与还原产物的质量比为8∶1。
8.C
【解析】C中阳极:2Cl--2e-=Cl2↑,阴极:2H++2e-=H2↑,损失的是HCl,因此需要补充适量的HCl。
9.A
【解析】由a极板质量增加,知溶液中阳离子在a极板析出。则a为阴极,X为负极;B中a极板不析出金属,B错;C中X为正极,C错;又由b极板有无色、无臭气体放出,D错。
10.D
【解析】本题考查了电化学基础知识。由a极内圈为白色,外圈呈现浅红色说明a极生成的氯气与水反应生成具有漂白性的HClO,则a极为阳极,与电源的正极相连,b极为阴极,发生还原反应,消耗氢离子,所以pH变大。在此反应中水为氧化剂。
11.C
【解析】根据图中所给的信息,我们可以判断出左边是氢氧燃料电池,右边是电解池,所以A项错;根据入口中所标的氧气和氢气的位置,可以知道a作正极,b作负极;并且Zn和b相连,所以是阴极,而Cu是阳极,故B项错误;Cu片上的电极反应式为:Cu-2e-=Cu2+,当铜片的质量变化为12.8 g时,电路中转移电子的物质的量为:。a极上的电极反应式为:O2+4e-+2H2O=4OH-,因为各个电极转移电子的物质的量相等,所以a极上消耗V (O2)=22.4 L·mol-1×n (O2)=22.4 L·mol-1× =2.24 L,故C项正确;装置中电子的流向为:b→Zn→CuSO4溶液→Cu→a,所以D项错误。
12.AD 【解析】根据题目要求:阳极选择惰性电极、溶液中有不活泼金属的阳离子,电解实质是放氧生酸。
13.D
二、非选择题
1.(1)HCl、CuCl2 (2)Na2SO4、H2SO4 (3)NaCl、BaCl2、CuSO4
【解析】(1)以碳棒为电极,使电解质的质量减少,水量不变,则采用的电解质是无氧酸、不活泼金属的无氧酸盐。
(2)以碳棒为电极,使电解质的质量不变,水量减少,进行电解,则采用的电解质是含氧酸、活泼金属的含氧酸盐。
(3)以铂为电极,使电解质和水量都减少,进行电解,则采用的电解质是活泼金属的无氧酸盐、不活泼金属的含氧酸盐。
2.(1)Fe-2e-=Fe2+ 2H++2e-=H2↑
(2)Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O
(3)H+不断放电,Cr2O72-与Fe2+反应中消耗H+,打破了水的电离平衡,使溶液中c (OH-)>c (H+)
(4)不能 用石墨作电极,阳极产生Cl2或O2,得不到Fe2+,缺少还原剂,不能使Cr2O72-转化为Cr3+,再转化为Cr(OH)3沉淀而除去
3.(1)① 弱 氧和硫元素处于同主族,从上到下,原子半径逐渐增大,得电子能力减弱。
② 减小 P2 > P1 当温度一定时,增大压强3H2(g) + SO2 (g) H2S(g) + 2H2O(g)平衡正向移动,SO2的转化率增大。
(2)富集H2S(获得高浓度H2S)
(3)2H2S(g)+O2(g)=2S(s)+2H2O(g) △H=-2a kJ/mol
(4)Na2SO3+SO2+H2O=2NaHSO3
(5)阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离子交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3。阴极2H+-2e-=H2↑,导致HSO3- H++ SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3。
【解析】(1)①氧和硫元素处于同主族,从上到下,原子半径逐渐增大,得电子能力减弱,非金属性减弱,所以稳定性:H2O>H2S;
②3H2 (g)+SO2 (g)H2S (g)+2H2O (g),二氧化硫为反应物,图示压强一定,随温度升高,二氧化硫的平衡转率减小,所以化学平衡常数K的变化趋势是减小,当温度一定时,增大压强3H2 (g)+SO2 (g)H2S (g)+2H2O (g)平衡正向移动,SO2的转化率增大,从图示可知,同温度下,P2的SO2的转化率增大,所以P2>P1;
(2)生成的硫化氢气体中含有水蒸气,二乙醇胺能吸收H2S,不吸收水蒸气,然后在再生塔中加热分解重新获得H2S,主要目的是富集H2S(获得高浓度H2S);
(3)1 mol H2S气体完全燃烧生成固态硫磺及气态水,释放a kJ能量,2 mol H2S气体完全燃烧生成固态硫碘及气态水,释放2a kJ能量,放热,ΔH<0,所以其热化学方程式为2H2S (g)+O2 (g)=2S (s)+2H2O (g) ΔH=-2a kJ/mol;
(4)Na2SO3水溶液吸收SO2生成NaHSO3,反应为Na2SO3+SO2+H2O=2NaHSO3;
(5)通过电解法可分离NaHSO3与Na2SO3混合物,阳极2H2O-4e-=4H++O2↑,c(H+)增大,H+由a室经阳离交换膜进入b室,H+与SO32-结合生成HSO3-,Na2SO3转化为NaHSO3。阴极2H+-2e-=H2↑,导致HSO3-H++SO32-正向移动,Na+从b室进入c室,NaHSO3转化为Na2SO3,实现Na2SO3的循环利用。
