(人教版)高一化学必修2第二章 第一节化学能与热能课件(共14张PPT)
文档属性
| 名称 | (人教版)高一化学必修2第二章 第一节化学能与热能课件(共14张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 513.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-22 11:04:43 | ||
图片预览





文档简介
(共14张PPT)
第二章 化学反应与能量
第一节 化学能与热能
人教版高中化学必修2
知识回顾
2、化学反应的本质:
旧化学键的断裂和新化学键的形成
1、化学键的分类?
离子键
化学键
非极性键
共价键
极性键
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:化学反应中能量变化的主要原因:
化学键的断裂和形成
一 、化学键与化学反应中能量变化的关系
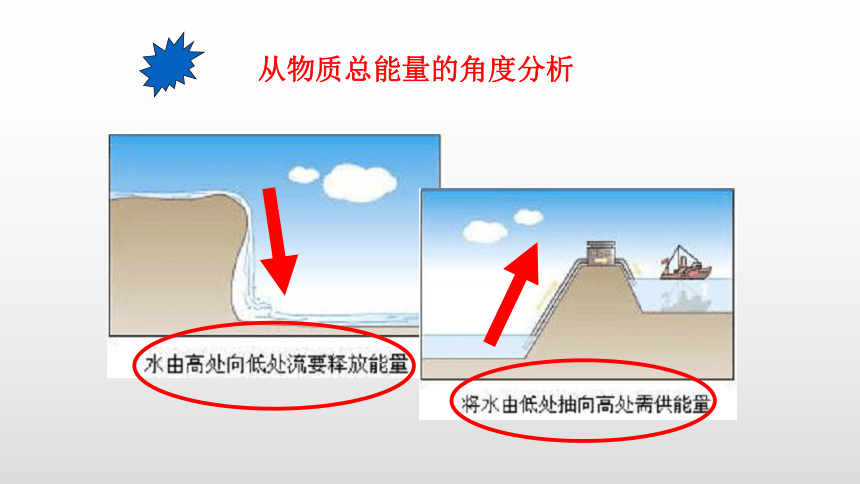
从物质总能量的角度分析
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
决定于反应物的总能量与生成物的总能量的相对大小。
化学反应
化学反应
吸收能量
一个化学反应吸收
能量还是放出能量
放热
吸热
从整体考虑的角度出发
课堂训练
下列对化学反应的认识错误的是( )
A、会引起化学键的变化
B、会产生新的物质
C、必然引起物质状态的变化
D、必然伴随着能量的变化
C
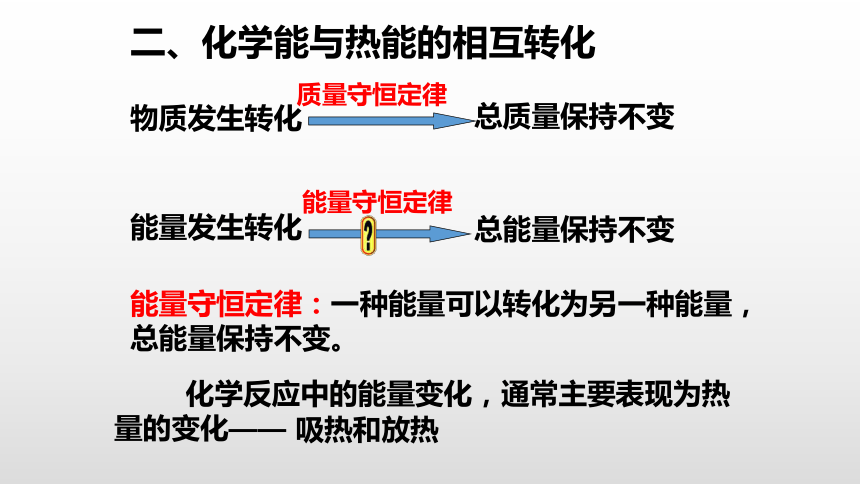
二、化学能与热能的相互转化
物质发生转化
总质量保持不变
质量守恒定律
能量发生转化
总能量保持不变
能量守恒定律:一种能量可以转化为另一种能量,总能量保持不变。
能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化——
吸热和放热
实验探究1
现 象 结 论
1.??有气泡放出;
2. 温度计的液柱升高,由?? ℃到?? ?? ℃;
3. 手触摸的感觉是?? ?? ??。 1. 大多数置换反应是 ;
2.???? ? 能转为??? ? 能释放出来。
变热
放热反应
化学
热
(实验2-1:)铝与盐酸反应
实验探究2
现象 结论
1. 产生?? 气味气体,混合物呈?? 状;
2. 手触摸杯壁下部感觉?? ;
3. 玻璃片与烧杯?????? ? 。 1. 反应产生????? ,并有???? ? 生成;
2. 该反应是???? 反应;
3.???? 能转为??? ?? 储存起来;
刺激性
糊
温度降低
粘在一起
氨气
水
吸热
热
化学能
(实验2-2:) Ba(OH)2·8H2O晶体与NH4Cl晶体反应
反应方程式:
Ba(OH)2·8H2O+ 2NH4Cl=BaCl2 +2NH3↑+10H2O
实验探究3
盐酸
温度 NaOH
溶液温度 反应后
温度 结 论
室温? 室温? ? 该反应是 反应,酸碱中和反应是 反应
升高
放热
放热
(实验2-3:) 酸碱中和反应
结论
w.w.w.k.s.5.u.c.o.m
1、金属与酸反应是 反应,酸碱中和反应是 反应,Ba(OH)2·8H2O晶体与NH4Cl晶体反应是 反应。
2、中和热的定义:酸与碱发生中和反应生成 水时所释放的热量。
3、化学反应伴随着能量变化是化学反应的基本特征之一。
吸热
放热
放热
w.w.w.k.s.5.u.c.o.m
4、反应刚开始需要加热,之后就无需加热的反应是放热反应,需要持续加热才反应,不加热反应就停止的反应是吸热反应!
5、有化学键的断裂或形成的过程不一定是化学变化,如HCl的溶解等!
常见的放热反应和吸热反应
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2·8H2O+NH4Cl
大部分分解反应,如CaCO3高温分解
放热反应
燃料的燃烧
中和反应
金属与酸或水的反应
物质氧化
部分化合反应
规律总结
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
第二章 化学反应与能量
第一节 化学能与热能
人教版高中化学必修2
知识回顾
2、化学反应的本质:
旧化学键的断裂和新化学键的形成
1、化学键的分类?
离子键
化学键
非极性键
共价键
极性键
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:化学反应中能量变化的主要原因:
化学键的断裂和形成
一 、化学键与化学反应中能量变化的关系
从物质总能量的角度分析
反应物的总能量高
生成物的总能量低
放出能量
生成物的总能量高
反应物的总能量低
决定于反应物的总能量与生成物的总能量的相对大小。
化学反应
化学反应
吸收能量
一个化学反应吸收
能量还是放出能量
放热
吸热
从整体考虑的角度出发
课堂训练
下列对化学反应的认识错误的是( )
A、会引起化学键的变化
B、会产生新的物质
C、必然引起物质状态的变化
D、必然伴随着能量的变化
C
二、化学能与热能的相互转化
物质发生转化
总质量保持不变
质量守恒定律
能量发生转化
总能量保持不变
能量守恒定律:一种能量可以转化为另一种能量,总能量保持不变。
能量守恒定律
化学反应中的能量变化,通常主要表现为热量的变化——
吸热和放热
实验探究1
现 象 结 论
1.??有气泡放出;
2. 温度计的液柱升高,由?? ℃到?? ?? ℃;
3. 手触摸的感觉是?? ?? ??。 1. 大多数置换反应是 ;
2.???? ? 能转为??? ? 能释放出来。
变热
放热反应
化学
热
(实验2-1:)铝与盐酸反应
实验探究2
现象 结论
1. 产生?? 气味气体,混合物呈?? 状;
2. 手触摸杯壁下部感觉?? ;
3. 玻璃片与烧杯?????? ? 。 1. 反应产生????? ,并有???? ? 生成;
2. 该反应是???? 反应;
3.???? 能转为??? ?? 储存起来;
刺激性
糊
温度降低
粘在一起
氨气
水
吸热
热
化学能
(实验2-2:) Ba(OH)2·8H2O晶体与NH4Cl晶体反应
反应方程式:
Ba(OH)2·8H2O+ 2NH4Cl=BaCl2 +2NH3↑+10H2O
实验探究3
盐酸
温度 NaOH
溶液温度 反应后
温度 结 论
室温? 室温? ? 该反应是 反应,酸碱中和反应是 反应
升高
放热
放热
(实验2-3:) 酸碱中和反应
结论
w.w.w.k.s.5.u.c.o.m
1、金属与酸反应是 反应,酸碱中和反应是 反应,Ba(OH)2·8H2O晶体与NH4Cl晶体反应是 反应。
2、中和热的定义:酸与碱发生中和反应生成 水时所释放的热量。
3、化学反应伴随着能量变化是化学反应的基本特征之一。
吸热
放热
放热
w.w.w.k.s.5.u.c.o.m
4、反应刚开始需要加热,之后就无需加热的反应是放热反应,需要持续加热才反应,不加热反应就停止的反应是吸热反应!
5、有化学键的断裂或形成的过程不一定是化学变化,如HCl的溶解等!
常见的放热反应和吸热反应
吸热反应
C+CO2
H2+CuO
C+H2O
Ba(OH)2·8H2O+NH4Cl
大部分分解反应,如CaCO3高温分解
放热反应
燃料的燃烧
中和反应
金属与酸或水的反应
物质氧化
部分化合反应
规律总结
科学视野
1、社会发展与能源利用
2、人类利用能源的三个阶段
柴草时期
化石能源时期
多能源结构时期
