生物:测量不同植被环境的空气温度和湿度 精品教案(北师大版七年级)
文档属性
| 名称 | 生物:测量不同植被环境的空气温度和湿度 精品教案(北师大版七年级) |  | |
| 格式 | rar | ||
| 文件大小 | 20.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北师大版 | ||
| 科目 | 生物学 | ||
| 更新时间 | 2009-08-12 16:22:00 | ||
图片预览

文档简介
本资料来自于资源最齐全的21世纪教育网www.21cnjy.com
2009学年第一学期12月月考试题卷
学科:高一化学 满分:100分 考试时间90分钟 命题:张雅春 审核:丁冬英
第I卷(50分)
本卷可能用到的相对原子质量: H:1 He:4 C:12 N:14 O:16 Na:23
Mg:24 Al:27 Cl:35.5 Ca:40
一、选择题(每小题只有一个选项符合题意,每小题2分,共50分)[21世纪教育网]
1.从分类角度看,下列变化中有一种变化与其它三种变化有本质区别,这种变化是
A.水结成冰 B.石灰石煅烧成石灰
C.铁矿石冶炼变为生铁 D.用锌粒与盐酸反应放出氢气
2.“纳米材料”是粒子直径为l~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
3.如图在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡
后静置,出现下列现象,(阴影为有机层)正确的结论是
A.①加了CCl4 ②加了苯 ③加了酒精
B.①加了苯 ②加了CCl4 ③加了酒精
C.①加了酒精 ②加了CCl4 ③加了苯
D.①加了苯 ②加了酒精 ③加了CCl4
4.下列物质在给定状态下能导电的是
A.固体NaCl B.气态HCl C.液态乙醇 D.液态KOH
5. 等物质的量的氢气和氦气一定具有相同的
A.原子数 B.体积 C.电子数 D.质量
6.0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A.5:2 B. 3:1 C.15:2 D. 1:3
7.质子数和中子数相同的原子A,其阳离子An+核外共有X个 电子,则A的质量数为:
A.2(x+n) B.2(x-n) C.2x D.n+2
8.只用一种试剂可区别五种溶液, 这种试剂是
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
9.下图为反应Fe + CuSO4 = Cu + FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe ,S B.Cu,S
C.Fe,O D.Fe,Cu
10.用NA表示阿伏加德罗常数,则下列说法正确是( )
A.常温常压下,11.2L CH4中含有的氢原子数为2NA
B.11.2 L CO2与8.5 g NH3所含分子数相等
C.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+ 数为0.2NA
11.2005年3月,京沪高速公路淮安段一辆载有约35吨液氯的槽罐车与一辆货车相撞,导致槽罐车中液氯大面积泄漏,造成多人伤亡。下列处理方法和过程最合理的是
A.将人群转移到地势较低的地方,等待营救
B.在泄漏地点撒上石灰
C.用高压水枪向空中喷洒大量水 [来源:21世纪教育网]
D.被转移人群可戴上用NaOH处理过的口罩
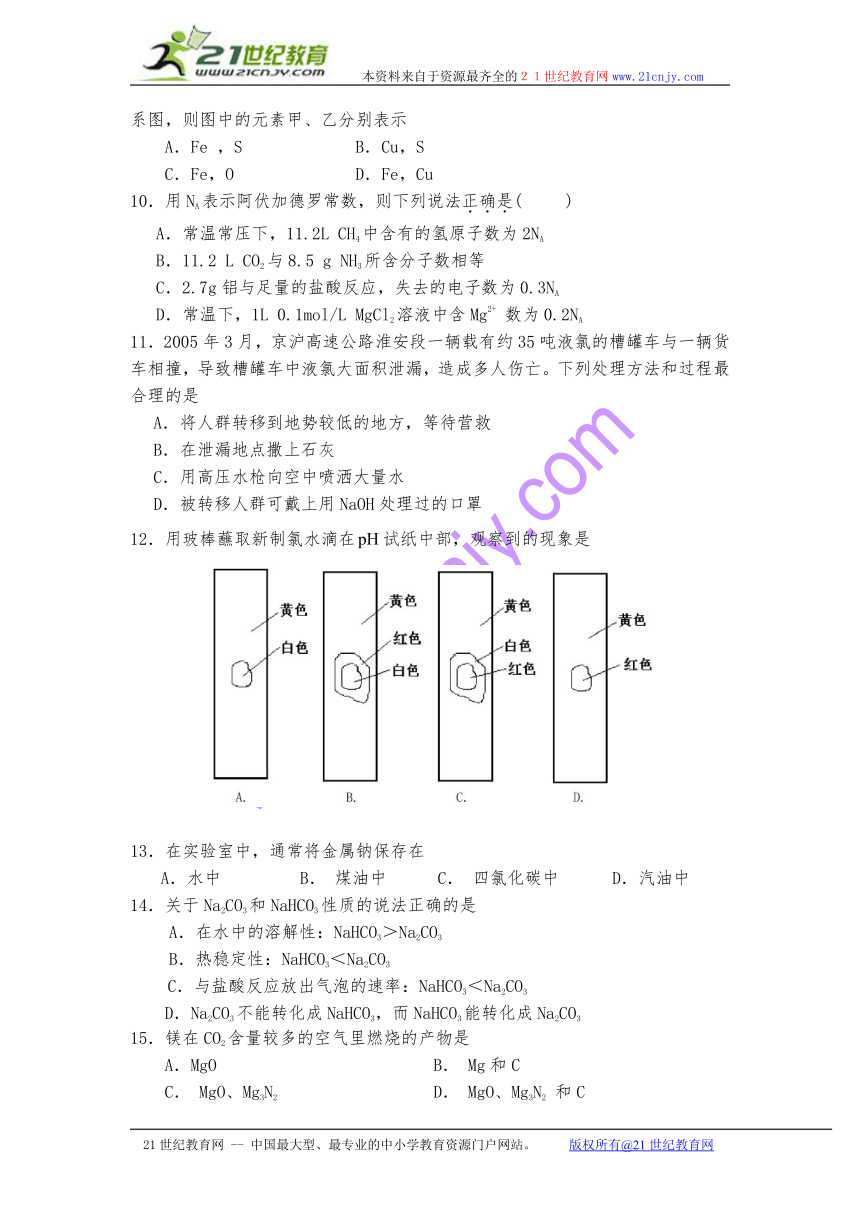
12.用玻棒蘸取新制氯水滴在试纸中部,观察到的现象是
13.在实验室中,通常将金属钠保存在[21世纪教育网]
A.水中 B. 煤油中 C. 四氯化碳中 D.汽油中
14.关于Na2CO3和NaHCO3性质的说法正确的是
A.在水中的溶解性:NaHCO3>Na2CO3
B.热稳定性:NaHCO3<Na2CO3
C.与盐酸反应放出气泡的速率:NaHCO3<Na2CO3
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
15.镁在CO2含量较多的空气里燃烧的产物是
A.MgO B. Mg和C
C. MgO、Mg3N2 D. MgO、Mg3N2 和C
16.现有三种常见治疗胃病药品的标签:
[来源:21世纪教育网]
这三种药品中所含的物质均能中和胃里过量的盐酸,按每片药片中和胃酸的量来衡量药效,则药效由大到小为
A.①>②>③ B. ①>③>②
C.③>②>① D. ②>③>①
17.下列关于金属铝的叙述中,说法不正确的是
A.Al是地壳中含量最多的金属元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 [来源:21世纪教育网]
C.在常温下,铝遇浓硫酸、浓硝酸时会发生钝化,且钝化是物理变化
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落[来源:21世纪教育网]
18.将铝投入到一定量的NaOH溶液中,充分反应后,有2mol的电子发生了转移。则参加反应的铝的物质的量为
A.1/3mol B.1mol C.2mol D.2/3mol
19.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
20.将氢氧化钠溶液逐滴加入含有盐酸的AlCl3溶液时, 图中曲线正确的是(x轴表示加入NaOH溶液的体积, y轴表示沉淀的量)
21.等质量的Na、Mg、Al分别跟足量的稀硫酸反应, 放出氢气由多到少的次序是 [来源:21世纪教育网]
A.Na>Mg>Al B.Al>Mg>Na C.Mg>Na>Al D.Al>Na>Mg
22.下列判断那些是正确的
①氢氧化钠是电解质
②强电解质溶液的导电性一定比弱电解质溶液导电性强
③氯化银难溶于水,所以氯化银是非电解质
④蔗糖易溶于水,所以是电解质
⑤氯气溶于水后导电,所以Cl2是电解质
A.① B.①③ C.①②⑤ D.①②③⑤
23.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
24.下列离子方程式书写正确的是
A.碳酸钡溶液中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.CuO与H2SO4混合:Cu2+ + SO42- = CuSO4 + H2O
C.NaHCO3溶液与盐酸反应:HCO3- + H+ = H2O + CO2↑
D.苛性钠溶液中加入稀醋酸:H+ + OH― = H2O
25.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
A.2W-+Z2=2Z-+W2 B.2X-+Z2=2Z-+X2
C.2W-+Y2=2Y-+W2 D.2Z-+X2=2X-+Z2
Ⅱ卷 (非选择题共50分)
二、填空题(共15分)
26.用下列仪器的编号回答问题(5分)
①容量瓶 ②蒸馏烧瓶 ③分液漏斗 ④量筒 ⑤烧杯 ⑥托盘天平
⑴加热时必须垫石棉网的有 ,
⑵使用时必须检查是否漏水的有 ,[来源:21世纪教育网]
⑶标有零刻度的有 。
27.(8分)在反应2Na + 2H2O = 2NaOH + H 2 ↑中用双线桥表示此反应电子转移的方向和数目。氧化剂是 ,氧化产物是 ,生成33.6LH2 (标准状况下)时转移电子数为 。
28.(2分)在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、
CO32-、OH- 6种离子。
①已知甲烧杯的溶液呈蓝色,则甲烧杯的溶液中大量存在的离子是
②乙烧杯的溶液中大量存在的离子是 。(填离子符号)
三、实验题(共17分)
29.(1)(4分)用下图所示装置做NaHCO3的分解实验,请回答下列问题:
Ⅰ.大试管内发生反应的化学方程式为:
Ⅱ.组装装置后主要实验操作有:①用酒精灯加热;②熄灭酒精灯;③检查装置的气密性;④在试管里加入NaHCO3固体;⑤将导气管撤离石灰水。
则正确的操作为 (填各步操作的序号)。
(2)(9分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示,并回答下列问题:
Ⅰ.写出在海水中加入氧化钙生成氢氧化镁的化学方程式 。
操作①主要是指 。
Ⅱ.试剂①可选用 ,该反应的离子方程式为 。[来源:21世纪教育网]
Ⅲ.操作②主要是指 。[来源:21世纪教育网]
Ⅳ.经操作③最终可得金属镁,该反应的化学方程式是 。
30.(4分)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答
⑴此实验中,观察到的现象有
① , ② 。
⑵写出实验过程中反应的离子方程式为 。
四、计算题(共18分)
31.(9分)称取无水Na2CO3和NaHCO3的混合物4.42g,加入40mL的盐酸恰好完全反应生成NaCl CO2 和H2O。将生成的CO2全部通入过量的澄清 石灰水中,得到5.0g白色沉淀。求
(1)原混合物中Na2CO3和NaHCO3的质量。
(2)所加入盐酸的物质的量浓度。[来源:21世纪教育网]
[来源:21世纪教育网]
32.(9分)为测定镁铝合金中各金属的含量,取一定量的镁铝合金完全溶于足量的6mol/L的盐酸,在标准状况下收集到4.48升H2,在所得溶液中加入过量的氢阳化钠溶液充分反应后过滤,生成的沉淀经洗涤干燥称重质量为2.9g。求
⑴收集到的氢气物质的量为多少?
⑵原合金中镁铝的质量分别为多少g?
甲 乙
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
2009学年第一学期12月月考试题卷
学科:高一化学 满分:100分 考试时间90分钟 命题:张雅春 审核:丁冬英
第I卷(50分)
本卷可能用到的相对原子质量: H:1 He:4 C:12 N:14 O:16 Na:23
Mg:24 Al:27 Cl:35.5 Ca:40
一、选择题(每小题只有一个选项符合题意,每小题2分,共50分)[21世纪教育网]
1.从分类角度看,下列变化中有一种变化与其它三种变化有本质区别,这种变化是
A.水结成冰 B.石灰石煅烧成石灰
C.铁矿石冶炼变为生铁 D.用锌粒与盐酸反应放出氢气
2.“纳米材料”是粒子直径为l~100 nm(纳米)的材料,纳米碳就是其中的一种。若将纳米碳均匀地分散到蒸馏水中,所形成的物质
①是溶液 ②是胶体 ③能产生丁达尔效应
④能透过滤纸 ⑤不能透过滤纸 ⑥静置后,会析出黑色沉淀
A.①④⑥ B.②③④ C.②③⑤ D.①③④⑥
3.如图在盛有溴水的三支试管中分别加入苯、四氯化碳和酒精,振荡
后静置,出现下列现象,(阴影为有机层)正确的结论是
A.①加了CCl4 ②加了苯 ③加了酒精
B.①加了苯 ②加了CCl4 ③加了酒精
C.①加了酒精 ②加了CCl4 ③加了苯
D.①加了苯 ②加了酒精 ③加了CCl4
4.下列物质在给定状态下能导电的是
A.固体NaCl B.气态HCl C.液态乙醇 D.液态KOH
5. 等物质的量的氢气和氦气一定具有相同的
A.原子数 B.体积 C.电子数 D.质量
6.0.5L 1mol/L FeCl3溶液与0.2L1mol/L KCl溶液中的Cl-的数目之比
A.5:2 B. 3:1 C.15:2 D. 1:3
7.质子数和中子数相同的原子A,其阳离子An+核外共有X个 电子,则A的质量数为:
A.2(x+n) B.2(x-n) C.2x D.n+2
8.只用一种试剂可区别五种溶液, 这种试剂是
A.Ba(OH)2 B.H2SO4 C.NaOH D.AgNO3
9.下图为反应Fe + CuSO4 = Cu + FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe ,S B.Cu,S
C.Fe,O D.Fe,Cu
10.用NA表示阿伏加德罗常数,则下列说法正确是( )
A.常温常压下,11.2L CH4中含有的氢原子数为2NA
B.11.2 L CO2与8.5 g NH3所含分子数相等
C.2.7g铝与足量的盐酸反应,失去的电子数为0.3NA
D.常温下,1L 0.1mol/L MgCl2溶液中含Mg2+ 数为0.2NA
11.2005年3月,京沪高速公路淮安段一辆载有约35吨液氯的槽罐车与一辆货车相撞,导致槽罐车中液氯大面积泄漏,造成多人伤亡。下列处理方法和过程最合理的是
A.将人群转移到地势较低的地方,等待营救
B.在泄漏地点撒上石灰
C.用高压水枪向空中喷洒大量水 [来源:21世纪教育网]
D.被转移人群可戴上用NaOH处理过的口罩
12.用玻棒蘸取新制氯水滴在试纸中部,观察到的现象是
13.在实验室中,通常将金属钠保存在[21世纪教育网]
A.水中 B. 煤油中 C. 四氯化碳中 D.汽油中
14.关于Na2CO3和NaHCO3性质的说法正确的是
A.在水中的溶解性:NaHCO3>Na2CO3
B.热稳定性:NaHCO3<Na2CO3
C.与盐酸反应放出气泡的速率:NaHCO3<Na2CO3
D.Na2CO3不能转化成NaHCO3,而NaHCO3能转化成Na2CO3
15.镁在CO2含量较多的空气里燃烧的产物是
A.MgO B. Mg和C
C. MgO、Mg3N2 D. MgO、Mg3N2 和C
16.现有三种常见治疗胃病药品的标签:
[来源:21世纪教育网]
这三种药品中所含的物质均能中和胃里过量的盐酸,按每片药片中和胃酸的量来衡量药效,则药效由大到小为
A.①>②>③ B. ①>③>②
C.③>②>① D. ②>③>①
17.下列关于金属铝的叙述中,说法不正确的是
A.Al是地壳中含量最多的金属元素
B.Al是比较活泼的金属,在化学反应中容易失去电子,表现还原性 [来源:21世纪教育网]
C.在常温下,铝遇浓硫酸、浓硝酸时会发生钝化,且钝化是物理变化
D.铝箔在空气中受热可以熔化,由于氧化膜的存在,熔化的铝并不滴落[来源:21世纪教育网]
18.将铝投入到一定量的NaOH溶液中,充分反应后,有2mol的电子发生了转移。则参加反应的铝的物质的量为
A.1/3mol B.1mol C.2mol D.2/3mol
19.下列物质中既能跟稀H2SO4反应, 又能跟氢氧化钠溶液反应的是
①NaHCO3 ②Al2O3 ③Al(OH)3 ④Al
A.③④ B.②③④ C.①③④ D.全部
20.将氢氧化钠溶液逐滴加入含有盐酸的AlCl3溶液时, 图中曲线正确的是(x轴表示加入NaOH溶液的体积, y轴表示沉淀的量)
21.等质量的Na、Mg、Al分别跟足量的稀硫酸反应, 放出氢气由多到少的次序是 [来源:21世纪教育网]
A.Na>Mg>Al B.Al>Mg>Na C.Mg>Na>Al D.Al>Na>Mg
22.下列判断那些是正确的
①氢氧化钠是电解质
②强电解质溶液的导电性一定比弱电解质溶液导电性强
③氯化银难溶于水,所以氯化银是非电解质
④蔗糖易溶于水,所以是电解质
⑤氯气溶于水后导电,所以Cl2是电解质
A.① B.①③ C.①②⑤ D.①②③⑤
23.在强酸性溶液中,下列离子组能大量共存且溶液为无色透明的是
A.Na+、K+、OH-、Cl- B.Na+、Cu2+ 、SO42-、NO3-
C.Mg2+、Na+、SO42-、Cl- D.Ba2+、HCO3-、NO3-、K+
24.下列离子方程式书写正确的是
A.碳酸钡溶液中加入稀硫酸:BaCO3+2H+=Ba2++CO2↑+H2O
B.CuO与H2SO4混合:Cu2+ + SO42- = CuSO4 + H2O
C.NaHCO3溶液与盐酸反应:HCO3- + H+ = H2O + CO2↑
D.苛性钠溶液中加入稀醋酸:H+ + OH― = H2O
25.已知X2、Y2、Z2、W2四种物质的氧化能力为W2>Z2>X2>Y2,判断下列氧化还原反应能发生的是
A.2W-+Z2=2Z-+W2 B.2X-+Z2=2Z-+X2
C.2W-+Y2=2Y-+W2 D.2Z-+X2=2X-+Z2
Ⅱ卷 (非选择题共50分)
二、填空题(共15分)
26.用下列仪器的编号回答问题(5分)
①容量瓶 ②蒸馏烧瓶 ③分液漏斗 ④量筒 ⑤烧杯 ⑥托盘天平
⑴加热时必须垫石棉网的有 ,
⑵使用时必须检查是否漏水的有 ,[来源:21世纪教育网]
⑶标有零刻度的有 。
27.(8分)在反应2Na + 2H2O = 2NaOH + H 2 ↑中用双线桥表示此反应电子转移的方向和数目。氧化剂是 ,氧化产物是 ,生成33.6LH2 (标准状况下)时转移电子数为 。
28.(2分)在甲、乙两烧杯溶液中,含有大量的Cu2+、Na+、H+、SO42-、
CO32-、OH- 6种离子。
①已知甲烧杯的溶液呈蓝色,则甲烧杯的溶液中大量存在的离子是
②乙烧杯的溶液中大量存在的离子是 。(填离子符号)
三、实验题(共17分)
29.(1)(4分)用下图所示装置做NaHCO3的分解实验,请回答下列问题:
Ⅰ.大试管内发生反应的化学方程式为:
Ⅱ.组装装置后主要实验操作有:①用酒精灯加热;②熄灭酒精灯;③检查装置的气密性;④在试管里加入NaHCO3固体;⑤将导气管撤离石灰水。
则正确的操作为 (填各步操作的序号)。
(2)(9分)海水中含有大量的氯化镁,从海水中提取镁的生产流程如下图所示,并回答下列问题:
Ⅰ.写出在海水中加入氧化钙生成氢氧化镁的化学方程式 。
操作①主要是指 。
Ⅱ.试剂①可选用 ,该反应的离子方程式为 。[来源:21世纪教育网]
Ⅲ.操作②主要是指 。[来源:21世纪教育网]
Ⅳ.经操作③最终可得金属镁,该反应的化学方程式是 。
30.(4分)如图所示,在一烧杯中盛有H2SO4溶液,同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入 Ba(OH)2溶液至恰好完全反应[设H2SO4和Ba(OH)2溶液密度相同]。试回答
⑴此实验中,观察到的现象有
① , ② 。
⑵写出实验过程中反应的离子方程式为 。
四、计算题(共18分)
31.(9分)称取无水Na2CO3和NaHCO3的混合物4.42g,加入40mL的盐酸恰好完全反应生成NaCl CO2 和H2O。将生成的CO2全部通入过量的澄清 石灰水中,得到5.0g白色沉淀。求
(1)原混合物中Na2CO3和NaHCO3的质量。
(2)所加入盐酸的物质的量浓度。[来源:21世纪教育网]
[来源:21世纪教育网]
32.(9分)为测定镁铝合金中各金属的含量,取一定量的镁铝合金完全溶于足量的6mol/L的盐酸,在标准状况下收集到4.48升H2,在所得溶液中加入过量的氢阳化钠溶液充分反应后过滤,生成的沉淀经洗涤干燥称重质量为2.9g。求
⑴收集到的氢气物质的量为多少?
⑵原合金中镁铝的质量分别为多少g?
甲 乙
21世纪教育网 -- 中国最大型、最专业的中小学教育资源门户网站。 版权所有@21世纪教育网
