四年级语文上册课件 一个中国孩子的呼声 2(鲁教版)
文档属性
| 名称 | 四年级语文上册课件 一个中国孩子的呼声 2(鲁教版) |

|
|
| 格式 | rar | ||
| 文件大小 | 809.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 语文 | ||
| 更新时间 | 2010-10-12 00:00:00 | ||
图片预览


文档简介
2009—2010学年“拼搏一年·成就梦想”
高三年级第一次摸底考试( 化学 )科试卷
考试时间:100分钟 试卷满分:100分
命 题 人: 孙琳琳 审 题 人: 曲宝琦
注意事项:
1.答第Ⅰ卷前,考生务必将自己的姓名、考号、班级、考试科目等有关信息用2B铅笔涂写在答题卡和答题纸上.
2.每小题选出答案后,用铅笔把答题卡上对应题目的答案标号涂黑.如需改动,用橡皮擦干净后,再选涂其它答案.
3.考试结束后,只收答题纸和答题卡.
可能用到的相对原子质量: H:1 C:12 O:16 Na:23 Mg:24 Al:27
Si:28 S:32 Ca:40 Fe:56 Cu:64
第Ⅰ卷 (选择题共50分)
一、选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意)
1.下列叙述正确的是
A.危险化学品标志中的数字表示该危险品的危害程度,数字越大危害越大
B.二氧化硅晶体被广泛用于制作太阳能电池和光导纤维
C.根据分散质在分散剂中均匀分布时间的长短把分散系进一步分为溶液、胶体和浊液
D.钢材和硬币都是合金,若改变这些合金的原料配比会改变这些合金的性能
2.符合右图阴影部分的物质是
A.KHSO4 B.K2SO4
C.K2CO3 D.KAl(SO4)2·12H2O
3.下列药品保存方法不正确的是
A.浓HNO3和AgNO3溶液都要避光密封保存
B.保存氯化铁和氯化亚铁试剂都要加盐酸和铁粉
C.少量的金属钠、钾、白磷和液溴都要用液封法保存
D.碱性较强的溶液都要保存在配有胶塞的细口试剂瓶中
4.将电解质分为强、弱电解质的依据是
A.在一定条件下的电离程度 B.属于离子化合物还是共价化合物
C.熔融状态下是否完全电离 D.溶于水后的导电能力是强还是弱
5.下列反应过程中,最终溶液保持原来颜色的是
A.向滴有酚酞的NaOH溶液中通入过量的 CO2气体
B.向酸性KMnO4溶液中加入足量的H2O2
C.向含有KSCN的FeC13溶液中加入足量的Cu粉
D.向品红溶液中通入足量的等体积混合的Cl2与SO2气体
6.下列氧化还原反应中,1molH2O得到1mol电子的是
A.Cl2+H2O=HCl+HClO B.2Na2O2+2H2O=4NaOH+O2↑
C.2Na+2H2O=2NaOH+H2↑ D.3NO2+H2O=2HNO3+NO
7.下列各组离子在特定条件下一定能够大量共存的是
A.含有较多Fe3+的溶液:Na+、SO42—、HS—、NH4+
B.c(OH—)=1mol·L—1的溶液:AlO2—、CH3COO—、K+、Ba2+
C. pH=1的溶液:K+、Fe2+、NO3—、Na+
D.遇Al能放出H2的溶液:HCO3—、K+、Mg2+、Cl—
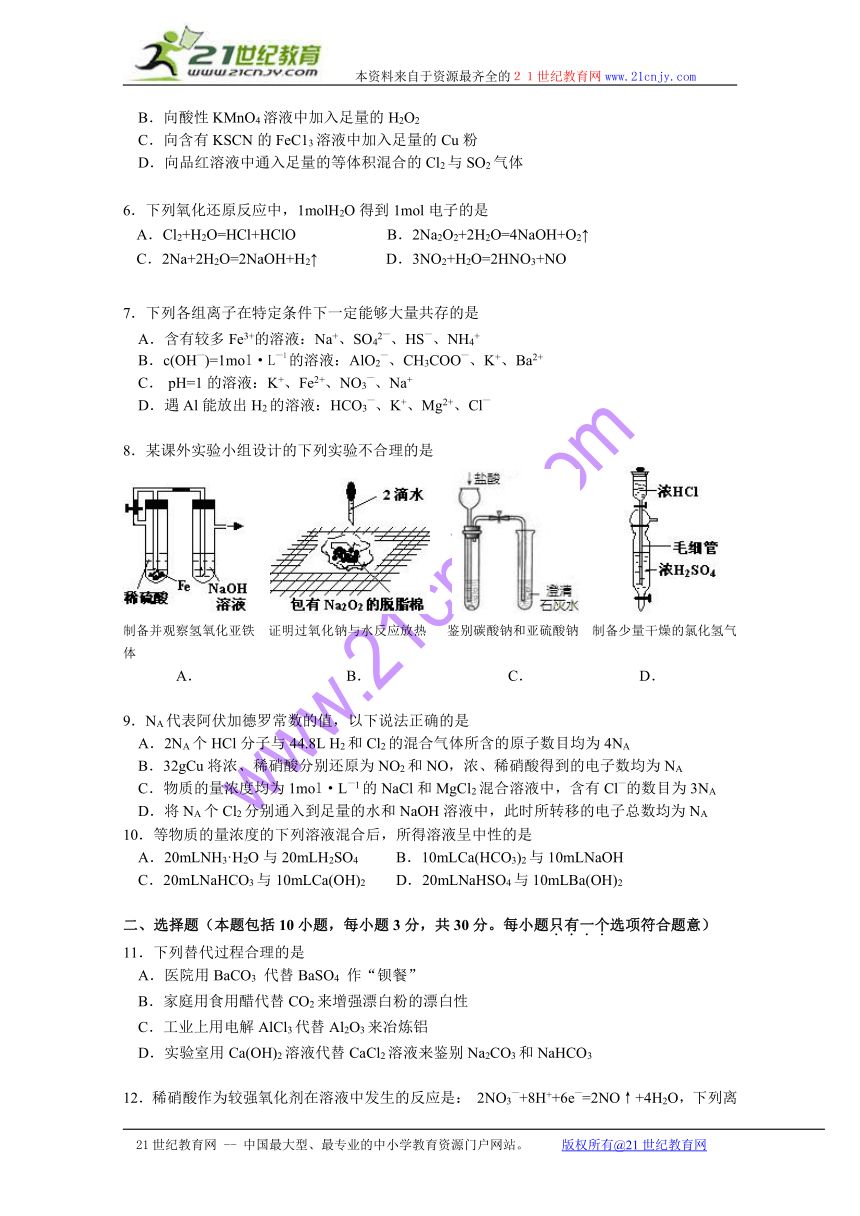
8.某课外实验小组设计的下列实验不合理的是
制备并观察氢氧化亚铁 证明过氧化钠与水反应放热 鉴别碳酸钠和亚硫酸钠 制备少量干燥的氯化氢气体
A. B. C. D.
9.NA代表阿伏加德罗常数的值,以下说法正确的是
A.2NA个HCl分子与44.8L H2和Cl2的混合气体所含的原子数目均为4NA
B.32gCu将浓、稀硝酸分别还原为NO2和NO,浓、稀硝酸得到的电子数均为NA
C.物质的量浓度均为1mol·L—1的NaCl和MgCl2混合溶液中,含有Cl—的数目为3NA
D.将NA个Cl2分别通入到足量的水和NaOH溶液中,此时所转移的电子总数均为NA
10.等物质的量浓度的下列溶液混合后,所得溶液呈中性的是
A.20mLNH3·H2O与20mLH2SO4 B.10mLCa(HCO3)2与10mLNaOH
C.20mLNaHCO3与10mLCa(OH)2 D.20mLNaHSO4与10mLBa(OH)2
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11.下列替代过程合理的是
A.医院用BaCO3 代替BaSO4 作“钡餐”
B.家庭用食用醋代替CO2来增强漂白粉的漂白性
C.工业上用电解AlCl3代替Al2O3来冶炼铝
D.实验室用Ca(OH)2溶液代替CaCl2溶液来鉴别Na2CO3和NaHCO3
12.稀硝酸作为较强氧化剂在溶液中发生的反应是: 2NO3—+8H++6e—=2NO↑+4H2O,下列离子能让此反应过程发生的是
①Fe2+;②Mg2+;③SO32—;④S2—;⑤I—;⑥ClO—。
A.①③④⑤ B.①②③④⑤⑥ C.②③④⑥ D.①③④⑥
13.下列离子方程式书写正确的是
A.AlCl3溶液与过量的浓氨水:Al3++4NH3·H2O=AlO2—+4NH4++2H2O
B.向Ca(ClO)2溶液通入过量的CO2:Ca2++2ClO—+CO2+H2O=CaCO3↓+2HClO
C.NH4HCO3溶液与少量的澄清石灰水:Ca2++HCO3—+OH—=CaCO3↓+H2O
D.CuSO4溶液与少量的Ba(OH)2溶液: Cu2++ SO42—+Ba2++2OH—=Cu(OH)2↓+BaSO4↓
14.下列反应所产生的气体体积在标准状况下为22.4L的是
A.将2mol金属Cu与含2molH2SO4的浓硫酸共热
B.将1 mol MnO2固体与含4molHCl的浓盐酸共热
C.常温下,将32.2g金属钠和5.4g金属铝同时投入到足量水中
D.常温下,将10.8g的Al和22.4g的Fe投入到300g 98%的硫酸中
15.将下列A~D四组物质wg分别在O2中充分燃烧后,再通过装有足量Na2O2的干燥管,干燥管增重的质量大于wg的是
A.C4H8O2 B.C6H12O6
C.C2H4O3 D.H2和CO的混合气体
16.下列类比正确的是
A.NaHCO3晶体可以使新制氯水中c(HClO)浓度增大;NaHSO3晶体也可以
B.品红溶液能区别CO2和SO2两种气体,石蕊也能
C.CO2和SO2都不能使BaCl2溶液变浑浊,SO3也不能
D.用BaCl2和稀硝酸不能证明某无色溶液中一定含有SO42—,Ba(NO3)2和稀硝酸也不能
17.某学习小组为了探究碳酸钠溶液与盐酸的反应,将等体积的a mol/LNa2CO3溶液和b mol/L盐酸相互滴加混合,收集的气体体积大小关系为:V1>V2>0。下列有关说法正确的是
A.V1是盐酸滴入到碳酸钠中产生的气体 B.2a>b>a
C.a=b D.2a=b
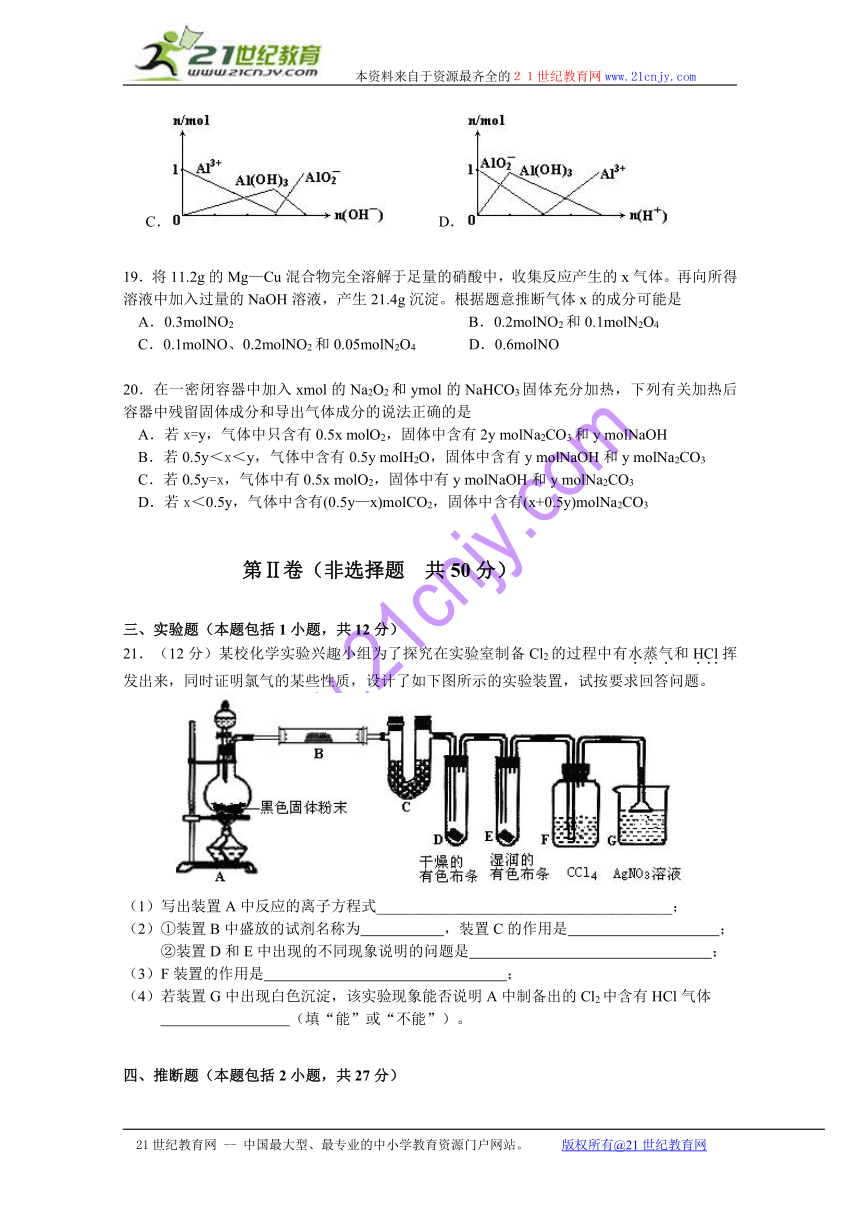
18.下列图像正确的是
A. B.
C. D.
19.将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入过量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
A.0.3molNO2 B.0.2molNO2和0.1molN2O4
C.0.1molNO、0.2molNO2和0.05molN2O4 D.0.6molNO
20.在一密闭容器中加入xmol的Na2O2和ymol的NaHCO3固体充分加热,下列有关加热后容器中残留固体成分和导出气体成分的说法正确的是
A.若x=y,气体中只含有0.5x molO2,固体中含有2y molNa2CO3和y molNaOH
B.若0.5y<x<y,气体中含有0.5y molH2O,固体中含有y molNaOH和y molNa2CO3
C.若0.5y=x,气体中有0.5x molO2,固体中有y molNaOH和y molNa2CO3
D.若x<0.5y,气体中含有(0.5y—x)molCO2,固体中含有(x+0.5y)molNa2CO3
第Ⅱ卷(非选择题 共50分)
三、实验题(本题包括1小题,共12分)
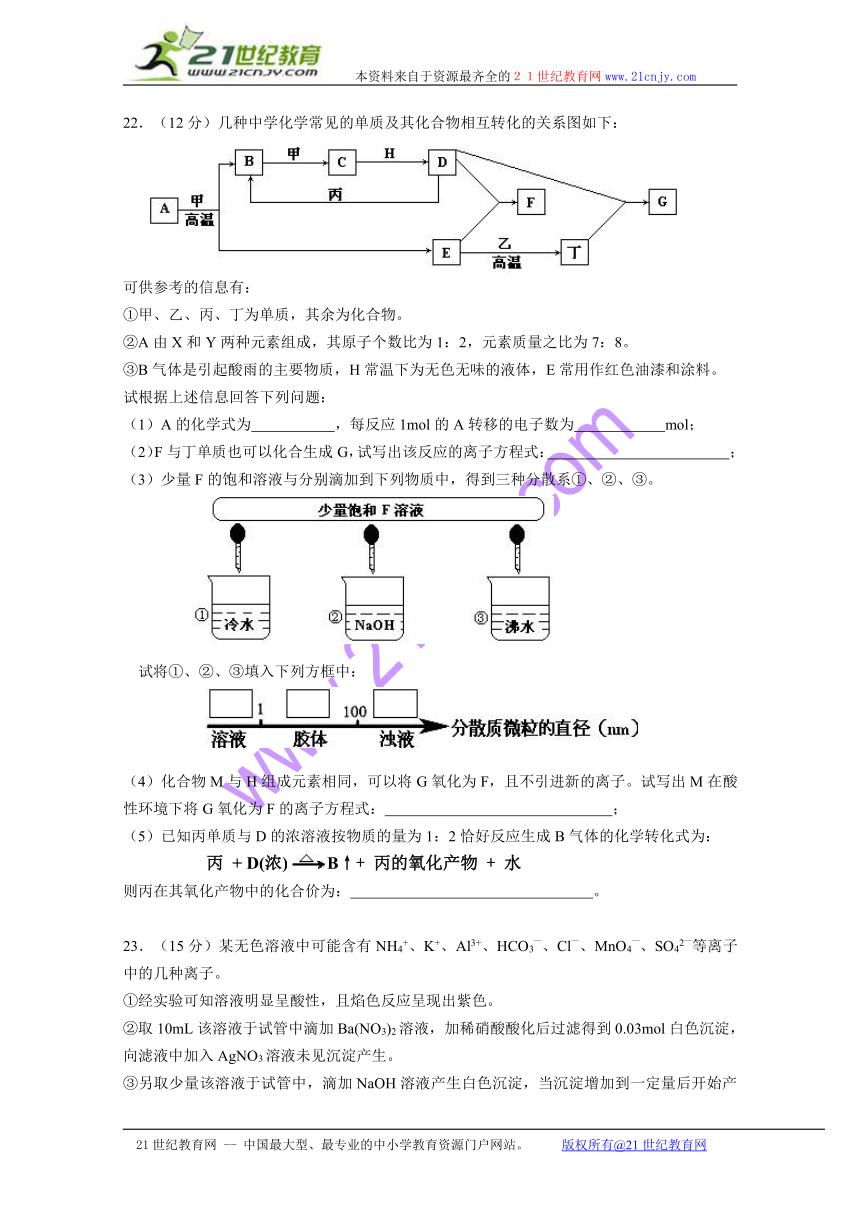
21.(12分)某校化学实验兴趣小组为了探究在实验室制备Cl2的过程中有水蒸气和HCl挥发出来,同时证明氯气的某些性质,设计了如下图所示的实验装置,试按要求回答问题。
(1)写出装置A中反应的离子方程式_______________________________________;
(2)①装置B中盛放的试剂名称为 ,装置C的作用是 ;
②装置D和E中出现的不同现象说明的问题是 ;
(3)F装置的作用是 ;
(4)若装置G中出现白色沉淀,该实验现象能否说明A中制备出的Cl2中含有HCl气体
(填“能”或“不能”)。
四、推断题(本题包括2小题,共27分)
22.(12分)几种中学化学常见的单质及其化合物相互转化的关系图如下:
可供参考的信息有:
①甲、乙、丙、丁为单质,其余为化合物。
②A由X和Y两种元素组成,其原子个数比为1:2,元素质量之比为7:8。
③B气体是引起酸雨的主要物质,H常温下为无色无味的液体,E常用作红色油漆和涂料。
试根据上述信息回答下列问题:
(1)A的化学式为 ,每反应1mol的A转移的电子数为 mol;
(2)F与丁单质也可以化合生成G,试写出该反应的离子方程式: ;
(3)少量F的饱和溶液与分别滴加到下列物质中,得到三种分散系①、②、③。
试将①、②、③填入下列方框中:
(4)化合物M与H组成元素相同,可以将G氧化为F,且不引进新的离子。试写出M在酸性环境下将G氧化为F的离子方程式: ;
(5)已知丙单质与D的浓溶液按物质的量为1:2恰好反应生成B气体的化学转化式为:
丙 + D(浓)B↑+ 丙的氧化产物 + 水
则丙在其氧化产物中的化合价为: 。
23.(15分)某无色溶液中可能含有NH4+、K+、Al3+、HCO3—、Cl—、MnO4—、SO42—等离子中的几种离子。
①经实验可知溶液明显呈酸性,且焰色反应呈现出紫色。
②取10mL该溶液于试管中滴加Ba(NO3)2溶液,加稀硝酸酸化后过滤得到0.03mol白色沉淀,向滤液中加入AgNO3溶液未见沉淀产生。
③另取少量该溶液于试管中,滴加NaOH溶液产生白色沉淀,当沉淀增加到一定量后开始产生气体,最后沉淀完全溶解。
(1)该溶液中一定不含有 (填离子的化学式)离子,一定含有的离子有 (填离子的化学式);
(2)在这些不存在的离子中,有一种离子在酸性环境中和碱性环境中都不能存在,试写出该离子与酸反应的离子方程式: ;
(3)为确定上述溶液中所含的各种离子的物质的量,取100mL上述溶液并向其中加入Na2O2固体,产生的沉淀和气体与所加Na2O2固体物质的量的关系曲线如图Ⅰ:
①该溶液中焰色反应呈现紫色的离子的物质的量为: mol,
②写出n(Na2O2)=0.2mol时反应的总离子方程式: ;
(4)将0.1mol明矾晶体与等物质的量的某无水盐晶体X混合后溶解于水中,所得溶液与上述溶液所含离子种类完全相同。若向该溶液中加入Ba(OH)2溶液,所得沉淀的物质的量与所加入Ba(OH)2的物质的量的关系如图Ⅱ:
试根据图像推断①X的化学式: ,②图像中A点溶液中的离子成分和物质的量分别是: ;
五、计算题(本题包括2小题,共11分)
24.(6分)已知①氯水和溴水能将Fe2+氧化成Fe3+,而碘水不能;②Fe3+可以使KI—淀粉试液变蓝色。
(1)向100mlFeBr2溶液中通入标况下体积为3.36L的Cl2,充分反应后测得溶液中Cl—和Br—的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为 ;
(2)向含1molFeI2和2molFeBr2的溶液中通入3molCl2后,溶液中所含各种离子的个数之比是 ;
(3)向含a mol FeI2和b mol FeBr2的溶液中通入c molCl2,若要保证溶液中含有两种阳离子,
c的取值范围是 。
25.(5分)现有一含少量SiO2杂质的石灰石样品,某实验小组同学为准确测定该样品的纯度,他们取用2.0g样品于烧杯中,把25.00mL某浓度的盐酸分成5等份,准备分别加入烧杯中进行反应,他们将前4次实验的结果记录如下:
次序
盐酸
剩余固体
1
先加入5.00mL
1.32g
2
再加入5.00mL
0.64g
3
再加入5.00mL
0.2g
4
再加入5.00mL
0.2g
(1)该实验小组同学是否还需要将第5份盐酸加入烧杯? ;
(2)原样品的纯度(CaCO3的质量分数)是______________。
(3)求该实验小组同学所用盐酸的物质的量浓度。(要求写出计算过程)
2009—2010学年“拼搏一年·成就梦想”
高三年级第一次摸底考试( 化学 )科试卷
答 题 纸
三、实验题(本题包括1小题,共12分)
21.(12分)
(1) (2分)
(2)① (2分) (2分)
② (2分)
(3) (2分)
(4) (2分)
四、推断题(本题包括2小题,共27分)
22.(12分)
(1) (2分) mol (2分)
(2) (2分)
(3)(2分)
(4) (2分)
(5) (2分)
23.(15分)
(1) (2分), (2分)
(2) (2分)
(3)① mol (2分)
② (2分)
(4)① (2分)
② (3分)
五、计算题(本题包括2小题,共11分)
24.(6分)
(1) (2分)
(2) (2分)
(3) (2分)
25.(5分)
(1) (1分)
(2) (2分)
(3)(2分)
2009—2010学年“拼搏一年·成就梦想”
高三年级第一次摸底考试( 化学 )科试卷
参 考 答 案
一、选择题(本题包括10小题,每题2分,共20分。每小题只有一个选项符合题意)
1.D 2.B 3.B 4.A 5.D
6.C 7.B 8.C 9.B 10. D
二、选择题(本题包括10小题,每小题3分,共30分。每小题只有一个选项符合题意)
11.B 12.A 13.D 14.C 15.A
16.D 17.B 18.B 19.C 20. D
三、实验题(本题包括1小题,共12分)
21、(1)MnO2+4H++2Cl-Mn2++Cl2↑+2H2O(2分)
(2)①无水硫酸铜(2分) 除水蒸气(2分)
②氯气无漂白性,次氯酸有漂白性 (或湿润的氯气有漂白性)(2分)
(3)吸收氯气(2分)
(4)不能(2分)
四、推断题(本题包括2小题,共27分)
22、(1)FeS2(2分),11 (2分);
(2)2Fe3++Fe=3Fe2+(2分);
(3)(2分)
(4)H2O2+2H++2Fe2+=2Fe3++2H2O(2分);
(5)+2或+4(2分);
23、(1)HCO3—、Cl—、MnO4—(2分),K+、NH4+、Al3+、SO42—(2分);
(2)HCO3—+H+=CO2↑+H2O(2分);
(3)① 0.1(2分)
②Al3++NH4++2Na2O2+H2O=Al(OH)3↓+NH3↑+O2↑+4Na+(2分);
(4)①(NH4)2SO4 (2分);
②0.1mol K+、0.2mol NH4+、0.15mol SO42—(3分)。
五、计算题(本题包括2小题,共11分)
24、(1)2mol/L(2分);
(2)Fe3+:Cl—:Br—=1:2:1(2分);
(3)a<c<(1.5a+0.5b) (2分)。
25、(1)不需要(1分)
(2)90%(2分)
(3)(2分) 根据 CaCO3——2HCl 有:
(2.0—1.32)g×2/100g·mol—1=0.005L×c(HCl)
c(HCl)=2. 72mol/L。
同课章节目录
- 第一单元
- 1 古诗两首
- 2 桂林山水
- 3 记金华的双龙洞
- 4 七月的天山
- 第二单元
- 5 中彩那天
- 6 万年牢
- 7 尊严
- 8 将心比心
- 第三单元
- 9 巨人的花园
- 10 幸福是什么
- 11 去年的树
- 12 小木偶的故事
- 第四单元
- 13 触摸春天
- 14 永生的眼睛
- 15 生命 生命
- 16 花的勇气
- 第五单元
- 17 夜莺的歌声
- 18 小英雄雨来
- 19 一个中国孩子的呼声
- 20 和我们一样享受春天
- 第六单元
- 21 古诗词三首
- 22 梅花魂
- 23 桂花雨
- 24 小桥流水人家
- 第七单元
- 25 为中华崛起而读书
- 26 那片绿绿的爬山虎
- 27 乌塔
- 28 尺有所短 寸有所长
- 第八单元
- 29 两个铁球同时着地
- 30 全神贯注
- 31 鱼游到了纸上
- 32 父亲的菜园
- 选读课文
- 趵突泉
- 小珊迪
- 小青石
- 生命的药方
- 黄继光
- 斗笠
- 到期归还
