人教版九年级化学第十一单元课题1生活中常见的盐(共51张PPT)
文档属性
| 名称 | 人教版九年级化学第十一单元课题1生活中常见的盐(共51张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-28 00:00:00 | ||
图片预览










文档简介
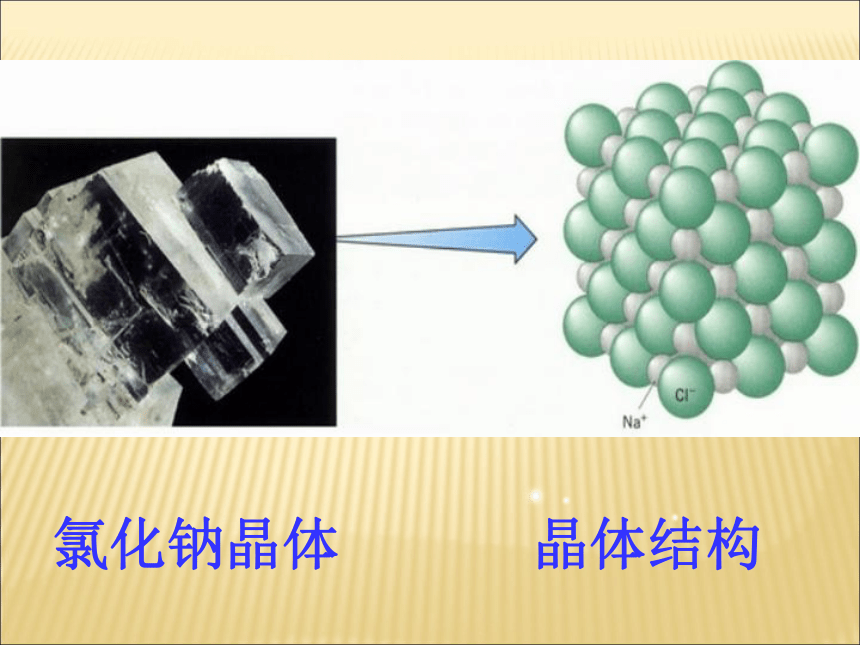
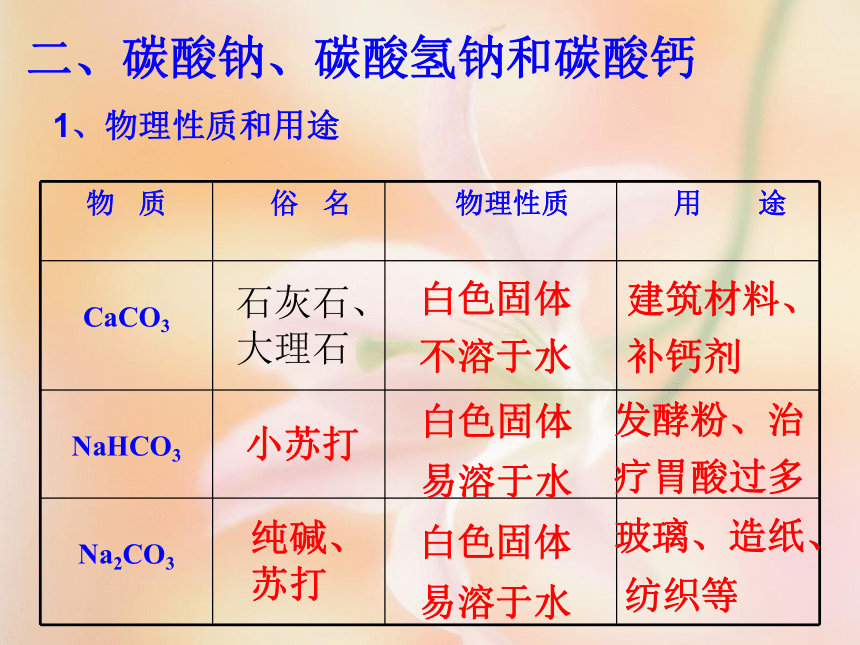
课件51张PPT。课题 1 生活中常见的盐第十一单元 盐 化肥盐是什么??组成里含有金属离子(或铵根离子NH4+)和酸根离子化合物。【碳酸钠Na2CO3、碳酸氢钠NaHCO3、高锰酸钾KMnO4、亚硝酸钠NaNO2(有毒)都属于 】盐一、氯化钠氯化钠晶体晶体结构氯化钠在生活中的用途:氯化钠是重要的调味品。钠离子对维持细胞内外正常的水分分布和促进细胞内外物质交换起重要作用;氯离子是胃液中的主要成分,具有促生盐酸,帮助消化和增进食欲的作用。氯化钠可以配制生理盐水,还可以作融雪剂。海水、盐湖、盐井和岩矿中都蕴藏食盐海盐通过晾晒海水或煮盐井水、盐湖水等,可以蒸发除去水分,得到粗盐。粗盐中含有多种可溶性杂质(氯化镁、氯化钙等)和不溶性杂质(泥沙等)。粗盐通过溶解、沉淀、过滤、蒸发、结晶等处理,可以得到初步提纯。怎样从海水中得到粗盐?粗盐中含有哪些杂质?粗盐如何提纯?注意观察大理石的应用。天安门前华表人民大会堂的柱子豪华酒店地面二、碳酸钠、碳酸氢钠和碳酸钙1、物理性质和用途纯碱、苏打白色固体
易溶于水玻璃、造纸、
纺织等 小苏打白色固体
易溶于水白色固体
不溶于水发酵粉、治
疗胃酸过多建筑材料、
补钙剂石灰石、大理石纯碱(Na2CO3)是不是碱, ,而是 。它的水溶液显碱性。小苏打(NaHCO3)水溶液也显碱性。注意:不是碱 盐【回顾] 请说出实验室制取CO2的化学反应原理。CaCO3 + 2 HCl == CaCl2 + H2O+CO2↑【猜想】
根据上述反应,请问Na2CO3和NaHCO3能否与稀盐酸反应?
如果能反应,请问它们又会生成什么物质?盐酸腐蚀含CaCO3的建材白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体实验11-1 :向盛有0.5g碳酸钠(或碳酸氢钠)的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管的另一端通入盛有澄清石灰水的试管中,观察现象。化学方程式: Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
生成二氧化碳气体【思考】1、含有CO32- 或HCO3 –的盐都能与哪类
物质反应,产生的气体是什么?
2、如何检验CO32- 或HCO3 –?取少量待测样品于试管中,加入少量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或HCO3 – 能与盐酸反应, Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O写出碳酸钠、碳酸氢钠跟盐酸反应的化学方程式。小结:组成里含有CO32-(或HCO3-)离子的盐,都能和稀HCl反应生成使澄清石灰水变浑浊的气体CO2 ,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)离子。所用试剂为稀盐酸和澄清石灰水。实验11-2:向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。有白色沉淀生成碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
(生成新盐和新碱)如何判断氢氧化钠固体是否变质?能不能用酸碱指示剂?为什么?取少量物质溶于水,再滴加足量的什么试剂呢。Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
还可以选用什么试剂呢?Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
石灰水稀盐酸实验11-3 向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液。产生蓝色絮状沉淀产生白色沉淀CuSO4+2NaOH=
Cu(OH)2↓+Na2SO4CuSO4+BaCl2=
BaSO4↓+CuCl2
观察:上述几个反应有什么特点?
(分析)反应物通过什么方式变成了生成物? ???
CaCO3+2HCl=CaCl2+H2CO3? ???
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2SO4+BaCl2=2NaCl+BaSO4↓H2O+CO2 ↑分析下面这个反应的离子互换过程。定义:两种化合物互相交换成分,生成另外两种化合物的反应,叫做AB+CD=AD+Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
用字母表示为:CB复分解反应是基本类型。复分解反应。1、酸和碱作用生成盐和水的中和反应是否也属复分解反应?为什么?答:属于复分解反应。因为“酸
+碱→盐+水”符合复分解反应
的概念,即两种化合物相互交换
成分,生成另外两种化合物。讨论??? 2、分析归纳上述几个酸、碱、盐之间的复分解反应,它们的生成 物有什么特点? 答:生成物中有沉淀或气体或水生成。讨论NaOH + KNO3 = × Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2SO4+2NaOH=Na2SO4+2H2O复习三个化学方程式:反应物的要求 :
金属氧化物+酸
盐+酸
(中和反应)碱+酸
盐(可溶 )+碱(可溶 )
盐(可溶 )+盐(可溶 )
生成物的要求 :沉淀或气体或水
}(有一种反应物可溶即可 )复分解反应的实质:离子之间结合,生成水
(或沉淀或气体)盐的分类阴离子分类氯化物硝酸盐硫酸盐
碳酸盐碳酸氢盐
命名
氯化某硝酸某
硫酸某碳酸某碳酸氢某阳离子分类钠盐
镁盐
铵盐酸、碱、盐的溶解性(20℃)盐的溶解性
硫(酸)盐不溶硫酸钡,
氯(化)物不溶氯化银,
其 它盐类往下沉。钾钠硝(酸)铵溶水快,1、判断稀硫酸与下表中的溶液之间能否发生反应H2SO4+2NaOH=Na2SO4+2H2OH2SO4+2NaCl=Na2SO4+2HCl H2SO4+K2CO3=K2SO4+H2O+CO2↑H2SO4+Ba(N03)2=BaSO4↓+2HNO3××2、下列各组中的物质,能在溶液中共存的是 ( )
A KNO3 NaCl NaOH
B KOH Na2CO3 HCl
C KNO3 NaOH FeCl3
D AgNO3 BaCl2 HNO3A Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
3NaOH + FeCl3 =Fe(OH)3↓ +3NaCl 2AgNO3 + BaCl2=2AgCl ↓+ Ba(NO3)2 1、AgNO3 + HCl ----------
2、 K2CO3+ Ca(OH)2-----
3、Na2CO3+ H2SO4 -----
4、Na2SO4 + HCl ----------5、H2SO4 + BaCl2--------
6、Ba(OH)2+ KCl --------
7、CuSO4 + NaNO3-----
8、HNO3 + NaOH -------AgCl↓+HNO3CaCO3↓+ KOHNa2SO4+H2O+CO2↑不反应BaSO4↓+HCl不反应不反应NaNO3 + H2O比一比,赛一赛:下列哪些能反应?复分解反应的本质:下列短线两端的两种离子能发生反应,在溶液中不能共存。例如中和反应就是:H++OH-=H2O盐的化学性质:1、盐+金属→新盐+新金属(金属前换后,盐
溶是条件,KCaNa除外,铁换亚铁盐)Fe+CuSO4==FeSO4+Cu2、盐+酸(一种可溶)→新盐+新酸CaCO3+2HCl==CaCl2+CO2↑+H2O3、盐+碱(两种可溶)→新盐+新碱Na2CO3+Ca(OH)2==CaCO3↓+2NaOH4、盐+盐(两种可溶)→两种新盐Na2CO3+BaCl2==BaCO3↓+2NaCl举例:举例:举例:举例:掌握物质的分类物质{混合物纯净物{单质化合物{氧化物酸碱盐把空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠、氯化钠放入相应的位置。{金属单质非金属单质稀有气体单质每种物质分别举例。{金属氧化物非金属氧化物总结物质之间的变化规律金属↓金属氧化物↓碱非金属↓非金属氧化物↓酸盐盐_______________________如何判断氢氧化钠是部分变质还是全部变质?取少量物质溶于水,加入足量的氯化钙溶液(或氯化钡溶液),然后向溶液中滴加无色酚酞溶液。CaCl2+Na2CO3=CaCO3↓+2NaCl若溶液变为红色,说明氢氧化钠 变质若溶液仍为无色,说明氢氧化钠 变质提示:氯化钙、氯化钡、氯化钠溶液呈中性NaOH(Na2CO3)
2NaOH + CO2 = Na2CO3 + H2O能否直接用酚酞溶液来判断?部分全部 巩固练习:
1、体操运动员在上器械之前常用“镁粉”搓手,“镁粉”的主要成分是碳酸镁。 碳酸镁属于 ( )
A. 氧化物 B. 酸 C. 碱 D. 盐
2、下列各组物质的名称、俗名和化学式一致的是( )
A.氢氧化钠、纯碱、NaOH
B.氢氧化钙、熟石灰、Ca(OH)2
C.碳酸氢钠、烧碱、Na2CO3
D.氧化钙、石灰石、CaO D B4.下列反应中不属于复分解反应的是( )
A. H2SO4+Ca(OH)2==CaSO4+2H2O
B. H2SO4+BaCl2==BaSO4↓+2HCl
C. 2HCl+Fe==FeCl2+H2↑
D. 2HCl+CaCO3==CaCl2+H2O+CO2↑
5.在下列物质中:A.食盐; B.碳酸氢钠;
C.纯碱; D.碳酸钙;
(1)可用作调味剂的 ;
(2)可用作发酵粉和治疗胃酸过多症的是 。
(3)可用作补钙剂和牙膏填充剂的是 ;
(4)可用于生产玻璃的是 ; ABD CC6、探究:如何鉴别氯化钠溶液和碳酸钠溶液?Na2CO3+2HCl==
2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==
CaCO3↓+2NaOH酚酞试液
显红色的为碳酸钠溶液,显无色的为氯化钠溶液pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氢氧化钙
溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液7、为了探究皮蛋中的化学知识,同学们找来一包
皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化
钙、纯碱和食盐。为了验证皮蛋加工配料的主要成分,他们进行了
如下实验:
(1)、取少量配料于小烧杯中,并向其中加入适量的水,搅拌、静
置、过滤。过滤后得到的白色固体为 它们在水中发生反
应的化学方程式为 、
。
滤液中一定存在溶质是 (2)、如果反应物没有恰好完全反应,滤液中还可能存在的溶质
是:_______________________________
_________________________________
CaCO3CaO+H2O==Ca(OH)2Ca(OH)2+Na2CO3==CaCO3 ↓ +2NaOHNaOH、NaCl①滤液中若有Na2CO3,则没有Ca(OH)2②滤液中若没有Na2CO3,则有Ca(OH)2(3)、为了进一步确定滤液中可能存在的物质,他们设计
了如下实验,请你帮助他们完善:实验步骤取一支试管,倒入少量
滤液,往其中滴加稀盐
酸实验现象若有气泡产生若无气泡产生实验结论①滤液中有
Na2CO3,没
有Ca(OH)2②滤液中没
有Na2CO3,
有Ca(OH)2你认为是否仍需进行实验? (填“是”或
“否”),理由是 。滤液中可能存在的物质已确定否7.(8分)有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:
(Ⅰ)取一定量的白色粉末,加入足量水,振荡,得到无色透明溶液;
(Ⅱ)取少量(Ⅰ)的溶液,加入足量盐酸,有气泡产生。(提示:Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?____,可能含有什么物质?____。专题四:物质的推断 (2)为确定可能含有的物质是否存在,还需要做什么实验?请写出简要的实验步骤。__________________________________________________________。3、专题训练专题四:物质的推断3、专题训练专题八:综合计算型试题3、专题训练专题八:综合计算型试题3、专题训练专题八:综合计算型试题3、专题训练基本反应类型比较:产生白色沉淀含有Cl-的溶液能与硝酸银溶液反
应产生不溶于稀硝酸的白色沉淀,
以此鉴别Cl-(Cl-+Ag+=AgCl↓) NaCl +AgNO3=AgCl↓+NaNO3向盛有少量NaCl溶液的试管中
滴入硝酸银溶液,观察现象。产生白色沉淀含有SO42—的溶液能与BaCl2溶液反
应产生不溶于稀硝酸的白色沉淀,以
此鉴别SO42— (Ba2++SO42-==BaSO4↓)向盛有少量BaCl2溶液的试管中
滴入硫酸钠溶液,观察现象。 BaCl2 +Na2SO4=BaSO4↓+2NaCl石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
易溶于水玻璃、造纸、
纺织等 小苏打白色固体
易溶于水白色固体
不溶于水发酵粉、治
疗胃酸过多建筑材料、
补钙剂石灰石、大理石纯碱(Na2CO3)是不是碱, ,而是 。它的水溶液显碱性。小苏打(NaHCO3)水溶液也显碱性。注意:不是碱 盐【回顾] 请说出实验室制取CO2的化学反应原理。CaCO3 + 2 HCl == CaCl2 + H2O+CO2↑【猜想】
根据上述反应,请问Na2CO3和NaHCO3能否与稀盐酸反应?
如果能反应,请问它们又会生成什么物质?盐酸腐蚀含CaCO3的建材白色固体溶解,放出使澄清石灰水变浑浊的无色气体碳酸钠(或碳酸氢钠)与盐酸反应生成了CO2气体实验11-1 :向盛有0.5g碳酸钠(或碳酸氢钠)的试管里加入2mL盐酸,迅速用带导管的胶塞塞紧试管口,并将导管的另一端通入盛有澄清石灰水的试管中,观察现象。化学方程式: Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O
生成二氧化碳气体【思考】1、含有CO32- 或HCO3 –的盐都能与哪类
物质反应,产生的气体是什么?
2、如何检验CO32- 或HCO3 –?取少量待测样品于试管中,加入少量稀盐酸,若产生能使澄清石灰水变浑浊的气体,则说明样品中含有CO32- 或HCO3 – 能与盐酸反应, Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
NaHCO3 + HCl === NaCl + CO2↑+H2O写出碳酸钠、碳酸氢钠跟盐酸反应的化学方程式。小结:组成里含有CO32-(或HCO3-)离子的盐,都能和稀HCl反应生成使澄清石灰水变浑浊的气体CO2 ,利用此反应可以检验盐的组成中是否含有CO32-(或HCO3-)离子。所用试剂为稀盐酸和澄清石灰水。实验11-2:向盛有少量碳酸钠溶液的试管里滴入澄清的石灰水,观察现象。有白色沉淀生成碳酸钠与氢氧化钙反应生成碳酸钙白色沉淀Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
(生成新盐和新碱)如何判断氢氧化钠固体是否变质?能不能用酸碱指示剂?为什么?取少量物质溶于水,再滴加足量的什么试剂呢。Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
还可以选用什么试剂呢?Na2CO3+Ca(OH)2==CaCO3↓+2NaOH
石灰水稀盐酸实验11-3 向两只分别盛有少量氢氧化钠溶液和氯化钡溶液的试管中滴加硫酸铜溶液。产生蓝色絮状沉淀产生白色沉淀CuSO4+2NaOH=
Cu(OH)2↓+Na2SO4CuSO4+BaCl2=
BaSO4↓+CuCl2
观察:上述几个反应有什么特点?
(分析)反应物通过什么方式变成了生成物? ???
CaCO3+2HCl=CaCl2+H2CO3? ???
Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
Na2SO4+BaCl2=2NaCl+BaSO4↓H2O+CO2 ↑分析下面这个反应的离子互换过程。定义:两种化合物互相交换成分,生成另外两种化合物的反应,叫做AB+CD=AD+Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
用字母表示为:CB复分解反应是基本类型。复分解反应。1、酸和碱作用生成盐和水的中和反应是否也属复分解反应?为什么?答:属于复分解反应。因为“酸
+碱→盐+水”符合复分解反应
的概念,即两种化合物相互交换
成分,生成另外两种化合物。讨论??? 2、分析归纳上述几个酸、碱、盐之间的复分解反应,它们的生成 物有什么特点? 答:生成物中有沉淀或气体或水生成。讨论NaOH + KNO3 = × Na2CO3+Ca(OH)2=2NaOH+CaCO3↓
CaCO3+2HCl=CaCl2+H2O+CO2↑
H2SO4+2NaOH=Na2SO4+2H2O复习三个化学方程式:反应物的要求 :
金属氧化物+酸
盐+酸
(中和反应)碱+酸
盐(可溶 )+碱(可溶 )
盐(可溶 )+盐(可溶 )
生成物的要求 :沉淀或气体或水
}(有一种反应物可溶即可 )复分解反应的实质:离子之间结合,生成水
(或沉淀或气体)盐的分类阴离子分类氯化物硝酸盐硫酸盐
碳酸盐碳酸氢盐
命名
氯化某硝酸某
硫酸某碳酸某碳酸氢某阳离子分类钠盐
镁盐
铵盐酸、碱、盐的溶解性(20℃)盐的溶解性
硫(酸)盐不溶硫酸钡,
氯(化)物不溶氯化银,
其 它盐类往下沉。钾钠硝(酸)铵溶水快,1、判断稀硫酸与下表中的溶液之间能否发生反应H2SO4+2NaOH=Na2SO4+2H2OH2SO4+2NaCl=Na2SO4+2HCl H2SO4+K2CO3=K2SO4+H2O+CO2↑H2SO4+Ba(N03)2=BaSO4↓+2HNO3××2、下列各组中的物质,能在溶液中共存的是 ( )
A KNO3 NaCl NaOH
B KOH Na2CO3 HCl
C KNO3 NaOH FeCl3
D AgNO3 BaCl2 HNO3A Na2CO3 + 2 HCl === 2NaCl +CO2↑+H2O
3NaOH + FeCl3 =Fe(OH)3↓ +3NaCl 2AgNO3 + BaCl2=2AgCl ↓+ Ba(NO3)2 1、AgNO3 + HCl ----------
2、 K2CO3+ Ca(OH)2-----
3、Na2CO3+ H2SO4 -----
4、Na2SO4 + HCl ----------5、H2SO4 + BaCl2--------
6、Ba(OH)2+ KCl --------
7、CuSO4 + NaNO3-----
8、HNO3 + NaOH -------AgCl↓+HNO3CaCO3↓+ KOHNa2SO4+H2O+CO2↑不反应BaSO4↓+HCl不反应不反应NaNO3 + H2O比一比,赛一赛:下列哪些能反应?复分解反应的本质:下列短线两端的两种离子能发生反应,在溶液中不能共存。例如中和反应就是:H++OH-=H2O盐的化学性质:1、盐+金属→新盐+新金属(金属前换后,盐
溶是条件,KCaNa除外,铁换亚铁盐)Fe+CuSO4==FeSO4+Cu2、盐+酸(一种可溶)→新盐+新酸CaCO3+2HCl==CaCl2+CO2↑+H2O3、盐+碱(两种可溶)→新盐+新碱Na2CO3+Ca(OH)2==CaCO3↓+2NaOH4、盐+盐(两种可溶)→两种新盐Na2CO3+BaCl2==BaCO3↓+2NaCl举例:举例:举例:举例:掌握物质的分类物质{混合物纯净物{单质化合物{氧化物酸碱盐把空气、氧气、水、碳、二氧化碳、氧化铜、铁、铝、硫酸、氢氧化钠、氯化钠放入相应的位置。{金属单质非金属单质稀有气体单质每种物质分别举例。{金属氧化物非金属氧化物总结物质之间的变化规律金属↓金属氧化物↓碱非金属↓非金属氧化物↓酸盐盐_______________________如何判断氢氧化钠是部分变质还是全部变质?取少量物质溶于水,加入足量的氯化钙溶液(或氯化钡溶液),然后向溶液中滴加无色酚酞溶液。CaCl2+Na2CO3=CaCO3↓+2NaCl若溶液变为红色,说明氢氧化钠 变质若溶液仍为无色,说明氢氧化钠 变质提示:氯化钙、氯化钡、氯化钠溶液呈中性NaOH(Na2CO3)
2NaOH + CO2 = Na2CO3 + H2O能否直接用酚酞溶液来判断?部分全部 巩固练习:
1、体操运动员在上器械之前常用“镁粉”搓手,“镁粉”的主要成分是碳酸镁。 碳酸镁属于 ( )
A. 氧化物 B. 酸 C. 碱 D. 盐
2、下列各组物质的名称、俗名和化学式一致的是( )
A.氢氧化钠、纯碱、NaOH
B.氢氧化钙、熟石灰、Ca(OH)2
C.碳酸氢钠、烧碱、Na2CO3
D.氧化钙、石灰石、CaO D B4.下列反应中不属于复分解反应的是( )
A. H2SO4+Ca(OH)2==CaSO4+2H2O
B. H2SO4+BaCl2==BaSO4↓+2HCl
C. 2HCl+Fe==FeCl2+H2↑
D. 2HCl+CaCO3==CaCl2+H2O+CO2↑
5.在下列物质中:A.食盐; B.碳酸氢钠;
C.纯碱; D.碳酸钙;
(1)可用作调味剂的 ;
(2)可用作发酵粉和治疗胃酸过多症的是 。
(3)可用作补钙剂和牙膏填充剂的是 ;
(4)可用于生产玻璃的是 ; ABD CC6、探究:如何鉴别氯化钠溶液和碳酸钠溶液?Na2CO3+2HCl==
2NaCl+H2O+CO2↑Na2CO3+Ca(OH)2==
CaCO3↓+2NaOH酚酞试液
显红色的为碳酸钠溶液,显无色的为氯化钠溶液pH试纸pH>7 ,碳酸钠溶液
pH=7,氯化钠溶液稀盐酸有大量气泡产生的是碳酸钠溶液
无明显现象的为氯化钠溶液氢氧化钙
溶液有白色沉淀产生的是碳酸钠溶液
无明显现象的为氯化钠溶液7、为了探究皮蛋中的化学知识,同学们找来一包
皮蛋加工配料,经过查找资料得知皮蛋加工配料的主要成分是氧化
钙、纯碱和食盐。为了验证皮蛋加工配料的主要成分,他们进行了
如下实验:
(1)、取少量配料于小烧杯中,并向其中加入适量的水,搅拌、静
置、过滤。过滤后得到的白色固体为 它们在水中发生反
应的化学方程式为 、
。
滤液中一定存在溶质是 (2)、如果反应物没有恰好完全反应,滤液中还可能存在的溶质
是:_______________________________
_________________________________
CaCO3CaO+H2O==Ca(OH)2Ca(OH)2+Na2CO3==CaCO3 ↓ +2NaOHNaOH、NaCl①滤液中若有Na2CO3,则没有Ca(OH)2②滤液中若没有Na2CO3,则有Ca(OH)2(3)、为了进一步确定滤液中可能存在的物质,他们设计
了如下实验,请你帮助他们完善:实验步骤取一支试管,倒入少量
滤液,往其中滴加稀盐
酸实验现象若有气泡产生若无气泡产生实验结论①滤液中有
Na2CO3,没
有Ca(OH)2②滤液中没
有Na2CO3,
有Ca(OH)2你认为是否仍需进行实验? (填“是”或
“否”),理由是 。滤液中可能存在的物质已确定否7.(8分)有一包白色粉末,其中含有CuSO4、BaCl2、NaOH、Na2CO3中的一种或几种。某化学小组为确定白色粉末的成分,进行了如下实验:
(Ⅰ)取一定量的白色粉末,加入足量水,振荡,得到无色透明溶液;
(Ⅱ)取少量(Ⅰ)的溶液,加入足量盐酸,有气泡产生。(提示:Na2CO3的水溶液呈碱性)
(1)该白色粉末中肯定含有什么物质?____,可能含有什么物质?____。专题四:物质的推断 (2)为确定可能含有的物质是否存在,还需要做什么实验?请写出简要的实验步骤。__________________________________________________________。3、专题训练专题四:物质的推断3、专题训练专题八:综合计算型试题3、专题训练专题八:综合计算型试题3、专题训练专题八:综合计算型试题3、专题训练基本反应类型比较:产生白色沉淀含有Cl-的溶液能与硝酸银溶液反
应产生不溶于稀硝酸的白色沉淀,
以此鉴别Cl-(Cl-+Ag+=AgCl↓) NaCl +AgNO3=AgCl↓+NaNO3向盛有少量NaCl溶液的试管中
滴入硝酸银溶液,观察现象。产生白色沉淀含有SO42—的溶液能与BaCl2溶液反
应产生不溶于稀硝酸的白色沉淀,以
此鉴别SO42— (Ba2++SO42-==BaSO4↓)向盛有少量BaCl2溶液的试管中
滴入硫酸钠溶液,观察现象。 BaCl2 +Na2SO4=BaSO4↓+2NaCl石灰石和石灰岩地区的溶洞溶洞的形成
石灰岩的主要成分是碳酸钙。碳酸钙遇到溶有二氧化碳的水时,会慢慢变成可溶于水的碳酸氢钙Ca(HCO3)2]
CaCO3+H2O+CO2=Ca(HCO3)2
当受热或压强突然变小时,水中碳酸氢钙会分解,重新变成碳酸钙沉积下来。
Ca(HCO3)2=CaCO3↓+CO2↑+H2O
在自然界里不断发生上述反应,石灰岩逐渐变成碳酸氢钙而溶解掉,形成溶洞;碳酸氢钙不断分解,生成的碳酸钙逐渐沉积,形成千姿百态的钟乳石、石笋和石柱。
同课章节目录
