人教版化学高一必修一4.3.1硫及其化合物 课件(34张PPT)
文档属性
| 名称 | 人教版化学高一必修一4.3.1硫及其化合物 课件(34张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-29 00:00:00 | ||
图片预览











文档简介
(共34张PPT)
人教版必修一 第四章 非金属元素
第三部分 硫元素
When burned, sulfur melts to a blood-red liquid and emits a blue flame that is best observed in the dark.
A sulfur dioxide plume from the?Halema?uma?u vent, glows at night
/HAH-lay-MAH-oo-MAH-oo/夏威夷火山公园
哈雷马乌马乌火山
硫元素价类二维图
1
硫元素价类二维图
1
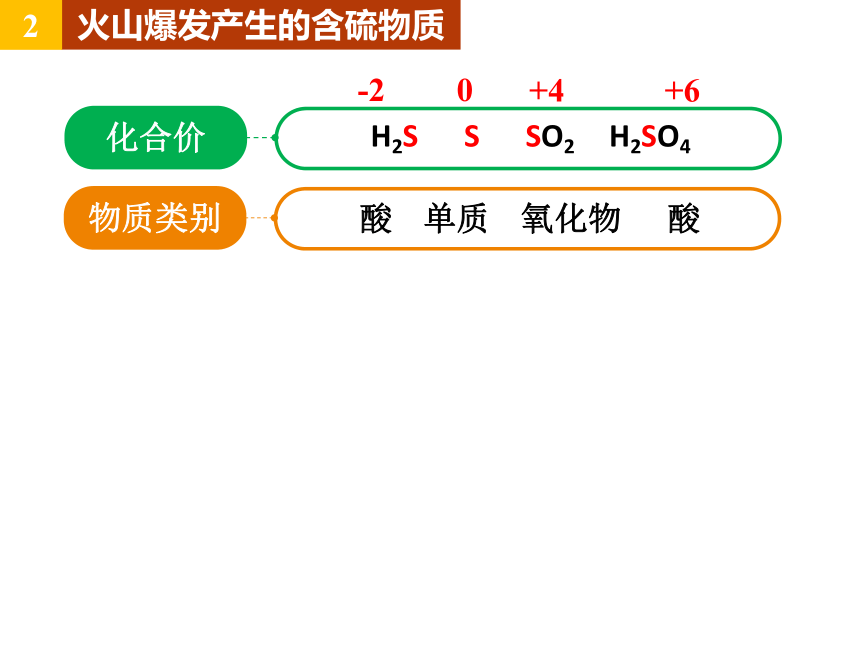
火山爆发产生的含硫物质
2
化合价
H2S S SO2 H2SO4
物质类别
酸 单质 氧化物 酸
-2
0
+4
+6
单质硫存在于火山口附近或地壳的岩石
硫元素的存在形式
3
游离态
化合态
硫酸盐
硫铁矿FeS2
黄铜矿CuFeS2
石膏CaSO4.2H2O
芒硝Na2SO4.10H2O
火山喷出物中
固态硫化物
H2S、SO2、SO3
Pyrite
硫铁矿
Chalcopyrite
黄铜矿
Gypsum
石膏
蛋白质
淡黄色晶体
质脆,容易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳。
密度比水大(约为2 g/cm3 )
熔沸点低(112.8℃, 444.6 ℃)
俗称:硫磺
4.1物理性质
硫的性质
4
4.2化学性质
氧化性(弱) 还原性
S + H2 = H2S
0
-2
△
S+Fe FeS
△
△
S + 2Cu Cu2S
S + O2 = SO2
0
+4
点燃
S+Hg HgS温度计
空气中燃烧火焰淡蓝色、氧气中燃烧火焰蓝紫色
溶于NaOH:3S+6NaOH=2Na2S+Na2SO3+3H2O
空气质量指数
Air quality index
Some of these are the?Air Quality Health Index (Canada),
the?Air Pollution Index?(Malaysia), and the?Pollutant Standards Index?(Singapore).
Mainland China
As of January 1, 2013, MEP monitors daily pollution level in 163 of its major cities. The AQI level is based on the level of six atmospheric pollutants, namely?sulfur dioxide?(SO2),?
nitrogen dioxide?(NO2),
suspended particulates smaller than 10 μm in?aerodynamic diameter?(PM10)[16], suspended particulates smaller than 2.5 μm in?aerodynamic diameter?(PM2.5)[16],carbon monoxide?(CO), and?ozone?(O3) measured at the monitoring stations throughout each city.
参与空气质量评价的主要污染物为细颗粒物、可吸入颗粒物、二氧化硫、二氧化氮、臭氧、一氧化碳等六项。-百度百科
https://en.wikipedia.org/wiki/Air_quality_index
空气质量指数
Air quality index
2019.7.30
9:00
广州
http://aqicn.org/city/guangzhou/
SO2
无色气体、易液化(-10 ℃ )
比空气大
有毒
5.1物理性质:
颜色、状态:
气味:
密度:
毒性:
刺激性气味
易溶于水(常温常压下 1 : 40 )
溶解性:
SO2二氧化硫的性质
5
CO2 SO2
酸性氧化物 1与水反应 CO2+H2O?H2CO3
2与CaO反应 CO2+CaO=CaCO3
3澄清石灰水
(或氢氧化钡) Ca(OH)2+CO2=
CaCO3↓+H2O
4与盐反应 CaCO3+H2O+CO2= Ca(HCO3)2
漂白性 5品红 X
还原性 6酸性高锰酸钾溶液 X
7氯水/溴水/碘水 X
8被氧气氧化 X
氧化性 9碳/硫化氢 CO2+C 2CO
5.2化学性质:
SO2二氧化硫的性质
5
CO2 SO2
酸性氧化物 1与水反应 CO2+H2O?H2CO3 水溶性 紫色石蕊变红
2与CaO反应 CO2+CaO=CaCO3
3澄清石灰水
(或氢氧化钡) Ca(OH)2+CO2=
CaCO3↓+H2O
4与盐反应 CaCO3+H2O+CO2= Ca(HCO3)2
漂白性 5品红 X
还原性 6酸性高锰酸钾溶液 X
7氯水/溴水/碘水 X
8被氧气氧化 X
氧化性 9碳/硫化氢 CO2+C 2CO
褪色,加热后恢复红色
褪色
褪色
氢氧化钡变浑浊
亚硫酸钡溶于盐酸
黄色沉淀
5.2化学性质:
SO2二氧化硫的性质
5
Ba(OH)2+SO2=BaSO3↓+H2O
SO2+CaO=CaSO3
SO2+H2O?H2SO3
Ca(OH)2+SO2=CaSO3↓+H2O
CaSO3+H2O+SO2= Ca(HSO3)2
2SO2+ O2 2SO3
催化剂
二氧化硫使品红褪色的原因
探讨1:如何鉴别SO2和CO2气体?
5.2化学性质:
SO2二氧化硫的性质
5
探讨2:如何除去CO2中的SO2?
试剂 SO2 CO2
品红
H2S
酸性KMnO4溶液
碘水、氯水、溴水
FeCl3溶液
澄清石灰水
探讨1:如何鉴别SO2和CO2气体?
5.2化学性质:
SO2二氧化硫的性质
5
探讨2:如何除去CO2中的SO2?
试剂 SO2 CO2
品红
H2S
酸性KMnO4溶液
碘水、氯水、溴水
FeCl3溶液
澄清石灰水
褪色
褪色
褪色
黄色沉淀
浅黄-浅绿
出现白色沉淀、后变澄清
SO2+NaHCO3=NaHSO3+CO2
探讨3:如何检验SO2和CO2?
5.2化学性质:
SO2二氧化硫的性质
5
将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:______________________;
猜想2:______________________;
猜想3:______________________。
为了验证猜想,该小组设计实验加以探究。
A B C D
试剂
现象
结论
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
探讨3:如何检验SO2和CO2?
5.2化学性质:
SO2二氧化硫的性质
5
将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:______________________;
猜想2:______________________;
猜想3:______________________。
为了验证猜想,该小组设计实验加以探究。
气体是SO2
气体是CO2
气体是SO2和CO2的混合物
A B C D
试剂
现象
结论
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
探讨4:过量与不足反应方程式书写
5.2化学性质:
SO2二氧化硫的性质
5
1.SO2通入澄清石灰水,先变浑浊,后变澄清。
2.SO2通入NaOH溶液中,少量,过量,方程式?
少量Ca(OH)2+SO2=CaSO3↓+H2O
过量CaSO3+H2O+SO2=Ca(HSO3)2
过量总反应Ca(OH)2+2SO2=Ca(HSO3)2
3.SO2通入Na2CO3溶液中,少量,过量,方程式?
少量SO2+2NaOH=Na2SO3+H2O
过量总反应SO2+NaOH=NaHSO3
2SO2+H2O+Na2CO3=2NaHSO3+CO2
SO2+H2O+Na2CO3=NaHCO3+NaHSO3
SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3
SO2很少
SO2不太多
SO2很多
探讨5:常见漂白剂的漂白原理
类型 漂白原理 漂白特点 变化类型 实例
氧化 氧化 永久 化学变化 氯水,过氧化钠,过氧化氢
化合 化合 暂时 化学变化 SO2
吸附 吸附 - 物理变化 活性炭
5.2化学性质:
SO2二氧化硫的性质
5
⑷漂白纸浆、毛、丝、草编制品等。
⑶杀灭细菌。
⑵作食物和干果的防腐剂。
⑴制造硫酸。
还原性
还原性
漂白性
氧化性
SO2二氧化硫的用途
6
性质决定用途
杀菌抗氧化
漂白衣物食品
工业原料
7.1物理性质
(1)与水的反应
熔点为16.8℃,沸点为44.8℃,常温下是液体。
SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
7.2化学性质:酸性氧化物的通性
(2)与碱性氧化物的反应
(3)与碱的反应
SO3三氧化硫的性质
7
8.1物理性质
氢硫酸是一种二元弱酸,具有酸的通性。
8.2化学性质
(1)弱酸性:
无色、有臭鸡蛋气味的有毒气体,溶于水即得氢硫酸。
H2S+2NaOH=Na2S+2H2O
①SO2通入氢硫酸H2S中
(2)还原性
②H2S通入FeCl3溶液
2FeCl3+ H2S=2FeCl2+S↓+2HCl
SO2 + 2H2S =3S↓+ 2H2O
2H2S +3 O2 =2SO2+ 2H2O
H2S硫化氢的性质
8
③H2S被O2氧化
2H2S + O2 =2S+ 2H2O
SO2对大气的污染
9
This shows the process of the air pollution being released into the atmosphere and the areas that will be affected.
9.1 SO2污染物的形成 书p93
1煤、石油、金属矿物质的燃烧和冶炼产生SO2
2酸雨:pH小于5.6的降水
SO2对大气的污染
9
2.1危害人体健康
2.2酸雨破坏农作物、森林,土壤酸化,腐蚀建筑等
硫酸酸雨
SO2 + H2O
H2SO3
2SO2 + O2 2SO3
催化剂
△
2H2SO3 + O2 = 2H2SO4
催化剂
SO3 + H2O=H2SO4
方式一
方式二
防治酸雨的措施 书p94
①、调整、发展、优化、提高,减少污染物
②、严格控制污染物的排放量
③、研究开发新技术
9.2 保护环境 整治污染
SO2对大气的污染
9
Acid clouds can grow on SO2?emissions from refineries, as seen here in?Cura?ao.
This chart shows that not all fish, shellfish, or the insects that they eat can tolerate the same amount of acid; for example, frogs can tolerate water that is more acidic (i.e., has a lower pH) than trout.
Cura?ao?(/?kj??r?so?/;)
H2SO4
10
10.1稀释浓硫酸的正确做法?
10.2稀硫酸的性质
酸的通性 H2SO4 = 2H+ + SO42-
1.可以使紫色石蕊试液 变红
2.与碱反应: H+ + OH- = H2O
3.与金属反应: 2H+ + Fe = Fe2+ + H2↑
4.与金属氧化物: 2H+ + CuO = Cu2+ + H2O
5.与某些盐反应: 2H+ + CO32- = CO2 ↑ + H2O
H2SO4
10
10.3 浓硫酸和稀硫酸的区别
H2SO4
10
10.4 浓硫酸的性质
10.4.1 浓硫酸的物理性质
无色、黏稠油状液体,难挥发,
w=98%,c=18.4mol/L,ρ=1.84g/mL
Comparison of sulfuric acid and water
Physical property H2SO4 Water Units
Density 1.84 1.0 kg/L
Volumetric heat capacity 2.54 4.18 kJ/L
Boiling point 337 100 °C
H2SO4
10
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
①吸水性:浓硫酸可以吸收物质中游离的水(包括结晶水),具有强烈的吸水性,可用作干燥剂。
A中性气体 B酸性气体 C碱性气体 D还原性气体
H2、O2、N2、CO、CH4 CO2、SO2、HCl、Cl2
NH3 H2S、HI
可以干燥非还原性的中性或酸性气体:
不能干燥碱性气体或还原性气体。
H2SO4
10
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
②脱水性
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体。
C12H22O11 ==== 12C + 11H2O
浓硫酸
将有机物中的H、O两种元素按水的组成比脱去。
黑面包实验
H2SO4
10
10.4 浓硫酸的性质
2H2SO4 (浓) + C = CO2↑ + 2H2O +2SO2↑
△
③强氧化性
1氧化非金属单质
10.4.2 浓硫酸的特性
请设计实验证明实验中产生的各种物质?
Zn Cu
稀硫酸
浓硫酸
H2SO4
10
③强氧化性
2氧化金属单质
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
Zn+H2SO4=ZnSO4+H2↑
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
不反应
Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O
△
浓硫酸表现
强氧化性
酸性
H2SO4
10
③强氧化性
2氧化金属单质
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
硫酸车槽
在常温下,浓硫酸可将铝、铁表面氧化成一层致密的氧化膜而使铝、铁等金属钝化。因此常温下可用Fe、Al制容器来盛装浓硫酸。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
脱水性
吸水性
强酸性
酸性和强氧化性
难挥发性
强氧化性
强酸性
H2SO4
10
10.4 浓硫酸的性质
下列现象反映了硫酸的哪些主要性质
H2SO4
10
10.4 硫酸的用途
人教版必修一 第四章 非金属元素
第三部分 硫元素
When burned, sulfur melts to a blood-red liquid and emits a blue flame that is best observed in the dark.
A sulfur dioxide plume from the?Halema?uma?u vent, glows at night
/HAH-lay-MAH-oo-MAH-oo/夏威夷火山公园
哈雷马乌马乌火山
硫元素价类二维图
1
硫元素价类二维图
1
火山爆发产生的含硫物质
2
化合价
H2S S SO2 H2SO4
物质类别
酸 单质 氧化物 酸
-2
0
+4
+6
单质硫存在于火山口附近或地壳的岩石
硫元素的存在形式
3
游离态
化合态
硫酸盐
硫铁矿FeS2
黄铜矿CuFeS2
石膏CaSO4.2H2O
芒硝Na2SO4.10H2O
火山喷出物中
固态硫化物
H2S、SO2、SO3
Pyrite
硫铁矿
Chalcopyrite
黄铜矿
Gypsum
石膏
蛋白质
淡黄色晶体
质脆,容易研成粉末。
不溶于水,微溶于酒精,易溶于二硫化碳。
密度比水大(约为2 g/cm3 )
熔沸点低(112.8℃, 444.6 ℃)
俗称:硫磺
4.1物理性质
硫的性质
4
4.2化学性质
氧化性(弱) 还原性
S + H2 = H2S
0
-2
△
S+Fe FeS
△
△
S + 2Cu Cu2S
S + O2 = SO2
0
+4
点燃
S+Hg HgS温度计
空气中燃烧火焰淡蓝色、氧气中燃烧火焰蓝紫色
溶于NaOH:3S+6NaOH=2Na2S+Na2SO3+3H2O
空气质量指数
Air quality index
Some of these are the?Air Quality Health Index (Canada),
the?Air Pollution Index?(Malaysia), and the?Pollutant Standards Index?(Singapore).
Mainland China
As of January 1, 2013, MEP monitors daily pollution level in 163 of its major cities. The AQI level is based on the level of six atmospheric pollutants, namely?sulfur dioxide?(SO2),?
nitrogen dioxide?(NO2),
suspended particulates smaller than 10 μm in?aerodynamic diameter?(PM10)[16], suspended particulates smaller than 2.5 μm in?aerodynamic diameter?(PM2.5)[16],carbon monoxide?(CO), and?ozone?(O3) measured at the monitoring stations throughout each city.
参与空气质量评价的主要污染物为细颗粒物、可吸入颗粒物、二氧化硫、二氧化氮、臭氧、一氧化碳等六项。-百度百科
https://en.wikipedia.org/wiki/Air_quality_index
空气质量指数
Air quality index
2019.7.30
9:00
广州
http://aqicn.org/city/guangzhou/
SO2
无色气体、易液化(-10 ℃ )
比空气大
有毒
5.1物理性质:
颜色、状态:
气味:
密度:
毒性:
刺激性气味
易溶于水(常温常压下 1 : 40 )
溶解性:
SO2二氧化硫的性质
5
CO2 SO2
酸性氧化物 1与水反应 CO2+H2O?H2CO3
2与CaO反应 CO2+CaO=CaCO3
3澄清石灰水
(或氢氧化钡) Ca(OH)2+CO2=
CaCO3↓+H2O
4与盐反应 CaCO3+H2O+CO2= Ca(HCO3)2
漂白性 5品红 X
还原性 6酸性高锰酸钾溶液 X
7氯水/溴水/碘水 X
8被氧气氧化 X
氧化性 9碳/硫化氢 CO2+C 2CO
5.2化学性质:
SO2二氧化硫的性质
5
CO2 SO2
酸性氧化物 1与水反应 CO2+H2O?H2CO3 水溶性 紫色石蕊变红
2与CaO反应 CO2+CaO=CaCO3
3澄清石灰水
(或氢氧化钡) Ca(OH)2+CO2=
CaCO3↓+H2O
4与盐反应 CaCO3+H2O+CO2= Ca(HCO3)2
漂白性 5品红 X
还原性 6酸性高锰酸钾溶液 X
7氯水/溴水/碘水 X
8被氧气氧化 X
氧化性 9碳/硫化氢 CO2+C 2CO
褪色,加热后恢复红色
褪色
褪色
氢氧化钡变浑浊
亚硫酸钡溶于盐酸
黄色沉淀
5.2化学性质:
SO2二氧化硫的性质
5
Ba(OH)2+SO2=BaSO3↓+H2O
SO2+CaO=CaSO3
SO2+H2O?H2SO3
Ca(OH)2+SO2=CaSO3↓+H2O
CaSO3+H2O+SO2= Ca(HSO3)2
2SO2+ O2 2SO3
催化剂
二氧化硫使品红褪色的原因
探讨1:如何鉴别SO2和CO2气体?
5.2化学性质:
SO2二氧化硫的性质
5
探讨2:如何除去CO2中的SO2?
试剂 SO2 CO2
品红
H2S
酸性KMnO4溶液
碘水、氯水、溴水
FeCl3溶液
澄清石灰水
探讨1:如何鉴别SO2和CO2气体?
5.2化学性质:
SO2二氧化硫的性质
5
探讨2:如何除去CO2中的SO2?
试剂 SO2 CO2
品红
H2S
酸性KMnO4溶液
碘水、氯水、溴水
FeCl3溶液
澄清石灰水
褪色
褪色
褪色
黄色沉淀
浅黄-浅绿
出现白色沉淀、后变澄清
SO2+NaHCO3=NaHSO3+CO2
探讨3:如何检验SO2和CO2?
5.2化学性质:
SO2二氧化硫的性质
5
将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:______________________;
猜想2:______________________;
猜想3:______________________。
为了验证猜想,该小组设计实验加以探究。
A B C D
试剂
现象
结论
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
探讨3:如何检验SO2和CO2?
5.2化学性质:
SO2二氧化硫的性质
5
将气体通入澄清石灰水,发现澄清石灰水变浑浊,持续通入发现浑浊又变澄清,由此该小组成员对气体的成分提出猜想。
(提出猜想)
猜想1:______________________;
猜想2:______________________;
猜想3:______________________。
为了验证猜想,该小组设计实验加以探究。
气体是SO2
气体是CO2
气体是SO2和CO2的混合物
A B C D
试剂
现象
结论
品红溶液
酸性KMnO4溶液
品红溶液
澄清石灰水
探讨4:过量与不足反应方程式书写
5.2化学性质:
SO2二氧化硫的性质
5
1.SO2通入澄清石灰水,先变浑浊,后变澄清。
2.SO2通入NaOH溶液中,少量,过量,方程式?
少量Ca(OH)2+SO2=CaSO3↓+H2O
过量CaSO3+H2O+SO2=Ca(HSO3)2
过量总反应Ca(OH)2+2SO2=Ca(HSO3)2
3.SO2通入Na2CO3溶液中,少量,过量,方程式?
少量SO2+2NaOH=Na2SO3+H2O
过量总反应SO2+NaOH=NaHSO3
2SO2+H2O+Na2CO3=2NaHSO3+CO2
SO2+H2O+Na2CO3=NaHCO3+NaHSO3
SO2+H2O+2Na2CO3=Na2SO3+2NaHCO3
SO2很少
SO2不太多
SO2很多
探讨5:常见漂白剂的漂白原理
类型 漂白原理 漂白特点 变化类型 实例
氧化 氧化 永久 化学变化 氯水,过氧化钠,过氧化氢
化合 化合 暂时 化学变化 SO2
吸附 吸附 - 物理变化 活性炭
5.2化学性质:
SO2二氧化硫的性质
5
⑷漂白纸浆、毛、丝、草编制品等。
⑶杀灭细菌。
⑵作食物和干果的防腐剂。
⑴制造硫酸。
还原性
还原性
漂白性
氧化性
SO2二氧化硫的用途
6
性质决定用途
杀菌抗氧化
漂白衣物食品
工业原料
7.1物理性质
(1)与水的反应
熔点为16.8℃,沸点为44.8℃,常温下是液体。
SO3+H2O=H2SO4(放出大量热)
SO3+CaO=CaSO4
SO3+Ca(OH)2=CaSO4+H2O
7.2化学性质:酸性氧化物的通性
(2)与碱性氧化物的反应
(3)与碱的反应
SO3三氧化硫的性质
7
8.1物理性质
氢硫酸是一种二元弱酸,具有酸的通性。
8.2化学性质
(1)弱酸性:
无色、有臭鸡蛋气味的有毒气体,溶于水即得氢硫酸。
H2S+2NaOH=Na2S+2H2O
①SO2通入氢硫酸H2S中
(2)还原性
②H2S通入FeCl3溶液
2FeCl3+ H2S=2FeCl2+S↓+2HCl
SO2 + 2H2S =3S↓+ 2H2O
2H2S +3 O2 =2SO2+ 2H2O
H2S硫化氢的性质
8
③H2S被O2氧化
2H2S + O2 =2S+ 2H2O
SO2对大气的污染
9
This shows the process of the air pollution being released into the atmosphere and the areas that will be affected.
9.1 SO2污染物的形成 书p93
1煤、石油、金属矿物质的燃烧和冶炼产生SO2
2酸雨:pH小于5.6的降水
SO2对大气的污染
9
2.1危害人体健康
2.2酸雨破坏农作物、森林,土壤酸化,腐蚀建筑等
硫酸酸雨
SO2 + H2O
H2SO3
2SO2 + O2 2SO3
催化剂
△
2H2SO3 + O2 = 2H2SO4
催化剂
SO3 + H2O=H2SO4
方式一
方式二
防治酸雨的措施 书p94
①、调整、发展、优化、提高,减少污染物
②、严格控制污染物的排放量
③、研究开发新技术
9.2 保护环境 整治污染
SO2对大气的污染
9
Acid clouds can grow on SO2?emissions from refineries, as seen here in?Cura?ao.
This chart shows that not all fish, shellfish, or the insects that they eat can tolerate the same amount of acid; for example, frogs can tolerate water that is more acidic (i.e., has a lower pH) than trout.
Cura?ao?(/?kj??r?so?/;)
H2SO4
10
10.1稀释浓硫酸的正确做法?
10.2稀硫酸的性质
酸的通性 H2SO4 = 2H+ + SO42-
1.可以使紫色石蕊试液 变红
2.与碱反应: H+ + OH- = H2O
3.与金属反应: 2H+ + Fe = Fe2+ + H2↑
4.与金属氧化物: 2H+ + CuO = Cu2+ + H2O
5.与某些盐反应: 2H+ + CO32- = CO2 ↑ + H2O
H2SO4
10
10.3 浓硫酸和稀硫酸的区别
H2SO4
10
10.4 浓硫酸的性质
10.4.1 浓硫酸的物理性质
无色、黏稠油状液体,难挥发,
w=98%,c=18.4mol/L,ρ=1.84g/mL
Comparison of sulfuric acid and water
Physical property H2SO4 Water Units
Density 1.84 1.0 kg/L
Volumetric heat capacity 2.54 4.18 kJ/L
Boiling point 337 100 °C
H2SO4
10
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
①吸水性:浓硫酸可以吸收物质中游离的水(包括结晶水),具有强烈的吸水性,可用作干燥剂。
A中性气体 B酸性气体 C碱性气体 D还原性气体
H2、O2、N2、CO、CH4 CO2、SO2、HCl、Cl2
NH3 H2S、HI
可以干燥非还原性的中性或酸性气体:
不能干燥碱性气体或还原性气体。
H2SO4
10
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
②脱水性
蔗糖变黑,体积膨胀,变成疏松多孔的海绵状的炭,并放出有刺激性气味的气体。
C12H22O11 ==== 12C + 11H2O
浓硫酸
将有机物中的H、O两种元素按水的组成比脱去。
黑面包实验
H2SO4
10
10.4 浓硫酸的性质
2H2SO4 (浓) + C = CO2↑ + 2H2O +2SO2↑
△
③强氧化性
1氧化非金属单质
10.4.2 浓硫酸的特性
请设计实验证明实验中产生的各种物质?
Zn Cu
稀硫酸
浓硫酸
H2SO4
10
③强氧化性
2氧化金属单质
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
Zn+H2SO4=ZnSO4+H2↑
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
不反应
Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O
△
浓硫酸表现
强氧化性
酸性
H2SO4
10
③强氧化性
2氧化金属单质
10.4 浓硫酸的性质
10.4.2 浓硫酸的特性
硫酸车槽
在常温下,浓硫酸可将铝、铁表面氧化成一层致密的氧化膜而使铝、铁等金属钝化。因此常温下可用Fe、Al制容器来盛装浓硫酸。
如浓HNO3、浓H2SO4、HClO3、K2Cr2O7、KMnO4等氧化剂都可使金属钝化。
(1)浓硫酸滴在木条上,过一会儿,木条变黑。
(2)敞口放置浓硫酸时,质量增加。
(3)锌粒投入稀硫酸中,有气泡产生。
(4)把铜片放入浓硫酸里加热,有气体产生。
(5)利用浓硫酸和食盐固体反应可制HCl气体。
(6)浓硫酸不能用来干燥硫化氢气体。
(7)利用硫化亚铁跟稀硫酸反应可制H2S气体。
脱水性
吸水性
强酸性
酸性和强氧化性
难挥发性
强氧化性
强酸性
H2SO4
10
10.4 浓硫酸的性质
下列现象反映了硫酸的哪些主要性质
H2SO4
10
10.4 硫酸的用途
