人教版化学第八单元课题2金属的化学性质(共28张PPT)
文档属性
| 名称 | 人教版化学第八单元课题2金属的化学性质(共28张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-31 17:38:06 | ||
图片预览




文档简介
(共28张PPT)
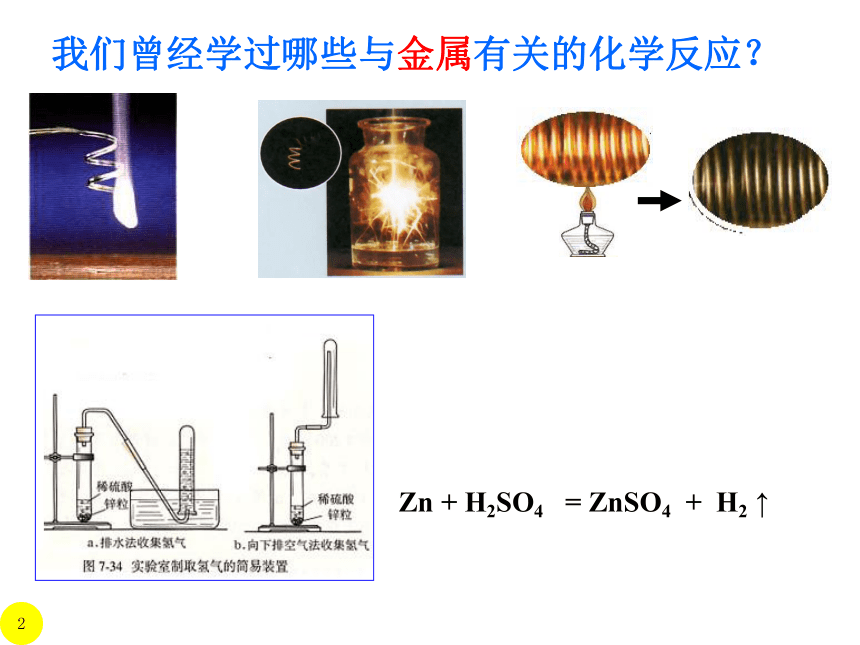
我们曾经学过哪些与金属有关的化学反应?
*
金属与氧气反应的剧烈程度
火星四射,放热,生成黑色固体
耀眼的白光,放热,生成白色固体
由红色变为黑色
不同
*
镁在空气中燃烧
铁丝在氧气中燃烧
铜在酒精灯上加热
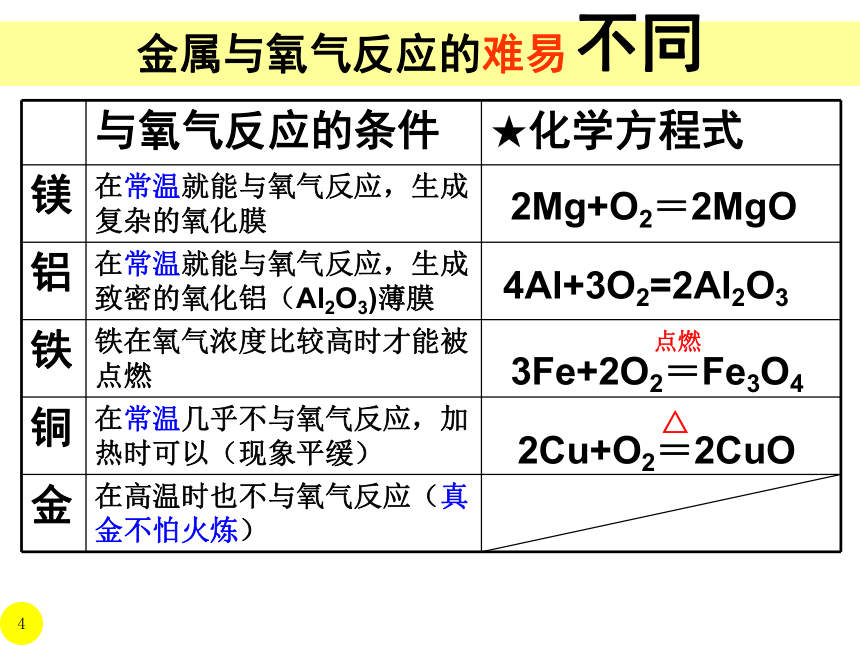
金属与氧气反应的难易
2Mg+O2=2MgO
4Al+3O2=2Al2O3
不同
*
与氧气反应的条件 ★化学方程式
镁 在常温就能与氧气反应,生成复杂的氧化膜
铝 在常温就能与氧气反应,生成致密的氧化铝(Al2O3)薄膜
铁 铁在氧气浓度比较高时才能被点燃
铜 在常温几乎不与氧气反应,加热时可以(现象平缓)
金 在高温时也不与氧气反应(真金不怕火炼)
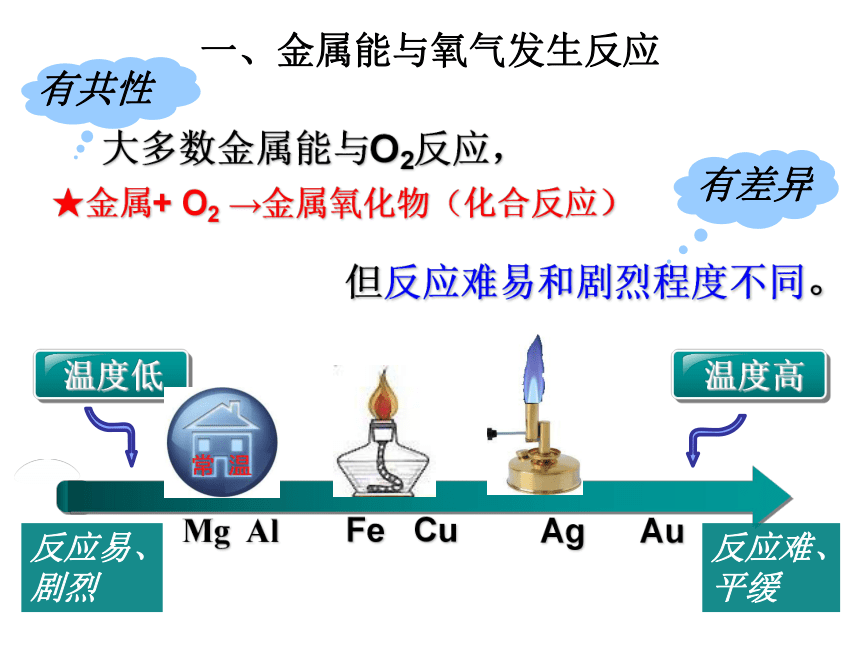
一、金属能与氧气发生反应
反应易、
剧烈
反应难、
平缓
大多数金属能与O2反应,
★金属+ O2 →金属氧化物(化合反应)
但反应难易和剧烈程度不同。
Mg Al Fe Cu Ag Au
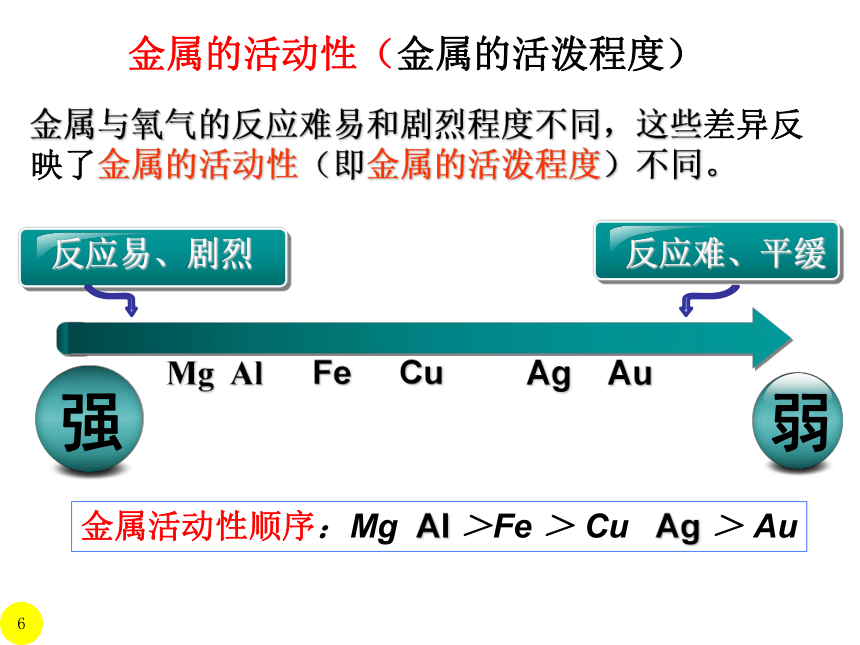
金属与氧气的反应难易和剧烈程度不同,这些差异反映了金属的活动性(即金属的活泼程度)不同。
金属的活动性(金属的活泼程度)
金属活动性顺序:Mg Al >Fe > Cu Ag > Au
Mg Al Fe Cu Ag Au
*
思 考:
1.为什么铝具有优良的抗腐蚀性能?
2.分析“真金不怕火炼”蕴含的化学原理。
4Al+3O2==2Al2O3
铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。
结 论:
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断:越容易反应,反应现象越剧烈,说明金属活动性越强。
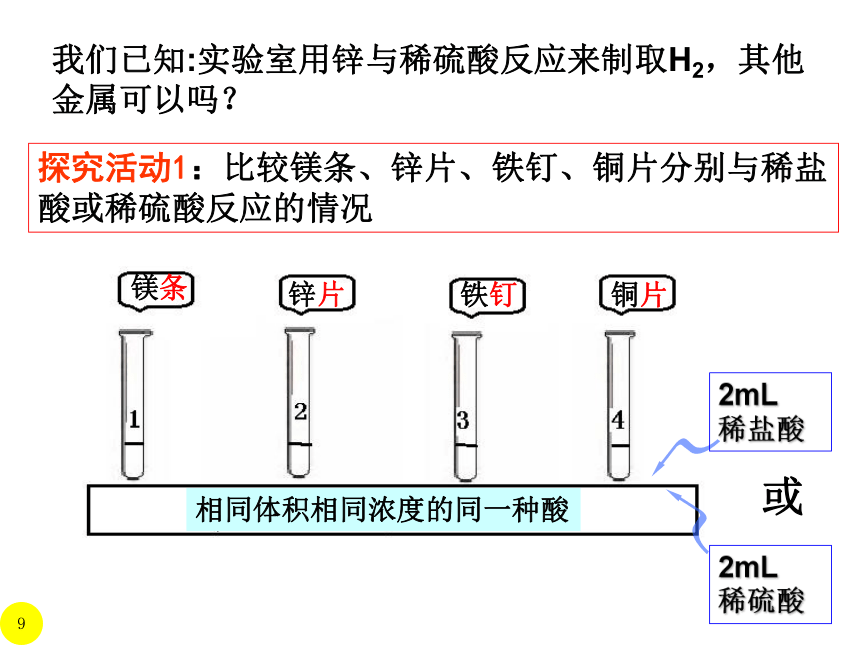
我们已知:实验室用锌与稀硫酸反应来制取H2,其他金属可以吗?
探究活动1:比较镁条、锌片、铁钉、铜片分别与稀盐酸或稀硫酸反应的情况
铜片
铁钉
镁条
锌片
相同体积相同浓度的同一种酸
*
实验现象分析,在课本表格中填写
2mL稀盐酸
*
讨论:观察此图,你有何看法?
探究活动1:金属与稀盐酸的反应
产生大量气泡,反应最快
产生许多气泡,反应快
产生少量气泡,反应较慢,溶液由无色变为浅绿色
无明显现象
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
金属与稀盐酸 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
金属与稀盐酸、稀硫酸的反应
1、大多数金属可以和酸发生反应;
2、能和酸反应的金属,其反应的剧烈程度不同。
Mg+H2SO4= MgSO4 +H2↑
Fe + H2SO4 = FeSO4+ H2↑
3、反应类型:置换反应
金属+ 酸 → 金属化合物 + H2 ↑
*
Zn+H2SO4==ZnSO4+H2↑
与盐酸反应
的化学方程式 与硫酸反应
的化学方程式
镁 Mg+2HCl= MgCl2 + H2↑
锌 Zn+2HCl==ZnCl2+H2↑
铁 Fe+2HCl = FeCl2+ H2 ↑
铜
结
论
上述反应的共同特征
1、反应物和产物都只有两种;
2、反应物是单质和化合物,产物也是单质和化合物;
结论:
置换反应:
特点:单质+化合物 → 单质+化合物
A + BC → AC + B
金属与酸的反应也是有共性和有差异!
金属活动性顺序:Mg> Zn > Fe > Cu
*
二、金属能与稀酸发生反应
结论 :
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断。
2、根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断:能与稀酸反应,并且反应越剧烈,说明金属的活动性越强。
你能否得出金属和化合物溶液反应的一般规律呢?
现象:_________________________________________________
________________________________________________________
将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
活动性:Fe﹥Cu
探究活动2:金属与金属化合物溶液的反应
铝丝上附着红色固体,溶液的蓝色变浅。
铜丝上附着银白色固体,溶液由无色慢慢变成蓝色。
无明显变化
?Cu+2AgNO3==2Ag+Cu(NO3)2
2Al+3CuSO4 == 3Cu+Al2(SO4)3
实 验 现 象 化学方程式
铝丝浸入CuSO4溶液中 ? ?
铜丝浸入AgNO3溶液中 ?
铜丝浸入Al2(SO4)3
溶液中 ? ?
三、部分金属能与金属化合物的溶液反应
1、Fe + CuSO4 == Cu + FeSO4
2、2Al+ 3CuSO4 == 3Cu + Al2(SO4)3
3、Cu + 2AgNO3 == 2Ag + Cu(NO3)2
活动性强弱:Fe >Cu
活动性强弱:Cu﹥Ag
活动性强弱:Al >Cu
结论 :
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断。
2、根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断。
3、根据金属A能否把另一种金属B从金属B的化合物的溶液中置换出来判断:若能置换出来,说明金属A的活动性比金属B强。
常见金属在溶液中的活动性顺序
★
1、金属的位置越靠前,它的活动性就越强
2、位于H前面的金属能置换出盐酸、稀硫酸中的氢
*
3、位于前面的金属能把位于后面的金属从它们化合物的溶液里置换来。
置换出
总 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀盐酸或稀H2SO4反应
(3)部分金属能与金属化合物的溶液反应
2、判断常见金属活动性强弱的方法
(1)金属与氧气反应的难易程度
(2)金属与酸反应的剧烈程度
(3)金属能否与金属化合物的溶液反应
网上搜搜问题
*
思考:银和铜的金属活动性强弱可以通过加入稀盐酸来比较吗?
可以用稀盐酸来鉴别银镯子和铝镯子。
即:铝和银的金属活动性强弱可以通过加入稀盐酸来比较。
★
★
★
*
小结:金属的化学性质
研究一类物质的方法
*
Mg + 2 HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
Mg + H2SO4 = MgSO4 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
置换反应
金属+ 酸 → 金属化合物 + H2
2、金属与稀盐酸、稀硫酸发生反应
单质 +化合物→化合物 +单质
A + BC → AC +B
BACK11
*
百度求助
BACK23
*
常温下的铜线
距今3000多年的
金面具
距今100多年的
银币
易拉罐(铝制品)
常温下镁条及打磨后
距今10多年的铁链
我们曾经学过哪些与金属有关的化学反应?
*
金属与氧气反应的剧烈程度
火星四射,放热,生成黑色固体
耀眼的白光,放热,生成白色固体
由红色变为黑色
不同
*
镁在空气中燃烧
铁丝在氧气中燃烧
铜在酒精灯上加热
金属与氧气反应的难易
2Mg+O2=2MgO
4Al+3O2=2Al2O3
不同
*
与氧气反应的条件 ★化学方程式
镁 在常温就能与氧气反应,生成复杂的氧化膜
铝 在常温就能与氧气反应,生成致密的氧化铝(Al2O3)薄膜
铁 铁在氧气浓度比较高时才能被点燃
铜 在常温几乎不与氧气反应,加热时可以(现象平缓)
金 在高温时也不与氧气反应(真金不怕火炼)
一、金属能与氧气发生反应
反应易、
剧烈
反应难、
平缓
大多数金属能与O2反应,
★金属+ O2 →金属氧化物(化合反应)
但反应难易和剧烈程度不同。
Mg Al Fe Cu Ag Au
金属与氧气的反应难易和剧烈程度不同,这些差异反映了金属的活动性(即金属的活泼程度)不同。
金属的活动性(金属的活泼程度)
金属活动性顺序:Mg Al >Fe > Cu Ag > Au
Mg Al Fe Cu Ag Au
*
思 考:
1.为什么铝具有优良的抗腐蚀性能?
2.分析“真金不怕火炼”蕴含的化学原理。
4Al+3O2==2Al2O3
铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。
结 论:
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断:越容易反应,反应现象越剧烈,说明金属活动性越强。
我们已知:实验室用锌与稀硫酸反应来制取H2,其他金属可以吗?
探究活动1:比较镁条、锌片、铁钉、铜片分别与稀盐酸或稀硫酸反应的情况
铜片
铁钉
镁条
锌片
相同体积相同浓度的同一种酸
*
实验现象分析,在课本表格中填写
2mL稀盐酸
*
讨论:观察此图,你有何看法?
探究活动1:金属与稀盐酸的反应
产生大量气泡,反应最快
产生许多气泡,反应快
产生少量气泡,反应较慢,溶液由无色变为浅绿色
无明显现象
Mg+2HCl=MgCl2+H2↑
Zn+2HCl=ZnCl2+H2↑
Fe+2HCl=FeCl2+H2↑
金属与稀盐酸 现 象 化学方程式
镁与稀盐酸
锌与稀盐酸
铁与稀盐酸
铜与稀盐酸
金属与稀盐酸、稀硫酸的反应
1、大多数金属可以和酸发生反应;
2、能和酸反应的金属,其反应的剧烈程度不同。
Mg+H2SO4= MgSO4 +H2↑
Fe + H2SO4 = FeSO4+ H2↑
3、反应类型:置换反应
金属+ 酸 → 金属化合物 + H2 ↑
*
Zn+H2SO4==ZnSO4+H2↑
与盐酸反应
的化学方程式 与硫酸反应
的化学方程式
镁 Mg+2HCl= MgCl2 + H2↑
锌 Zn+2HCl==ZnCl2+H2↑
铁 Fe+2HCl = FeCl2+ H2 ↑
铜
结
论
上述反应的共同特征
1、反应物和产物都只有两种;
2、反应物是单质和化合物,产物也是单质和化合物;
结论:
置换反应:
特点:单质+化合物 → 单质+化合物
A + BC → AC + B
金属与酸的反应也是有共性和有差异!
金属活动性顺序:Mg> Zn > Fe > Cu
*
二、金属能与稀酸发生反应
结论 :
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断。
2、根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断:能与稀酸反应,并且反应越剧烈,说明金属的活动性越强。
你能否得出金属和化合物溶液反应的一般规律呢?
现象:_________________________________________________
________________________________________________________
将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面会有红色物质析出,溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
活动性:Fe﹥Cu
探究活动2:金属与金属化合物溶液的反应
铝丝上附着红色固体,溶液的蓝色变浅。
铜丝上附着银白色固体,溶液由无色慢慢变成蓝色。
无明显变化
?Cu+2AgNO3==2Ag+Cu(NO3)2
2Al+3CuSO4 == 3Cu+Al2(SO4)3
实 验 现 象 化学方程式
铝丝浸入CuSO4溶液中 ? ?
铜丝浸入AgNO3溶液中 ?
铜丝浸入Al2(SO4)3
溶液中 ? ?
三、部分金属能与金属化合物的溶液反应
1、Fe + CuSO4 == Cu + FeSO4
2、2Al+ 3CuSO4 == 3Cu + Al2(SO4)3
3、Cu + 2AgNO3 == 2Ag + Cu(NO3)2
活动性强弱:Fe >Cu
活动性强弱:Cu﹥Ag
活动性强弱:Al >Cu
结论 :
判断金属活动性的方法:
1、根据金属与氧气反应的难易程度与反应现象的剧烈程度判断。
2、根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断。
3、根据金属A能否把另一种金属B从金属B的化合物的溶液中置换出来判断:若能置换出来,说明金属A的活动性比金属B强。
常见金属在溶液中的活动性顺序
★
1、金属的位置越靠前,它的活动性就越强
2、位于H前面的金属能置换出盐酸、稀硫酸中的氢
*
3、位于前面的金属能把位于后面的金属从它们化合物的溶液里置换来。
置换出
总 结:
1、金属的化学性质:
(1)大多数金属能与O2反应
(2)大多数金属能与稀盐酸或稀H2SO4反应
(3)部分金属能与金属化合物的溶液反应
2、判断常见金属活动性强弱的方法
(1)金属与氧气反应的难易程度
(2)金属与酸反应的剧烈程度
(3)金属能否与金属化合物的溶液反应
网上搜搜问题
*
思考:银和铜的金属活动性强弱可以通过加入稀盐酸来比较吗?
可以用稀盐酸来鉴别银镯子和铝镯子。
即:铝和银的金属活动性强弱可以通过加入稀盐酸来比较。
★
★
★
*
小结:金属的化学性质
研究一类物质的方法
*
Mg + 2 HCl = MgCl2 + H2↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑
Mg + H2SO4 = MgSO4 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + H2SO4 = FeSO4 + H2 ↑
置换反应
金属+ 酸 → 金属化合物 + H2
2、金属与稀盐酸、稀硫酸发生反应
单质 +化合物→化合物 +单质
A + BC → AC +B
BACK11
*
百度求助
BACK23
*
常温下的铜线
距今3000多年的
金面具
距今100多年的
银币
易拉罐(铝制品)
常温下镁条及打磨后
距今10多年的铁链
同课章节目录
