京改版化学九年级下册 12.2《 盐的性质》课件 (共16张PPT)
文档属性
| 名称 | 京改版化学九年级下册 12.2《 盐的性质》课件 (共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 204.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-31 00:00:00 | ||
图片预览





文档简介
课件16张PPT。盐的性质一. 盐 的 物 理 性 质: 1. 写出常见的不溶于水的盐:
(1).盐酸盐_____ ;(2).硫酸盐 _____ ;(3).碳酸盐_____. _______;
(4).碱 _______ . ________ 。
2. 写出不溶于水且不溶于稀硝酸的两种盐_____ ._____ 。
3. 写出能溶于水的碳酸盐 _______ . ________ 。
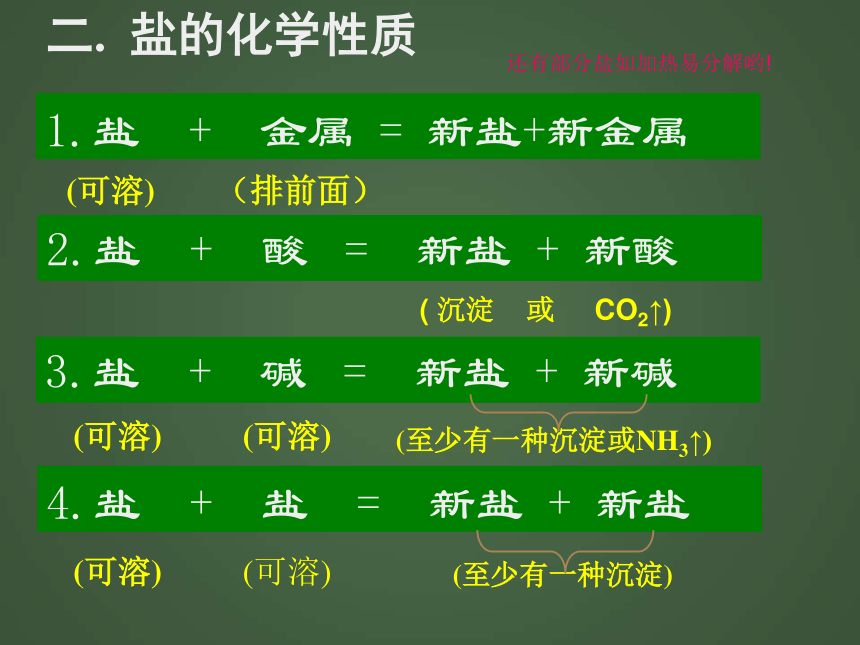
4. 写出不溶于水能溶于酸的 盐 ______ . _____ . ______ 。溶解性AgCl BaSO4BaCO3CaCO3Cu(OH)2 Mg(OH)2AgCl BaSO4 Na2CO3 K2CO3BaCO3 CaCO3 MgCO3二. 盐的化学性质
(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀或NH3↑)(至少有一种沉淀)1.盐 + 金属 = 新盐+新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐 ( 沉淀 或 CO2↑)(排前面)还有部分盐如加热易分解哟!1. CuCl2+Zn=ZnCl2+Cu2. BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3+HCl=AgCl ↓ +HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑3. CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
NH4Cl+NaOH=NaCl+NH3↑+H2O4. BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2盐的化学性质方程式: 请举一反三!三.主要应用判断金属与混合盐溶液的反应顺序
在金属活动顺序表中,排在越后边的金属越容易从它的盐溶液中被置换出来。或者说:金属活动性相差越大,置换反应越易发生。思考
金属单质失电子:
强 弱 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
Zn2+ Fe2+ H+ Cu2+ Ag+
弱 强
金属离子得电子:练习1:下列反应中,能进行的是( )
A:Cu+AgCl— Ag+CuCl2 B: Zn+AgNO3--
C: Fe+CuCl2— FeCl3+Cu D: Cu+ZnSO4—
E: Zn+Cu(OH)2-- F: Fe+CuO —
G: Na+CuSO4— Cu+ Na2SO4 H: Cu+Hg(NO3)2—
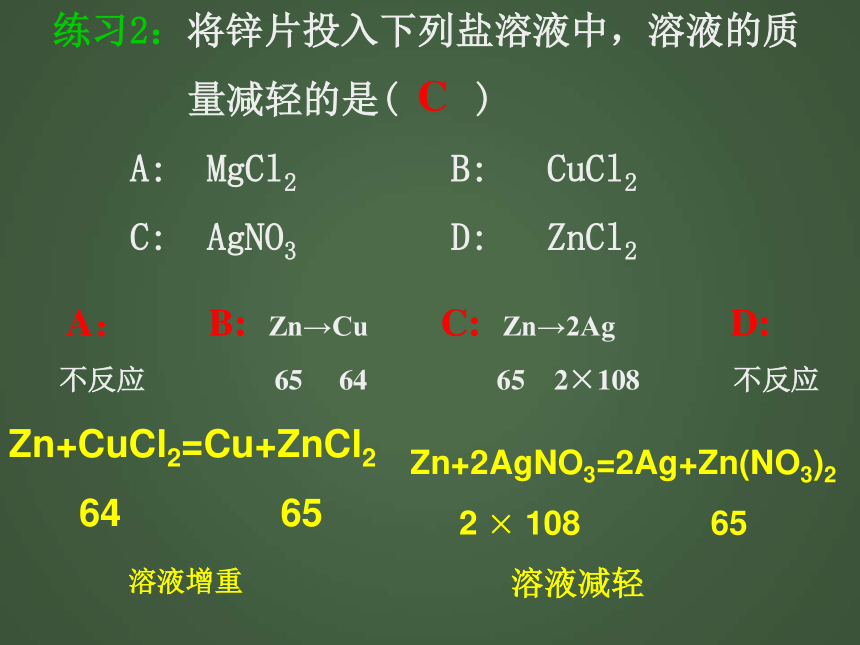
I: Mg+HNO3— H2+Mg(NO3)2 J: Ag+HCl —B H练习2:将锌片投入下列盐溶液中,溶液的质
量减轻的是( )
A: MgCl2 B: CuCl2
C: AgNO3 D: ZnCl2C A: B: Zn→Cu C: Zn→2Ag D:
不反应 65 64 65 2×108 不反应Zn+CuCl2=Cu+ZnCl2
64 65
溶液增重 Zn+2AgNO3=2Ag+Zn(NO3)2
2 × 108 65
溶液减轻练习3:将一定质量的铁粉,放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,则滤渣中一定含有的金属是:( )
A: Fe B: Cu C: Ag D:Cu和AgCFe+Cu(NO3)2=Cu+Fe(NO3)2
Fe+2AgNO3=2Ag+Fe(NO3)2Cu+2AgNO3=2Ag+Cu(NO3)2(后反应)
(先反应)
生成物 有沉淀或气体或水,反应才能进行。复分解反应进行的条件: 反应物 对于碱与盐.盐与盐反应,反应物都必须溶于水。练习4、判断下列物质间能否发生化学反 应,并写出有关反应的化学方程式:
(1) ZnCO3 +2HCl =
(2) AgCl + HNO3 =
(3) Na2SO4 + Ba(OH)2 =
(4) K2SO4 + NaOH =
(5) Na2CO3+ Cu(OH)2 =
(6) MgSO4 + 2NaOH =
(7) Na2SO4+ BaCO3=
(8) Cu(OH)2+CO2=看谁又快又对ZnCl2+H2O+CO2↑BaSO4↓+2NaOHNa2SO4+Mg(OH)2↓不反应不反应不反应不反应不反应(1)金属+酸→盐+H2
(2)金属+盐→新金属+新盐
(3)酸+碱→盐+H2O
(4)酸+碱性氧化物→盐+H2O
(5)碱+酸性氧化物→盐+H2O
(6)酸+盐→新酸+新盐
(7)碱+盐→新碱+新盐
(8)盐+盐→新盐+新盐 讨论:在已学过的反应中,有哪些反应是可以生成盐类物质的? (9)金属+非金属→盐练习5. 写出制取硫酸锌的四种方法:1. Zn+H2SO4=ZnSO4+H2↑2. Zn+CuSO4=ZnSO4+Cu3. ZnO+H2SO4=ZnSO4+H2O4. Zn(OH)2+H2SO4=ZnSO4+2H2O5. ZnCO3+H2SO4=ZnSO4+H2O+CO2↑盐的制法练习6. 写出制取氯化钾的五种方法:1. 2K+Cl2=2KCl2. K2O+2HCl=2KCl+H2O3. KOH+HCl=KCl+H2O4. K2CO3+2HCl=2KCl+H2O+CO2↑5. K2SO4+BaCl2=2KCl+BaSO4↓△6. 2KOH+CuCl2=2KCl+Cu(OH)2↓ 7. 2KClO3=2KCl+3O2 ↑△盐的制法1.有五瓶失去标签的溶液,它们分别是①CuCl2、②Ba(NO3)2、③NaOH、④NaCl、⑤MgSO4 不用其它试剂加以区别的先后顺序是_______。课外思考:2.将铁粉加入Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,
(1).若向滤液中加入稀HCl,出现白色沉淀,则滤液中的阳离子有_______,滤纸上有___;
(2).若向滤纸中固体加稀HCl,出现气泡,则滤液中的阳离子有___ ,滤纸上有______ 。①③⑤②④Ag+ Cu2+ Fe2+Ag Fe2+Fe Cu Ag3.将Na2CO3溶液与CaCl2溶液混合,得白色沉淀和无色滤液a,向滤液a中加入AgNO3产生色沉淀b,过滤后向沉淀b中加入稀硝酸, 回答: (1).若沉淀b不溶解,则滤液a中一定含有的离子有___,可能有__,一定没有__。 (2).若沉淀b部分溶解,则滤液a中一定含有的离子______,一定没有__。 ?Ca2+CO32-Na+ Cl- CO32-Ca2+Na+ Cl- Na2CO3+CaCl2=CaCO3↓+2NaCl NaCl+AgNO3=AgCl↓+NaNO3 Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3 ( Na2CO3过量)盐的性质 物 理 性 质 化 学 性 质 主 要 应 用复分解反应进行的条件小结:
(1).盐酸盐_____ ;(2).硫酸盐 _____ ;(3).碳酸盐_____. _______;
(4).碱 _______ . ________ 。
2. 写出不溶于水且不溶于稀硝酸的两种盐_____ ._____ 。
3. 写出能溶于水的碳酸盐 _______ . ________ 。
4. 写出不溶于水能溶于酸的 盐 ______ . _____ . ______ 。溶解性AgCl BaSO4BaCO3CaCO3Cu(OH)2 Mg(OH)2AgCl BaSO4 Na2CO3 K2CO3BaCO3 CaCO3 MgCO3二. 盐的化学性质
(可溶)(可溶)(可溶)(可溶)(可溶)(至少有一种沉淀或NH3↑)(至少有一种沉淀)1.盐 + 金属 = 新盐+新金属 2.盐 + 酸 = 新盐 + 新酸 3.盐 + 碱 = 新盐 + 新碱4.盐 + 盐 = 新盐 + 新盐 ( 沉淀 或 CO2↑)(排前面)还有部分盐如加热易分解哟!1. CuCl2+Zn=ZnCl2+Cu2. BaCl2+H2SO4=BaSO4↓+2HCl
AgNO3+HCl=AgCl ↓ +HNO3
CaCO3+2HCl=CaCl2+H2O+CO2↑3. CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
Na2CO3+Ca(OH)2=CaCO3 ↓ +2NaOH
NH4Cl+NaOH=NaCl+NH3↑+H2O4. BaCl2+2AgNO3=2AgCl↓+Ba(NO3)2盐的化学性质方程式: 请举一反三!三.主要应用判断金属与混合盐溶液的反应顺序
在金属活动顺序表中,排在越后边的金属越容易从它的盐溶液中被置换出来。或者说:金属活动性相差越大,置换反应越易发生。思考
金属单质失电子:
强 弱 K Ca Na Mg Al Zn Fe Sn Pb(H) Cu Hg Ag Pt Au
Zn2+ Fe2+ H+ Cu2+ Ag+
弱 强
金属离子得电子:练习1:下列反应中,能进行的是( )
A:Cu+AgCl— Ag+CuCl2 B: Zn+AgNO3--
C: Fe+CuCl2— FeCl3+Cu D: Cu+ZnSO4—
E: Zn+Cu(OH)2-- F: Fe+CuO —
G: Na+CuSO4— Cu+ Na2SO4 H: Cu+Hg(NO3)2—
I: Mg+HNO3— H2+Mg(NO3)2 J: Ag+HCl —B H练习2:将锌片投入下列盐溶液中,溶液的质
量减轻的是( )
A: MgCl2 B: CuCl2
C: AgNO3 D: ZnCl2C A: B: Zn→Cu C: Zn→2Ag D:
不反应 65 64 65 2×108 不反应Zn+CuCl2=Cu+ZnCl2
64 65
溶液增重 Zn+2AgNO3=2Ag+Zn(NO3)2
2 × 108 65
溶液减轻练习3:将一定质量的铁粉,放入硝酸铜和硝酸银的混合溶液中,充分反应后过滤,则滤渣中一定含有的金属是:( )
A: Fe B: Cu C: Ag D:Cu和AgCFe+Cu(NO3)2=Cu+Fe(NO3)2
Fe+2AgNO3=2Ag+Fe(NO3)2Cu+2AgNO3=2Ag+Cu(NO3)2(后反应)
(先反应)
生成物 有沉淀或气体或水,反应才能进行。复分解反应进行的条件: 反应物 对于碱与盐.盐与盐反应,反应物都必须溶于水。练习4、判断下列物质间能否发生化学反 应,并写出有关反应的化学方程式:
(1) ZnCO3 +2HCl =
(2) AgCl + HNO3 =
(3) Na2SO4 + Ba(OH)2 =
(4) K2SO4 + NaOH =
(5) Na2CO3+ Cu(OH)2 =
(6) MgSO4 + 2NaOH =
(7) Na2SO4+ BaCO3=
(8) Cu(OH)2+CO2=看谁又快又对ZnCl2+H2O+CO2↑BaSO4↓+2NaOHNa2SO4+Mg(OH)2↓不反应不反应不反应不反应不反应(1)金属+酸→盐+H2
(2)金属+盐→新金属+新盐
(3)酸+碱→盐+H2O
(4)酸+碱性氧化物→盐+H2O
(5)碱+酸性氧化物→盐+H2O
(6)酸+盐→新酸+新盐
(7)碱+盐→新碱+新盐
(8)盐+盐→新盐+新盐 讨论:在已学过的反应中,有哪些反应是可以生成盐类物质的? (9)金属+非金属→盐练习5. 写出制取硫酸锌的四种方法:1. Zn+H2SO4=ZnSO4+H2↑2. Zn+CuSO4=ZnSO4+Cu3. ZnO+H2SO4=ZnSO4+H2O4. Zn(OH)2+H2SO4=ZnSO4+2H2O5. ZnCO3+H2SO4=ZnSO4+H2O+CO2↑盐的制法练习6. 写出制取氯化钾的五种方法:1. 2K+Cl2=2KCl2. K2O+2HCl=2KCl+H2O3. KOH+HCl=KCl+H2O4. K2CO3+2HCl=2KCl+H2O+CO2↑5. K2SO4+BaCl2=2KCl+BaSO4↓△6. 2KOH+CuCl2=2KCl+Cu(OH)2↓ 7. 2KClO3=2KCl+3O2 ↑△盐的制法1.有五瓶失去标签的溶液,它们分别是①CuCl2、②Ba(NO3)2、③NaOH、④NaCl、⑤MgSO4 不用其它试剂加以区别的先后顺序是_______。课外思考:2.将铁粉加入Cu(NO3)2和AgNO3的混合溶液中,充分反应后过滤,
(1).若向滤液中加入稀HCl,出现白色沉淀,则滤液中的阳离子有_______,滤纸上有___;
(2).若向滤纸中固体加稀HCl,出现气泡,则滤液中的阳离子有___ ,滤纸上有______ 。①③⑤②④Ag+ Cu2+ Fe2+Ag Fe2+Fe Cu Ag3.将Na2CO3溶液与CaCl2溶液混合,得白色沉淀和无色滤液a,向滤液a中加入AgNO3产生色沉淀b,过滤后向沉淀b中加入稀硝酸, 回答: (1).若沉淀b不溶解,则滤液a中一定含有的离子有___,可能有__,一定没有__。 (2).若沉淀b部分溶解,则滤液a中一定含有的离子______,一定没有__。 ?Ca2+CO32-Na+ Cl- CO32-Ca2+Na+ Cl- Na2CO3+CaCl2=CaCO3↓+2NaCl NaCl+AgNO3=AgCl↓+NaNO3 Na2CO3+2AgNO3=Ag2CO3↓+2NaNO3 ( Na2CO3过量)盐的性质 物 理 性 质 化 学 性 质 主 要 应 用复分解反应进行的条件小结:
