京改版化学九年级下册 11.2 几种常见的酸 课件(共20张PPT)
文档属性
| 名称 | 京改版化学九年级下册 11.2 几种常见的酸 课件(共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 197.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-31 00:00:00 | ||
图片预览








文档简介
课件20张PPT。几种常见的酸1、写出生活中常见的酸的化学式 2、完成下列方程式 Mg Al Zn Fe;氧化铁、氧化铜 分别和稀盐酸、稀硫酸反应的化学方程式。课前准备?一、浓盐酸和浓硫酸HCl气体极易溶于水(1∶500)无色液体无色、粘稠、
油状的液体瓶口有白雾无现象有刺激性气味无气味浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。1.19g/mL1.84g/mL1、浓盐酸(1)盐酸是HCl气体的水溶液
(2) 浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成
盐酸小液滴——白雾?敞口放置在空气中的浓盐酸质量将如何变?
溶质的质量分数将如何变?2、浓硫酸(1)吸水性:
浓硫酸可吸收空气中、溶液中的水。
用途:作干燥剂
【例如】实验室要想得到干燥的二氧化碳气体可将气体通过浓硫酸
?敞口放置在空气中的浓硫酸质量将如何变?
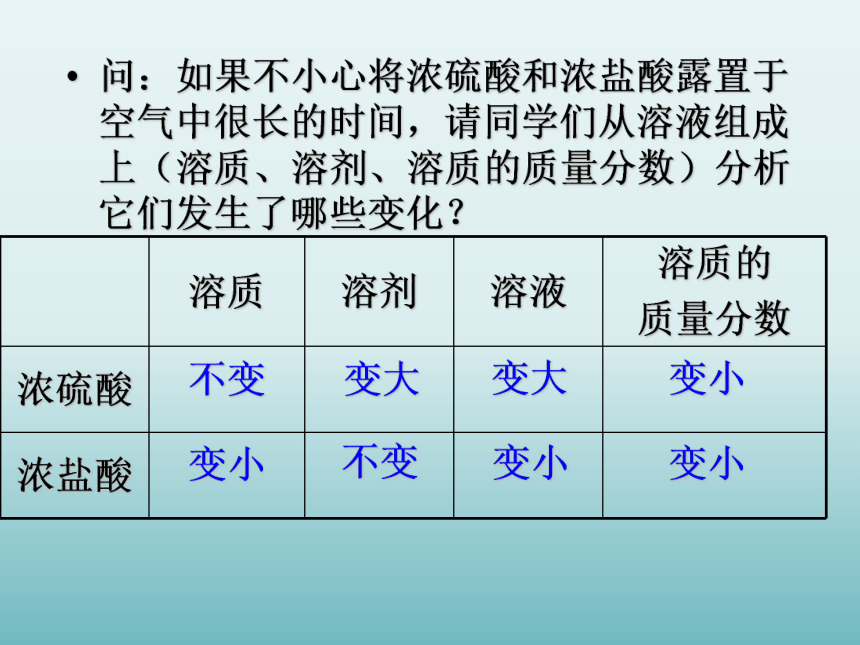
溶质的质量分数将如何变?问:如果不小心将浓硫酸和浓盐酸露置于空气中很长的时间,请同学们从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?不变变小变大不变变小变小变大变小(2)脱水性滴有浓硫酸的部位
变黑,甚至烧成洞纸上显出黑色字迹蘸有浓硫酸的部位变黑结论:浓硫酸有强烈的腐蚀性。
(浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱去,生成黑色的炭。
这种作用叫做脱水作用。)(3)浓硫酸的稀释:
浓硫酸稀释的错误操作水的密度较小,
浮在浓硫酸上
面,溶解时放出
的热会使水立
刻沸腾,使硫酸
液滴向四周飞
溅,这是非常危
险的.浓硫酸稀释的正确操作在稀释浓硫酸
时,一定要把浓
硫酸沿器壁慢
慢注入水里,并
不断搅拌.切不
可将水倒进浓
硫酸里.注意:浓硫酸水搅拌。水酸如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水
冲洗,然后涂上3%---5%的碳酸氢钠溶液.注意:回忆:学过哪些有盐酸或硫酸参与的化学反应?二、稀盐酸、稀硫酸的化学性质1、与酸碱指示剂反应
① 酸溶液能使紫色石蕊试液变成红色,
② 酸溶液不能使无色酚酞试液变色。2、与某些金属反应
金属 + 酸 → 盐 + 氢气
金属活动顺序表Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4=ZnSO4+H2↑Fe +H2SO4=FeSO4+H2↑酸:盐酸、稀硫酸思考:硫酸厂有一辆运输过浓硫酸的铁罐车(常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应),某新上岗的工人违反操作规定,边吸烟边用水冲洗该铁罐车,结果发生了爆炸事故。
请以该厂技术员的身份分析一下发生爆炸的原因。
实验:
(1)在试管中放入生锈铁钉,再加入1mL稀盐酸(或硫酸)。
(2)在试管中放入少量CuO粉末,再加入1mL稀硫酸(或稀盐酸),加热。红棕色的铁锈溶解,溶液由无色变成黄色。黑色CuO溶解,溶液由无色变成蓝色。(3)与某些金属氧化物反应
金属氧化物 + 酸 → 盐 + 水Fe2O3+6HCl
=2FeCl3+3H2OFe2O3+3H2SO4
=Fe2(SO4)3+3H2OCuO+2HCl
=CuCl2+H2OCuO+H2SO4
=CuSO4+H2O 利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?【随堂练习】
1、下列物质溶于水,不导电的是( )
A.硫酸 B.硝酸钾 C.酒精 D.氢氧化钾
2.某化合物溶液中通过实验证明只有Na+ 和SO42- ,则该化合物是( )
A.Na2CO3 B.NaCl C.Na2SO4 D.NaHSO4
3.下列电离方程式正确的是( )
A. FeSO4=Fe3+ +SO42- B. Ca(OH)2=Ca2+ +(OH)2-
C. AlCl3=Al3+ +3Cl- D. H2SO4=H+ +SO42-CCC4.下列电离方程式中是酸电离方程式的是( )
A.HCl =H+ +Cl- B.KNO3=K+ +NO3-
C.NaOH=Na+ +OH- D.NaCl=Na+ +Cl-
5.含有下列离子的溶液中,溶质全部为酸的是( )
A.H+ Na+ SO42- B.H+ Cl- NO3-
C.OH- K+ Ba2+ D.Ag+ K+ NO3-AB
油状的液体瓶口有白雾无现象有刺激性气味无气味浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成盐酸小液滴。1.19g/mL1.84g/mL1、浓盐酸(1)盐酸是HCl气体的水溶液
(2) 浓盐酸具有很强的挥发性,挥发出来的HCl气体溶解在空气中的水蒸气中,形成
盐酸小液滴——白雾?敞口放置在空气中的浓盐酸质量将如何变?
溶质的质量分数将如何变?2、浓硫酸(1)吸水性:
浓硫酸可吸收空气中、溶液中的水。
用途:作干燥剂
【例如】实验室要想得到干燥的二氧化碳气体可将气体通过浓硫酸
?敞口放置在空气中的浓硫酸质量将如何变?
溶质的质量分数将如何变?问:如果不小心将浓硫酸和浓盐酸露置于空气中很长的时间,请同学们从溶液组成上(溶质、溶剂、溶质的质量分数)分析它们发生了哪些变化?不变变小变大不变变小变小变大变小(2)脱水性滴有浓硫酸的部位
变黑,甚至烧成洞纸上显出黑色字迹蘸有浓硫酸的部位变黑结论:浓硫酸有强烈的腐蚀性。
(浓硫酸能将纸张、木材、布料、皮肤中的氢、氧元素按水的组成比脱去,生成黑色的炭。
这种作用叫做脱水作用。)(3)浓硫酸的稀释:
浓硫酸稀释的错误操作水的密度较小,
浮在浓硫酸上
面,溶解时放出
的热会使水立
刻沸腾,使硫酸
液滴向四周飞
溅,这是非常危
险的.浓硫酸稀释的正确操作在稀释浓硫酸
时,一定要把浓
硫酸沿器壁慢
慢注入水里,并
不断搅拌.切不
可将水倒进浓
硫酸里.注意:浓硫酸水搅拌。水酸如果不慎将浓硫酸沾到皮肤或衣服上,应立即用大量水
冲洗,然后涂上3%---5%的碳酸氢钠溶液.注意:回忆:学过哪些有盐酸或硫酸参与的化学反应?二、稀盐酸、稀硫酸的化学性质1、与酸碱指示剂反应
① 酸溶液能使紫色石蕊试液变成红色,
② 酸溶液不能使无色酚酞试液变色。2、与某些金属反应
金属 + 酸 → 盐 + 氢气
金属活动顺序表Mg+2HCl=MgCl2+H2↑Zn+2HCl=ZnCl2+H2↑Fe+2HCl=FeCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn +H2SO4=ZnSO4+H2↑Fe +H2SO4=FeSO4+H2↑酸:盐酸、稀硫酸思考:硫酸厂有一辆运输过浓硫酸的铁罐车(常温下,浓硫酸使铁表面生成一层致密的氧化膜,阻止铁与浓硫酸进一步反应),某新上岗的工人违反操作规定,边吸烟边用水冲洗该铁罐车,结果发生了爆炸事故。
请以该厂技术员的身份分析一下发生爆炸的原因。
实验:
(1)在试管中放入生锈铁钉,再加入1mL稀盐酸(或硫酸)。
(2)在试管中放入少量CuO粉末,再加入1mL稀硫酸(或稀盐酸),加热。红棕色的铁锈溶解,溶液由无色变成黄色。黑色CuO溶解,溶液由无色变成蓝色。(3)与某些金属氧化物反应
金属氧化物 + 酸 → 盐 + 水Fe2O3+6HCl
=2FeCl3+3H2OFe2O3+3H2SO4
=Fe2(SO4)3+3H2OCuO+2HCl
=CuCl2+H2OCuO+H2SO4
=CuSO4+H2O 利用上面的反应可以清除金属制品表面的锈,除锈时能否将金属制品长时间浸在酸中?为什么?【随堂练习】
1、下列物质溶于水,不导电的是( )
A.硫酸 B.硝酸钾 C.酒精 D.氢氧化钾
2.某化合物溶液中通过实验证明只有Na+ 和SO42- ,则该化合物是( )
A.Na2CO3 B.NaCl C.Na2SO4 D.NaHSO4
3.下列电离方程式正确的是( )
A. FeSO4=Fe3+ +SO42- B. Ca(OH)2=Ca2+ +(OH)2-
C. AlCl3=Al3+ +3Cl- D. H2SO4=H+ +SO42-CCC4.下列电离方程式中是酸电离方程式的是( )
A.HCl =H+ +Cl- B.KNO3=K+ +NO3-
C.NaOH=Na+ +OH- D.NaCl=Na+ +Cl-
5.含有下列离子的溶液中,溶质全部为酸的是( )
A.H+ Na+ SO42- B.H+ Cl- NO3-
C.OH- K+ Ba2+ D.Ag+ K+ NO3-AB
