京改版化学九年级下册 12.2《 盐的性质》教案
文档属性
| 名称 | 京改版化学九年级下册 12.2《 盐的性质》教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 13.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 北京课改版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-31 00:00:00 | ||
图片预览

文档简介
《盐的化学性质》教学设计
一、教学背景
1、学情分析
(1) 知识储备:在第12章第一节《几种常见的盐》中初步了解盐的组成,但仍有部分学生把生活中常说的“盐”等同于化学概念中物质分类的盐。通过第11章的学习,学生对酸、碱的有关知识已系统掌握,同时初步认识复分解反应的特征,这些都为本节课学习盐的化学性质做了好的知识铺垫。
(2) 能力储备:学生经过大半年的化学课学习,已具备一定简单的实验探究能力,能在老师的引导下进行简单的实验设计操作。
(3) 心理特征:学生处于形象思维到抽象思维的过渡阶段,有强烈的好奇心,在老师引导下能动脑思考,有一定的合作意识,愿意和同学进行交流。
2、教材分析
《盐的化学性质》是北京2011课标版第12章《盐》第二节的内容。在新课标内容标准中本节内容归为“身边的化学物质”一级主题下的“生活中常见的化合物”二级主题。
学习了常见的酸和碱,再来学习盐,是知识的自然发展。课标对盐的知识要求比较简单,仅是认识四种常见盐的性状和应用。本课时从实验情境入手,从学生身边熟悉的物质出发认识常见盐,从组成上离子的特征强化盐的认识,通过实验探究纯碱的化学性质进而归纳盐的化学性质,从而对酸、碱、盐的性质、应用和转化规律及化学反应有比较完整的归纳,对初中化学知识的学习将起到小结的作业,为今后高中学习化学做好铺垫。
二、教学目标
1、知识与技能
(1) 了解盐的组成特点。
(2) 在实验探究纯碱化学性质的基础上自主归纳盐的化学性质。
2、过程与方法
(1) 通过自主设计实验探究纯碱的化学性质,通过实验分析,学会由特殊到普遍归纳事物规律的方法。
(2) 通过自主探究实验,培养学生通过实验观察对获得的事实进行分析归纳得出结论的科学方法。
(3) 通过盐的化学性质总结,鼓励学生积极主动开动脑筋,总结规律,形成科学的记忆方法。
3、情感?态度?价值观
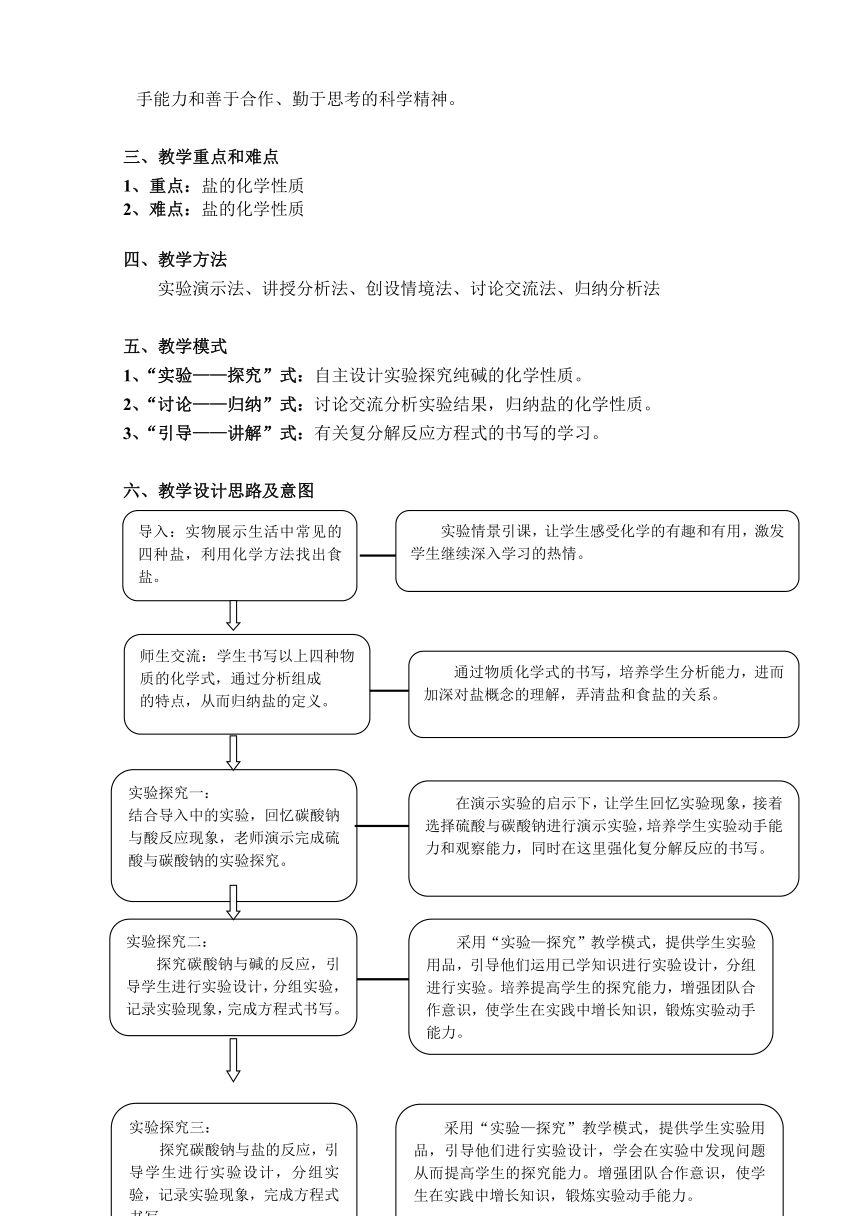
通过学生自己动手实验,增强学生对化学实验现象的探究欲,培养学生的动手能力和善于合作、勤于思考的科学精神。
三、教学重点和难点
1、重点:盐的化学性质
2、难点:盐的化学性质
四、教学方法
实验演示法、讲授分析法、创设情境法、讨论交流法、归纳分析法
五、教学模式
1、“实验——探究”式:自主设计实验探究纯碱的化学性质。
2、“讨论——归纳”式:讨论交流分析实验结果,归纳盐的化学性质。
3、“引导——讲解”式:有关复分解反应方程式的书写的学习。
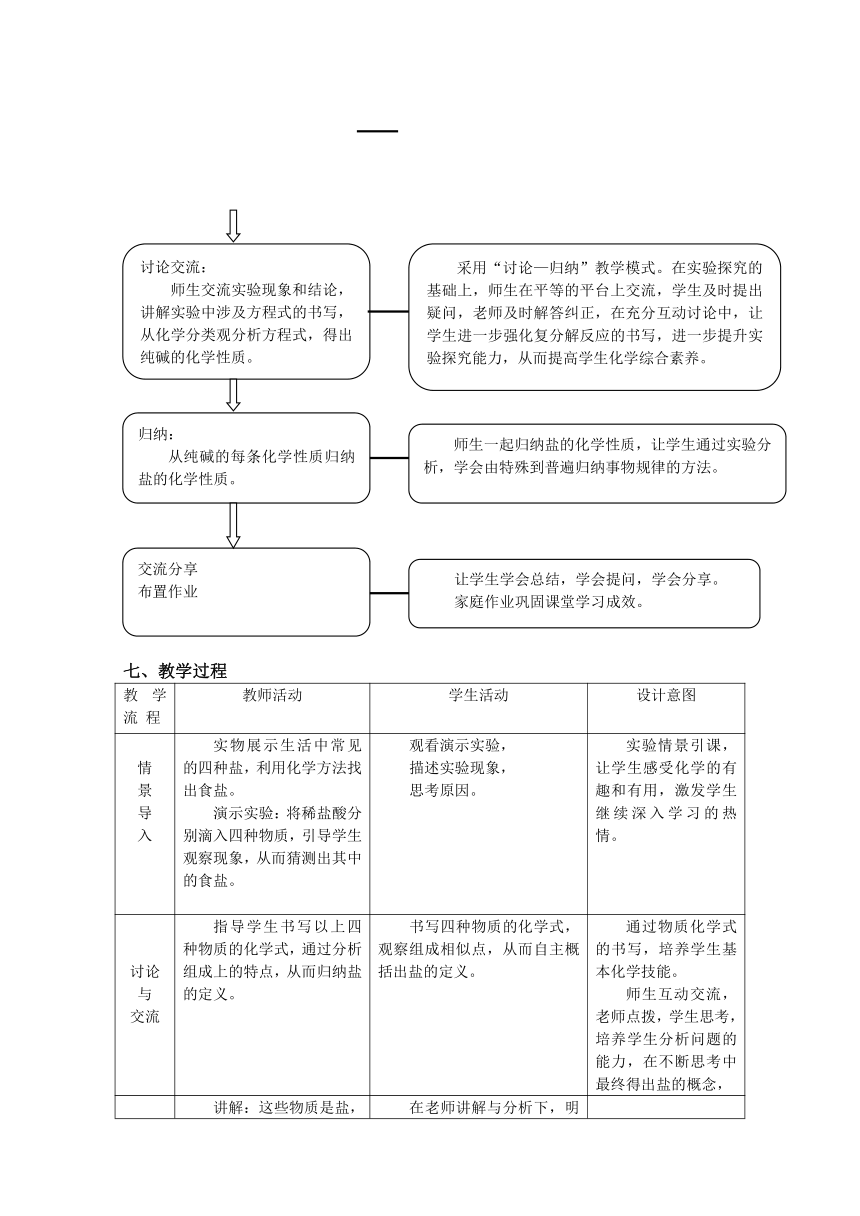
六、教学设计思路及意图
七、教学过程
教学流 程
教师活动
学生活动
设计意图
情
景
导
入
实物展示生活中常见的四种盐,利用化学方法找出食盐。
演示实验:将稀盐酸分别滴入四种物质,引导学生观察现象,从而猜测出其中的食盐。
观看演示实验,
描述实验现象,
思考原因。
实验情景引课,让学生感受化学的有趣和有用,激发学生继续深入学习的热情。
讨论与
交流
指导学生书写以上四种物质的化学式,通过分析组成上的特点,从而归纳盐的定义。
书写四种物质的化学式,观察组成相似点,从而自主概括出盐的定义。
通过物质化学式的书写,培养学生基本化学技能。
师生互动交流,老师点拨,学生思考,培养学生分析问题的能力,在不断思考中最终得出盐的概念,
讲
解
与
分
析
讲解:这些物质是盐,它们为离子化合物。离子分为阳离子和阴离子。
分析:引导学生观察阴阳离子的种类:阳离子为金属离子,阴离子为酸根离子。
小结:盐是一类物质,而食盐是千万种盐中的一种,所以盐是食盐的说法是错误的。
在老师讲解与分析下,明白:盐的阳离子主要为金属离子,阴离子为酸根离子。
从而自主归纳盐的概念:由金属离子和酸根离子构成的化合物。
记录板书:
一、盐的定义
过渡
盐有哪些化学性质呢?我们选取以上四种盐中的一种:B物质作为研究对象,用实验探究它的化学性质,从而学习盐的化学性质。
实
验
探
究
一
结合导入中的实验,回忆碳酸钠与酸反应现象,教师演示碳酸钠溶液与稀硫酸的反应,引导学生完成硫酸与碳酸钠的实验记录。
认真观察演示实验:
将稀硫酸滴入碳酸钠溶液中。
观察实验,记录现象,书写化学方程式。
在演示实验的启示下,让学生回忆实验现象,接着选择硫酸与碳酸钠进行分组实验,培养学生实验动手能力和观察能力,为后面进行自主实验设计实验铺垫。
交流
与
汇报
与学生交流实验现象。
投影:学生书写的化学方程式,及时纠正错误。
由实验现象归纳实验结论:碳酸钠能与酸发生反应。
汇报小组的实验现象:
碳酸钠与盐酸、硫酸反应产生气泡。
当场订正化学方程式。
采用“讨论—归纳”教学模式。在实验探究的基础上,师生在平等的平台上交流,在充分互动讨论中,让学生进一步强化复分解反应的书写,进一步提升实验探究能力,从而提高学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与酸反应的反应物和生成物进行分类。从而得归纳出盐的第一点化学性质:
板书归纳:
1.盐+酸=新盐+新酸
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
教学流 程
教师活动
学生活动
设计意图
实
验
探
究
二
引导学生进行碳酸钠与碱的反应实验设计,分组实验,记录实验现象,完成方程式书写。
让学生先选择碱试剂:
氢氧化钾、
硫酸钾、
澄清石灰水、
氯化钙、
氢氧化钡、
硝酸钡
认真听老师的引导内容,学生分组实验,按照取样→滴加→观察→记录四个步骤进行实验,记录实验步骤和实验现象。写出相对应的化学方程式。
采用“实验—探究”教学模式,提供学生实验用品,引导他们运用已学知识进行实验设计,分组进行实验。培养提高学生的探究能力,增强团队合作意识,使学生在实践中增长知识,锻炼实验动手能力。
交
流
与
发
现
与学生交流实验现象。
点拨:无明显现象并不意味一定不反应。在这里根据理论依据氢氧化钾与碳酸钠不反应,所以无明显现象。
由实验现象归纳实验结论:碳酸钠能与某些碱发生反应。
投影:学生书写的化学方程式,及时纠正错误。
汇报小组的实验现象。
提出问题:为什么氢氧化钾与碳酸钠无明显现象?
当场订正化学方程式。
采用“讨论—归纳”教学模式。在实验探究的基础上,师生在平等的平台上交流,学生及时提出疑问,老师及时解答纠正,在充分互动讨论中,让学生进一步强化复分解反应的书写,进一步提升实验探究能力,从而提高学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与碱反应的反应物和生成物进行分类。从而得归纳出盐的第二点化学性质:
板书归纳:
2.盐+碱=新盐+新碱
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
实
验
探
究
三
引导学生进行碳酸钠与盐的反应实验设计,分组实验,记录实验现象,完成方程式书写。
认真听老师的引导内容,学生分组实验,按照取样→滴加→观察进行实验步骤,记录实验步骤和实验现象。写出相对应的化学方程式。
采用“实验—探究”教学模式,提供学生实验用品,引导他们运用已学知识进行实验设计,分组进行实验。培养提高学生的探究能力,增强团队合作意识,使学生在实践中增长知识,锻炼实验动手能力。
教学流 程
教师活动
学生活动
设计意图
交
流
与
发
现
与学生交流实验现象。
点拨:无明显现象并不意味一定不反应。在这里根据理论依据硫酸钾钾与碳酸钠不反应,所以无明显现象。
由实验现象归纳实验结论:碳酸钠能与某些盐发生反应。
投影:学生书写的化学方程式,及时纠正错误。
汇报小组的实验现象。
提出问题:为什么硫酸钾与碳酸钠无明显现象?
当场订正化学方程式。
采用“讨论—归纳”教学模式。师生平等交流,培养学生学习交流的能力,在思维碰撞中解决问题,自主归纳结论,有利于进一步提升学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与盐反应的反应物和生成物进行分类。从而得归纳出盐的第三点化学性质:
板书归纳:
3.盐1+盐2=新盐1+新盐2
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
回
顾
与
归
纳
激疑:古代湿法炼铜的原理。
指导学生写出反应原理。
引导从物质分类观对该反应的反应物和生成物进行物质分类,归纳出盐的最后一点性质:
板书归纳:
4.盐+活泼金属=新盐+较不活泼的金属
回忆:湿法炼铜的原理:
CuSO4+Fe=FeSO4 + Cu
通过链接已有知识,让学生学会知识迁移,从而系统化盐的化学性质,进一步培养学生的归纳概括能力。
交
流
分
享
通过本节课的学习你有哪些收获与困惑。
引导学生寻找盐的四点化学性质有何规律。
大胆提出困惑。
大胆发言,分享收获,提出疑问。
让学生学会总结,学会提问,学会分享。
学以致 用
两道习题:
1.关于从不同角度对纯碱这个盐进行分类,深化对盐的分类认识。
2.联系中考,一道有关氯化铜盐的推断题,运用所学盐的化学性质进行解答。
联系本节课所学知识进行解答问题,及时提出问题,解决问题。
利用习题巩固本节课上课内容,让学生学会自主解决问题,达到学以致用的目的。
布
置
作
业
布置家庭作业:
完成本课时的导学案。
课本P247 1-6
记录作业
巩固课堂学习成效。
八、板书设计
§8.4 常见的盐
盐的定义
盐的化学性质
1. 盐+酸=新盐+新酸
2. 盐+碱=新盐+新碱
3. 盐1+盐2=新盐1+新盐2
4. 盐+活泼金属=新盐+较不活泼金属
一、教学背景
1、学情分析
(1) 知识储备:在第12章第一节《几种常见的盐》中初步了解盐的组成,但仍有部分学生把生活中常说的“盐”等同于化学概念中物质分类的盐。通过第11章的学习,学生对酸、碱的有关知识已系统掌握,同时初步认识复分解反应的特征,这些都为本节课学习盐的化学性质做了好的知识铺垫。
(2) 能力储备:学生经过大半年的化学课学习,已具备一定简单的实验探究能力,能在老师的引导下进行简单的实验设计操作。
(3) 心理特征:学生处于形象思维到抽象思维的过渡阶段,有强烈的好奇心,在老师引导下能动脑思考,有一定的合作意识,愿意和同学进行交流。
2、教材分析
《盐的化学性质》是北京2011课标版第12章《盐》第二节的内容。在新课标内容标准中本节内容归为“身边的化学物质”一级主题下的“生活中常见的化合物”二级主题。
学习了常见的酸和碱,再来学习盐,是知识的自然发展。课标对盐的知识要求比较简单,仅是认识四种常见盐的性状和应用。本课时从实验情境入手,从学生身边熟悉的物质出发认识常见盐,从组成上离子的特征强化盐的认识,通过实验探究纯碱的化学性质进而归纳盐的化学性质,从而对酸、碱、盐的性质、应用和转化规律及化学反应有比较完整的归纳,对初中化学知识的学习将起到小结的作业,为今后高中学习化学做好铺垫。
二、教学目标
1、知识与技能
(1) 了解盐的组成特点。
(2) 在实验探究纯碱化学性质的基础上自主归纳盐的化学性质。
2、过程与方法
(1) 通过自主设计实验探究纯碱的化学性质,通过实验分析,学会由特殊到普遍归纳事物规律的方法。
(2) 通过自主探究实验,培养学生通过实验观察对获得的事实进行分析归纳得出结论的科学方法。
(3) 通过盐的化学性质总结,鼓励学生积极主动开动脑筋,总结规律,形成科学的记忆方法。
3、情感?态度?价值观
通过学生自己动手实验,增强学生对化学实验现象的探究欲,培养学生的动手能力和善于合作、勤于思考的科学精神。
三、教学重点和难点
1、重点:盐的化学性质
2、难点:盐的化学性质
四、教学方法
实验演示法、讲授分析法、创设情境法、讨论交流法、归纳分析法
五、教学模式
1、“实验——探究”式:自主设计实验探究纯碱的化学性质。
2、“讨论——归纳”式:讨论交流分析实验结果,归纳盐的化学性质。
3、“引导——讲解”式:有关复分解反应方程式的书写的学习。
六、教学设计思路及意图
七、教学过程
教学流 程
教师活动
学生活动
设计意图
情
景
导
入
实物展示生活中常见的四种盐,利用化学方法找出食盐。
演示实验:将稀盐酸分别滴入四种物质,引导学生观察现象,从而猜测出其中的食盐。
观看演示实验,
描述实验现象,
思考原因。
实验情景引课,让学生感受化学的有趣和有用,激发学生继续深入学习的热情。
讨论与
交流
指导学生书写以上四种物质的化学式,通过分析组成上的特点,从而归纳盐的定义。
书写四种物质的化学式,观察组成相似点,从而自主概括出盐的定义。
通过物质化学式的书写,培养学生基本化学技能。
师生互动交流,老师点拨,学生思考,培养学生分析问题的能力,在不断思考中最终得出盐的概念,
讲
解
与
分
析
讲解:这些物质是盐,它们为离子化合物。离子分为阳离子和阴离子。
分析:引导学生观察阴阳离子的种类:阳离子为金属离子,阴离子为酸根离子。
小结:盐是一类物质,而食盐是千万种盐中的一种,所以盐是食盐的说法是错误的。
在老师讲解与分析下,明白:盐的阳离子主要为金属离子,阴离子为酸根离子。
从而自主归纳盐的概念:由金属离子和酸根离子构成的化合物。
记录板书:
一、盐的定义
过渡
盐有哪些化学性质呢?我们选取以上四种盐中的一种:B物质作为研究对象,用实验探究它的化学性质,从而学习盐的化学性质。
实
验
探
究
一
结合导入中的实验,回忆碳酸钠与酸反应现象,教师演示碳酸钠溶液与稀硫酸的反应,引导学生完成硫酸与碳酸钠的实验记录。
认真观察演示实验:
将稀硫酸滴入碳酸钠溶液中。
观察实验,记录现象,书写化学方程式。
在演示实验的启示下,让学生回忆实验现象,接着选择硫酸与碳酸钠进行分组实验,培养学生实验动手能力和观察能力,为后面进行自主实验设计实验铺垫。
交流
与
汇报
与学生交流实验现象。
投影:学生书写的化学方程式,及时纠正错误。
由实验现象归纳实验结论:碳酸钠能与酸发生反应。
汇报小组的实验现象:
碳酸钠与盐酸、硫酸反应产生气泡。
当场订正化学方程式。
采用“讨论—归纳”教学模式。在实验探究的基础上,师生在平等的平台上交流,在充分互动讨论中,让学生进一步强化复分解反应的书写,进一步提升实验探究能力,从而提高学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与酸反应的反应物和生成物进行分类。从而得归纳出盐的第一点化学性质:
板书归纳:
1.盐+酸=新盐+新酸
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
教学流 程
教师活动
学生活动
设计意图
实
验
探
究
二
引导学生进行碳酸钠与碱的反应实验设计,分组实验,记录实验现象,完成方程式书写。
让学生先选择碱试剂:
氢氧化钾、
硫酸钾、
澄清石灰水、
氯化钙、
氢氧化钡、
硝酸钡
认真听老师的引导内容,学生分组实验,按照取样→滴加→观察→记录四个步骤进行实验,记录实验步骤和实验现象。写出相对应的化学方程式。
采用“实验—探究”教学模式,提供学生实验用品,引导他们运用已学知识进行实验设计,分组进行实验。培养提高学生的探究能力,增强团队合作意识,使学生在实践中增长知识,锻炼实验动手能力。
交
流
与
发
现
与学生交流实验现象。
点拨:无明显现象并不意味一定不反应。在这里根据理论依据氢氧化钾与碳酸钠不反应,所以无明显现象。
由实验现象归纳实验结论:碳酸钠能与某些碱发生反应。
投影:学生书写的化学方程式,及时纠正错误。
汇报小组的实验现象。
提出问题:为什么氢氧化钾与碳酸钠无明显现象?
当场订正化学方程式。
采用“讨论—归纳”教学模式。在实验探究的基础上,师生在平等的平台上交流,学生及时提出疑问,老师及时解答纠正,在充分互动讨论中,让学生进一步强化复分解反应的书写,进一步提升实验探究能力,从而提高学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与碱反应的反应物和生成物进行分类。从而得归纳出盐的第二点化学性质:
板书归纳:
2.盐+碱=新盐+新碱
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
实
验
探
究
三
引导学生进行碳酸钠与盐的反应实验设计,分组实验,记录实验现象,完成方程式书写。
认真听老师的引导内容,学生分组实验,按照取样→滴加→观察进行实验步骤,记录实验步骤和实验现象。写出相对应的化学方程式。
采用“实验—探究”教学模式,提供学生实验用品,引导他们运用已学知识进行实验设计,分组进行实验。培养提高学生的探究能力,增强团队合作意识,使学生在实践中增长知识,锻炼实验动手能力。
教学流 程
教师活动
学生活动
设计意图
交
流
与
发
现
与学生交流实验现象。
点拨:无明显现象并不意味一定不反应。在这里根据理论依据硫酸钾钾与碳酸钠不反应,所以无明显现象。
由实验现象归纳实验结论:碳酸钠能与某些盐发生反应。
投影:学生书写的化学方程式,及时纠正错误。
汇报小组的实验现象。
提出问题:为什么硫酸钾与碳酸钠无明显现象?
当场订正化学方程式。
采用“讨论—归纳”教学模式。师生平等交流,培养学生学习交流的能力,在思维碰撞中解决问题,自主归纳结论,有利于进一步提升学生化学综合素养。
小结
从化学分类观引导学生对碳酸钠与盐反应的反应物和生成物进行分类。从而得归纳出盐的第三点化学性质:
板书归纳:
3.盐1+盐2=新盐1+新盐2
思考反应物和生成物的类别,进而自主归纳出盐的化学性质。
回
顾
与
归
纳
激疑:古代湿法炼铜的原理。
指导学生写出反应原理。
引导从物质分类观对该反应的反应物和生成物进行物质分类,归纳出盐的最后一点性质:
板书归纳:
4.盐+活泼金属=新盐+较不活泼的金属
回忆:湿法炼铜的原理:
CuSO4+Fe=FeSO4 + Cu
通过链接已有知识,让学生学会知识迁移,从而系统化盐的化学性质,进一步培养学生的归纳概括能力。
交
流
分
享
通过本节课的学习你有哪些收获与困惑。
引导学生寻找盐的四点化学性质有何规律。
大胆提出困惑。
大胆发言,分享收获,提出疑问。
让学生学会总结,学会提问,学会分享。
学以致 用
两道习题:
1.关于从不同角度对纯碱这个盐进行分类,深化对盐的分类认识。
2.联系中考,一道有关氯化铜盐的推断题,运用所学盐的化学性质进行解答。
联系本节课所学知识进行解答问题,及时提出问题,解决问题。
利用习题巩固本节课上课内容,让学生学会自主解决问题,达到学以致用的目的。
布
置
作
业
布置家庭作业:
完成本课时的导学案。
课本P247 1-6
记录作业
巩固课堂学习成效。
八、板书设计
§8.4 常见的盐
盐的定义
盐的化学性质
1. 盐+酸=新盐+新酸
2. 盐+碱=新盐+新碱
3. 盐1+盐2=新盐1+新盐2
4. 盐+活泼金属=新盐+较不活泼金属
