人教版选修三第二章第一节共价键(共40张ppt)
文档属性
| 名称 | 人教版选修三第二章第一节共价键(共40张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-01-29 00:00:00 | ||
图片预览






文档简介
(共40张PPT)
防晒霜之所以能有效减轻紫外线对人体的伤害,原因之一就是它的有效成分的分子中含有π键。 π键是什么样的化学键,它又是怎么形成的呢?
防晒霜为何能防晒呢?
第二章 化学键与分子间作用力
第一节 共价键模型
第1课时 共价键
共价键
化学键:直接相邻的原子核离子之间存在的强烈的相互作用。
离子键:阴阳离子间的静电作用
共价键:原子间通过共用电子对形成的相互作用
成键微粒:原子
存在:
共价化合物、非金属单质、某些离子化合物
现代价键理论的基本要点
①电子配对原理:两原子各自提供1个自旋方向相反的电子彼此配对
②最大重叠原理:两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
形成条件:电负性相同或电负性相差1.7以内的原子间
非金属原子间或不活泼的金属和非金属间
7
7
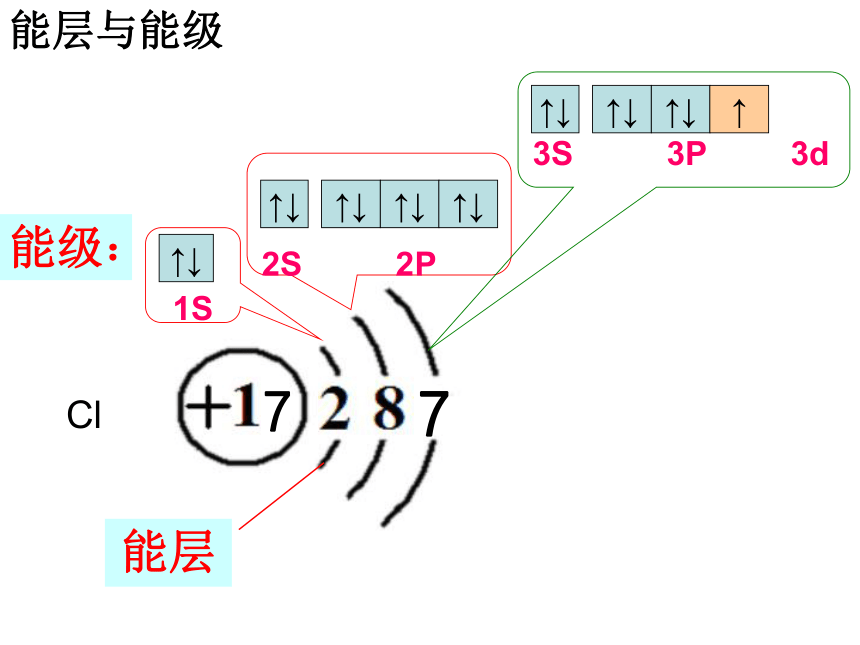
能层
2S 2P
1S
↑↓
↑↓
↑↓
↑↓
↑↓
能级:
能层与能级
3S 3P 3d
↑↓
↑↓
↑↓
↑
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
氯原子的电子排布图
↑
1S
H
↑↓
↑↓
1S
2S
↑
↑
↑
2P
N
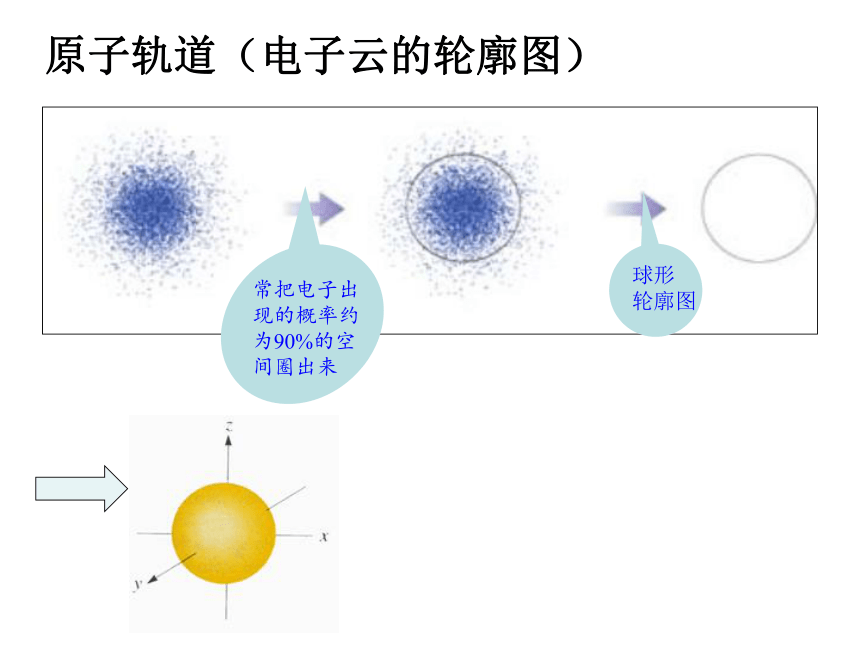
原子轨道(电子云的轮廓图)
常把电子出
现的概率约为90%的空间圈出来
球形
轮廓图
电子云:电子在原子核外空间概率密度分布的形象描述
原子轨道:电子在原子核外的一个空间运动状态
一.共价键
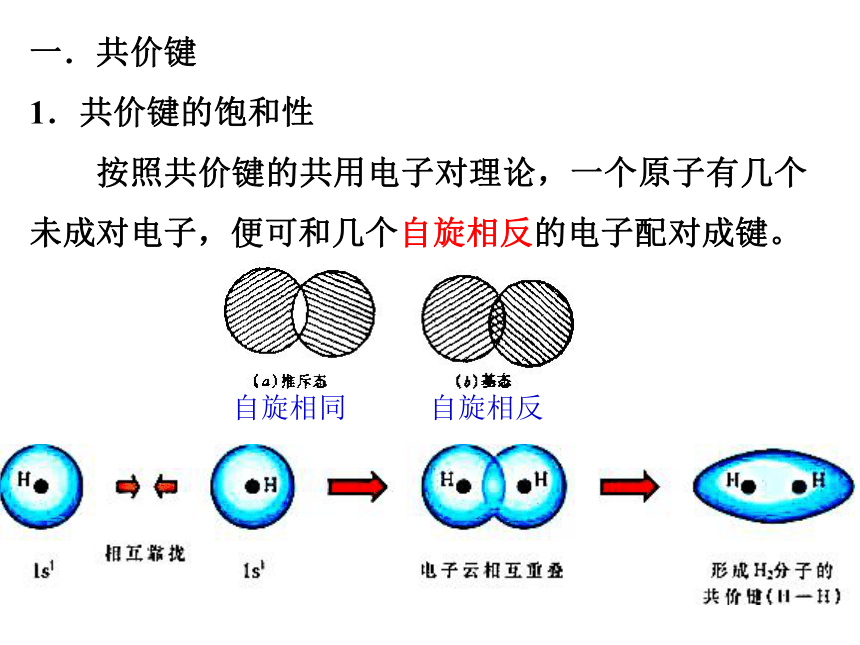
1.共价键的饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。
自旋相同
自旋相反
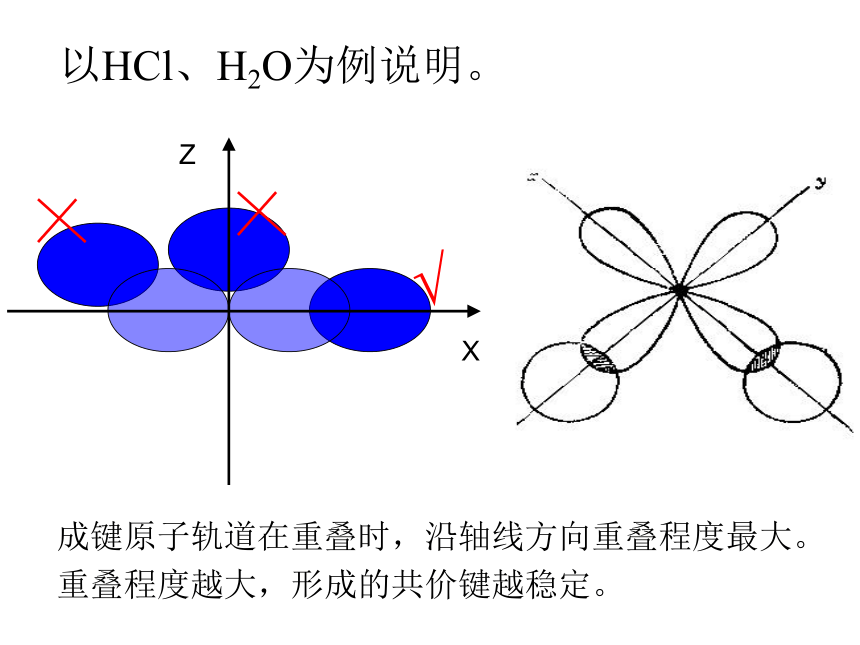
以HCl、H2O为例说明。
X
Z
√
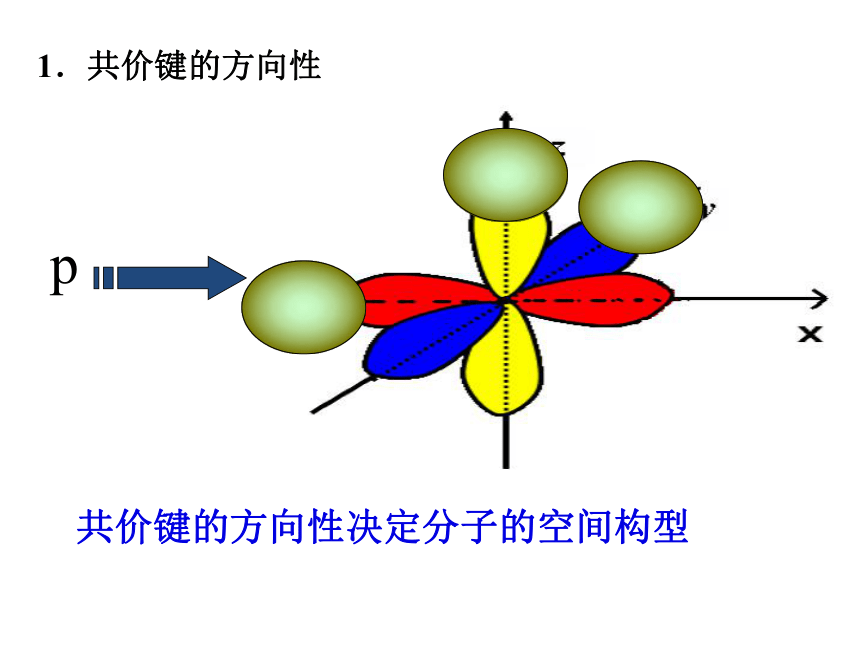
成键原子轨道在重叠时,沿轴线方向重叠程度最大。重叠程度越大,形成的共价键越稳定。
p
1.共价键的方向性
共价键的方向性决定分子的空间构型
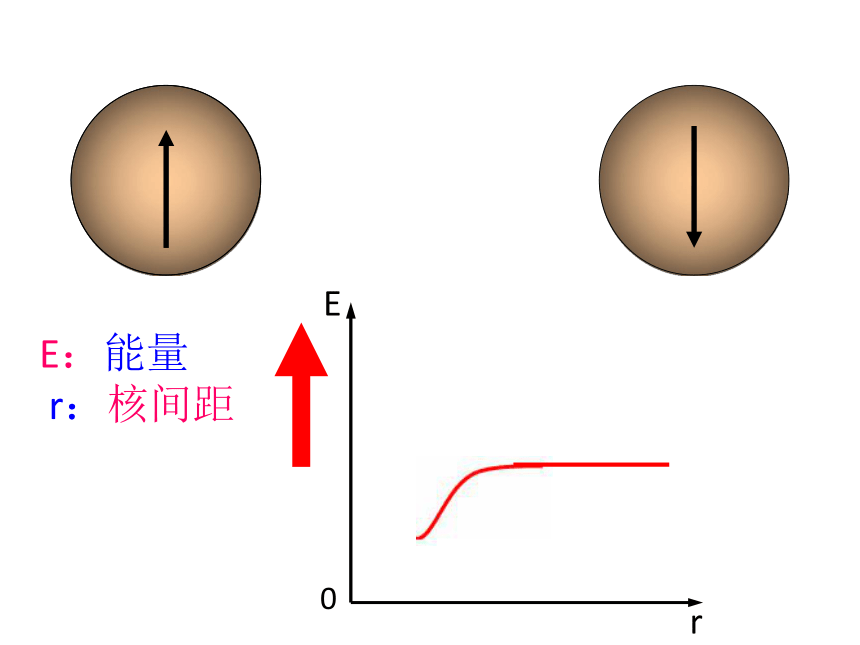
两个核外电子自旋方向相反的氢原子靠近
E
r
0
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
两个核外电子自旋方向相同的氢原子靠近
E
r
0
E:能量
r:核间距
2.价键理论的要点
(1)电子配对原理
两原子各自提供1个自旋方向相反的电子彼此配对。
(2)最大重叠原理
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
3.共价键的形成
H
H
H
H
氢原子形成氢分子的过程描述
↑
1S
↑
1S
H
?
?
H
1、未成对电子的原子轨道重叠程度最大时,共价键最强。
2、共价键的形成总是让未成对电子的原 子轨道的重叠程度最大。
H-Cl
H
Cl
氢原子和氯原子形成HCl的过程
Cl
?
?
?
?
?
?
?
H
?
↑
1S
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
氯原子形成氯分子的过程
Cl
Cl
Cl
Cl
Cl
?
?
?
?
?
?
?
Cl
?
?
?
?
?
?
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
σ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,称为 。
轴对称
S-S重叠
S-P重叠
P-P重叠
σ键原子轨道重叠方式 “头碰头”
σ键可以旋转
氮原子形成氮分子(N2) 形成过程
↑
↑
↑
↑↓
↑↓
1S
2S
2P
N
?
?
?
N
?
?
?
?
?
N
?
?
N
?
?
N
?
?
?
?
?
?
?
?
+
→
两个原子的p轨道“肩并肩”重叠形成共价键的过程
p-p
?键特征:?键的电子云分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为
“肩并肩”
镜面对称
π键
π键不能旋转
H
H
H-Cl
Cl
Cl
s-s σ键
s-pσ键
p-pσ键
p-pπ键
键类型 σ键 π键
重叠方式
对称方式
重叠程度
牢固程度
成键判断规律
头碰头
肩并肩
轴对称
镜面对称
σ键强度大,
不易断裂,不活泼
π键强度较小,
容易断裂,活泼
较大
较小
总结
共价单键都是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键
不同分子不同结构
性质稳定性不同
N2
CH3-CH3
HCl B. N2 C. H2S
D. C2H4 E. C2H2 F.H2O2
下列物质的分子中既有σ键又有π键的有:
各有几个σ键几个π键?
BDE
第二章 化学键与分子间作用力
第一节 共价键模型
第2课时 共价键键参数
1.键能
① 气态基态原子形成1mol化学键释放的最低能量。
键能越大,键越稳定。
破坏1mol化学键形成气态基态原子所需的最低能量。
② 单位:kJ·mol-1, 常用 EA-B 表示
保证释放能量最低
如:H—H 键能 436.0 kJ·mol-1 N≡N 键能 946.0 kJ·mol-1
1.键能
共价键 键能 共价键 键能
F-F 157 N-O 176
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
C-C 347.7 C-H 413.4
C=C 615 O-H 462.8
C≡C 812 N-H 390.8
C-O 351 H-F 568
C=O 745 H-Cl 431.8
N-N 193 H-Br 366
N=N 418 H-I 298.7
N≡N 946 H-H 436
键 键能 键 键能
F-F 157 N-O 176
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
C-C 347.7 C-H 413.4
C=C 615 O-H 462.8
C≡C 812 N-H 390.8
C-O 351 H-F 568
C=O 745 H-Cl 431.8
N-N 193 H-Br 366
N=N 418 H-I 298.7
N≡N 946 H-H 436
键能 EH-F>EH-Cl>EH-Br>EH-I
结构相似的分子中,化学键键能越大,分子越稳定。
稳定性 HF>HCl>HBr>HI
【学习活动1】键能与分子的稳定性关系
【练习1】由下表的数据判断下列分子的稳定性:
A.Cl2、Br2、I2 B.NH3、H2O
化学键 键能 化学键 键能
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
O-H 462.8 N-H 390.8
(1)概念:形成共价键的两个原子之间的核间距。
(2)应用:键长是衡量共价键稳定性的另一个参数。
2.键长
化学键 键能 键长 化学键 键能 键长
H-H 436 74 C≡C 812 120
F-F 157 141 C-H 413.4 109
Cl-Cl 242.7 198 O-H 462.8 96
Br-Br 193.7 228 N-H 390.8 101
I-I 152.7 267 N≡N 946 110
C-C 347.7 154 Si-Si 235
C=C 615 133 Si-O 162
卤素单质的键长与共价半径
两个共价键之间的夹角称为键角。
键角决定分子的空间构型。
键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。
3.键角
H2O 105°
NH3 107°
CO2 180°
CH4 109?28’
表明共价键具有方向性
【观察】下表中的数据
从表中可以看出,CO分子与N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子数,导致它们具有相似的化学结构。
分子 熔点/℃ 沸点/℃ 水中溶解度
(室温) 分子解离能
(kJ/mol) 分子的价电子总数
CO -205.05 -190.49 2.3 mL 1075 10
N2 -210.00 -195.81 1.6 mL 946 10
4.等电子体原理
(1)等电子体
原子总数相同、价电子总数相同的分子。
(2)等电子体原理
原子总数、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。(物理性质)
应用:预测分子空间的构型和性质。
防晒霜之所以能有效减轻紫外线对人体的伤害,原因之一就是它的有效成分的分子中含有π键。 π键是什么样的化学键,它又是怎么形成的呢?
防晒霜为何能防晒呢?
第二章 化学键与分子间作用力
第一节 共价键模型
第1课时 共价键
共价键
化学键:直接相邻的原子核离子之间存在的强烈的相互作用。
离子键:阴阳离子间的静电作用
共价键:原子间通过共用电子对形成的相互作用
成键微粒:原子
存在:
共价化合物、非金属单质、某些离子化合物
现代价键理论的基本要点
①电子配对原理:两原子各自提供1个自旋方向相反的电子彼此配对
②最大重叠原理:两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定
形成条件:电负性相同或电负性相差1.7以内的原子间
非金属原子间或不活泼的金属和非金属间
7
7
能层
2S 2P
1S
↑↓
↑↓
↑↓
↑↓
↑↓
能级:
能层与能级
3S 3P 3d
↑↓
↑↓
↑↓
↑
Cl
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
氯原子的电子排布图
↑
1S
H
↑↓
↑↓
1S
2S
↑
↑
↑
2P
N
原子轨道(电子云的轮廓图)
常把电子出
现的概率约为90%的空间圈出来
球形
轮廓图
电子云:电子在原子核外空间概率密度分布的形象描述
原子轨道:电子在原子核外的一个空间运动状态
一.共价键
1.共价键的饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键。
自旋相同
自旋相反
以HCl、H2O为例说明。
X
Z
√
成键原子轨道在重叠时,沿轴线方向重叠程度最大。重叠程度越大,形成的共价键越稳定。
p
1.共价键的方向性
共价键的方向性决定分子的空间构型
两个核外电子自旋方向相反的氢原子靠近
E
r
0
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
r0
E
r
0
r0 0.074nm
E:能量
r:核间距
两个核外电子自旋方向相同的氢原子靠近
E
r
0
E:能量
r:核间距
2.价键理论的要点
(1)电子配对原理
两原子各自提供1个自旋方向相反的电子彼此配对。
(2)最大重叠原理
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
3.共价键的形成
H
H
H
H
氢原子形成氢分子的过程描述
↑
1S
↑
1S
H
?
?
H
1、未成对电子的原子轨道重叠程度最大时,共价键最强。
2、共价键的形成总是让未成对电子的原 子轨道的重叠程度最大。
H-Cl
H
Cl
氢原子和氯原子形成HCl的过程
Cl
?
?
?
?
?
?
?
H
?
↑
1S
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
氯原子形成氯分子的过程
Cl
Cl
Cl
Cl
Cl
?
?
?
?
?
?
?
Cl
?
?
?
?
?
?
?
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
1S
2S
2P
3S
3P
σ键的特征:以形成化学键的两原子核的连线为轴作旋转操作,共价键电子云的图形不变,称为 。
轴对称
S-S重叠
S-P重叠
P-P重叠
σ键原子轨道重叠方式 “头碰头”
σ键可以旋转
氮原子形成氮分子(N2) 形成过程
↑
↑
↑
↑↓
↑↓
1S
2S
2P
N
?
?
?
N
?
?
?
?
?
N
?
?
N
?
?
N
?
?
?
?
?
?
?
?
+
→
两个原子的p轨道“肩并肩”重叠形成共价键的过程
p-p
?键特征:?键的电子云分别位于两原子核构成平面的两侧,如果以它们之间包含原子核的平面为镜面,它们互为镜像,称为
“肩并肩”
镜面对称
π键
π键不能旋转
H
H
H-Cl
Cl
Cl
s-s σ键
s-pσ键
p-pσ键
p-pπ键
键类型 σ键 π键
重叠方式
对称方式
重叠程度
牢固程度
成键判断规律
头碰头
肩并肩
轴对称
镜面对称
σ键强度大,
不易断裂,不活泼
π键强度较小,
容易断裂,活泼
较大
较小
总结
共价单键都是σ键;共价双键中一个是σ键,另一个是π键;共价三键中一个是σ键,另两个为π键
不同分子不同结构
性质稳定性不同
N2
CH3-CH3
HCl B. N2 C. H2S
D. C2H4 E. C2H2 F.H2O2
下列物质的分子中既有σ键又有π键的有:
各有几个σ键几个π键?
BDE
第二章 化学键与分子间作用力
第一节 共价键模型
第2课时 共价键键参数
1.键能
① 气态基态原子形成1mol化学键释放的最低能量。
键能越大,键越稳定。
破坏1mol化学键形成气态基态原子所需的最低能量。
② 单位:kJ·mol-1, 常用 EA-B 表示
保证释放能量最低
如:H—H 键能 436.0 kJ·mol-1 N≡N 键能 946.0 kJ·mol-1
1.键能
共价键 键能 共价键 键能
F-F 157 N-O 176
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
C-C 347.7 C-H 413.4
C=C 615 O-H 462.8
C≡C 812 N-H 390.8
C-O 351 H-F 568
C=O 745 H-Cl 431.8
N-N 193 H-Br 366
N=N 418 H-I 298.7
N≡N 946 H-H 436
键 键能 键 键能
F-F 157 N-O 176
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
C-C 347.7 C-H 413.4
C=C 615 O-H 462.8
C≡C 812 N-H 390.8
C-O 351 H-F 568
C=O 745 H-Cl 431.8
N-N 193 H-Br 366
N=N 418 H-I 298.7
N≡N 946 H-H 436
键能 EH-F>EH-Cl>EH-Br>EH-I
结构相似的分子中,化学键键能越大,分子越稳定。
稳定性 HF>HCl>HBr>HI
【学习活动1】键能与分子的稳定性关系
【练习1】由下表的数据判断下列分子的稳定性:
A.Cl2、Br2、I2 B.NH3、H2O
化学键 键能 化学键 键能
Cl-Cl 242.7 N=O 607
Br-Br 193.7 O-O 142
I-I 152.7 O=O 497.3
O-H 462.8 N-H 390.8
(1)概念:形成共价键的两个原子之间的核间距。
(2)应用:键长是衡量共价键稳定性的另一个参数。
2.键长
化学键 键能 键长 化学键 键能 键长
H-H 436 74 C≡C 812 120
F-F 157 141 C-H 413.4 109
Cl-Cl 242.7 198 O-H 462.8 96
Br-Br 193.7 228 N-H 390.8 101
I-I 152.7 267 N≡N 946 110
C-C 347.7 154 Si-Si 235
C=C 615 133 Si-O 162
卤素单质的键长与共价半径
两个共价键之间的夹角称为键角。
键角决定分子的空间构型。
键角一定,表明共价键具有方向性。键角是描述分子立体结构的重要参数,分子的许多性质与键角有关。
3.键角
H2O 105°
NH3 107°
CO2 180°
CH4 109?28’
表明共价键具有方向性
【观察】下表中的数据
从表中可以看出,CO分子与N2分子在许多性质上十分相似,这些相似性,可以归结为它们具有相等的价电子数,导致它们具有相似的化学结构。
分子 熔点/℃ 沸点/℃ 水中溶解度
(室温) 分子解离能
(kJ/mol) 分子的价电子总数
CO -205.05 -190.49 2.3 mL 1075 10
N2 -210.00 -195.81 1.6 mL 946 10
4.等电子体原理
(1)等电子体
原子总数相同、价电子总数相同的分子。
(2)等电子体原理
原子总数、价电子总数相同的分子具有相似的化学键特征,它们的许多性质是相近的。(物理性质)
应用:预测分子空间的构型和性质。
