科粤化学下册7.2 物质溶解的量(共37张PPT)
文档属性
| 名称 | 科粤化学下册7.2 物质溶解的量(共37张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 869.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 12:07:27 | ||
图片预览











文档简介
课件37张PPT。 7.2 物质溶解的量提出问题: 物质能不能无限制地溶解在一定量的水中呢?
课本P198观察活动一、饱和溶液与不饱和溶液1.定义:在一定温度下,在一定量的溶剂里,不能再溶解某物质的溶液,叫做这种溶质的饱和溶液;还能溶解某物质的溶液,叫做这种溶质的不饱和溶液。注意: (1)饱和溶液是“一定温度”、“一定量溶剂”条件下的饱和溶液。若改变温度或溶剂量,溶液就可能变为不饱和。(3)”饱和”的表现形式是“不能再溶解某种溶质”,即该条件下溶解的最大量。如下图判断溶液是否饱和(2)饱和溶液是一定条件下某一溶质的饱和溶液,但对于其它物质就不一定是饱和溶液了。所以,一定要指明是谁的饱和溶液。t(时间)某物质溶于水后,各阶段所得溶液如图……由c、b知,b中物质还在溶解,b为不饱和溶液;
由、c知,c中物质不再溶解,c、d为饱和溶液。2.溶液饱和的判定:在同种条件下,往溶液中加入少量原溶质 :
①有未溶解的溶质,且不再减少,则为饱和溶液
②没有未溶解的溶质(a.刚好饱和,b.不饱和) :再加少量的原溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。3.饱和溶液与不饱和溶液的相互转化:(1)对于大多数固体物质来说:(2)特殊情况:二.溶液的饱和与否和溶液浓稀的关系:(1)饱和溶液不一定是浓溶液;
不饱和溶液不一定是稀溶液。(2)同一温度下,某一溶质的
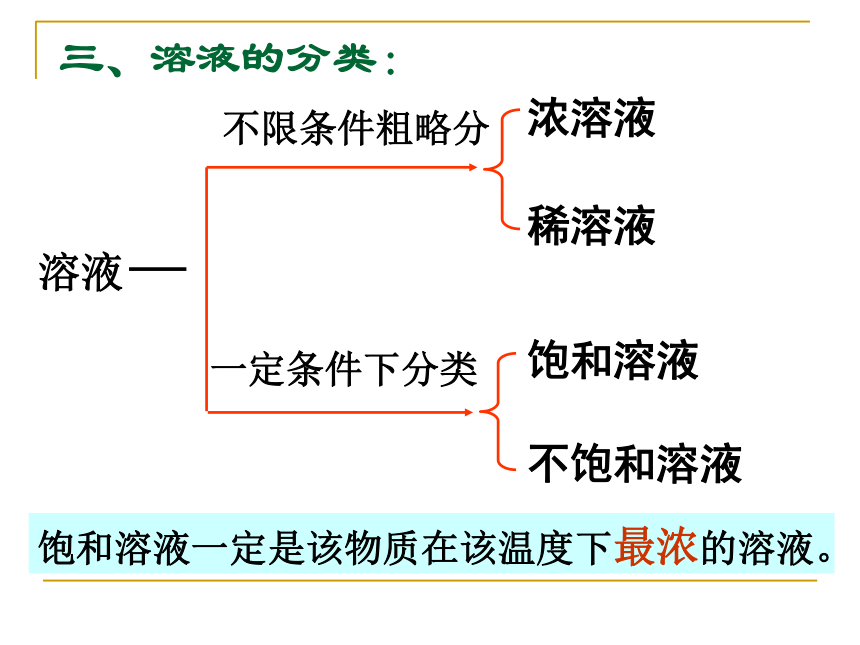
饱和溶液一定比不饱和溶液浓。溶液不限条件粗略分一定条件下分类浓溶液稀溶液饱和溶液不饱和溶液三、溶液的分类:饱和溶液一定是该物质在该温度下最浓的溶液。1、下列说法中,错误的是 ( )
A、在温度不变时,KNO3的饱和溶液不能再溶解KNO3
B、当温度升高时,饱和溶液一定能继续溶解溶质
C、稀溶液一定是不饱和溶液,浓溶液一定是饱和溶液
D、改变温度可以使不饱和溶液变成饱和溶液B、C巩 固 练 习3、室温下,向一定质量的氯化钠溶液中加入10克氯化钠固体,充分搅拌后,尚有部分未溶解,加入10克水后,固体全部溶解。下列判断正确的是 ( )
A、加水前一定是饱和溶液
B、加水前可能是饱和溶液
C、加水后一定是饱和溶液
D、加水后一定是不饱和溶液A4、在一定温度下,将一瓶接近饱和的硝酸钾溶液转化成饱和溶液的方法 ( )①升高温度②降低温度③增加溶质④增加溶剂⑤蒸发溶剂A、①②③B、②③⑤C、②③④D、③④⑤B5、使20℃的饱和食盐溶液变成不饱和溶液,可采取的措施是 ( )
A、加水 B、取出一些食盐溶液
C、加食盐 D、蒸发水A6、在一定温度下,一定量的水中,不断加入食盐晶体,能正确表示溶解的食盐质量m与时间t的关系的图象的是 ( )D7. 下列说法正确的是 ( )
A、凡是均一、稳定的液体都是溶液B、饱和溶液中的溶质一定比不饱和溶液的多C、析出晶体后的溶液一定是饱和溶液D、某物质的饱和溶液不能再溶解任何物质C8、下列有关从海水中提取食盐晶体的说法,错误的是 ( )A、属于化学变化B、属于物理变化C、得到纯净的食盐晶体D、得到不纯净的食盐晶体 AC9.下列有6种操作,选出其代号填入下列转化关系的横线处:
A.加KNO3晶体 B.加水 C.恒温下蒸发掉一些水 D. 升温 E.降温 F.加入较稀的KNO3溶液
KNO3的饱和溶液 KNO3不饱和溶液
B、D、FA、C、E 注意: a.对于大多数物质成立, 氢氧化钙例外。 b.所加溶质必须是同一种溶质。10.判断
①将5ml硝酸钾饱和溶液和5ml氯化钠饱和溶液均匀混合后的溶液仍是饱和溶液。
②从100ml硝酸钾饱和溶液中取出10ml,则该10ml溶液不再是饱和溶液。
③把40℃时的氯化钠饱和溶液降温到10℃,溶液就是10℃时的氯化钠饱和溶液。一、固体物质的溶解度:1.定义:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。注意:(1)条件:一定温度下(2)标准:100g溶剂(3)状态:饱和状态(4)单位:克(g)四要素,缺一不可2.溶解度的意义:表示在一定温度下,某固态物质在100克水中,
达到饱和状态时溶解的最大克数
例:下列对“20℃时,KNO3的溶解度为
31.6g”的解释正确的是 ( )
A. 20℃时,31.6gKNO3溶解在水里;
B. 20℃时,100g溶液中含有31.6gKNO3;
C. 31.6gKNO3在100g水中达到饱和状态
D. 20℃时,31.6gKNO3溶解在100g水中
恰好达到饱和状态。D(1)内因:溶质和溶剂本身的性质3.影响固体溶解度的因素:(2)外因:只与温度有关4.在一定的温度下,某物质的溶解度用S表示 则在饱和溶液中有:
M质: M剂:M液=S:100:(100+S)练习:1、20 ℃时NaCl溶解度是36克,则20 ℃时,NaCl饱和溶液中,溶质:溶剂:溶液的质量比=___________.
2、20 ℃时KNO3在水中的溶解度为31.6克,则溶剂:_______克,溶质______克,溶液:______克。
3、50 ℃NH4Cl溶解度为50克,则50 ℃时NH4Cl饱和溶液中溶质:溶剂:溶液的质量比_________.36:100:13610031.6131.61:2:3(1)20℃时,36g NaCl能溶解在100g水中,所以说, 20℃时NaCl的溶解度为36g(2)36g NaCl溶解在100g水中,达到饱和状态,所以说, NaCl的溶解度为36g(3)20℃时,18g NaCl溶解在50g水中恰和达到饱和状态,所以说, 20℃时NaCl的溶解度为18g(4)20℃时,18g NaCl溶解在50g水中恰好达到饱和状态,所以说, 20℃时NaCl的溶解度为36g。
4、判断下列说法是否正确,说明理由。5.固体溶解度与溶解性的关系:(1)溶解性:物质的溶解能力叫做溶解性。注意:①溶解性属于物质的物理性质;
②大小跟溶质和溶剂的性质有关;
③分类:难溶、微溶、可溶、易溶。 (2)溶解度和溶解性的关系:1、在200C,NaCl的溶解度是36g。在200C时,把20g NaCl投入50g水中,充分溶解后,下列有关说法不正确的是( )
A、制成了70g饱和溶液
B、制成了68g饱和溶液
C、有18g NaCl发生溶解
D、还剩余2g固体NaCl未溶解A练习3、在30℃时,50g水中最多能溶解8gA物质,在60℃时,100g水中最多能溶解10gB物质,则A比B的溶解度 。
(填“大”、“小”)大2、在200C,NaCl的溶解度是36g。 NaCl属于( )
A、易溶物 B、微溶物
C、可溶物 D、难溶物A5、60℃的硝酸钾饱和溶液蒸发水后再恢复到60℃,则杯底 ,溶液为 溶液,溶液的浓稀 。(填“变浓”、“变稀”、“不变”)有固体析出饱和不变4、60℃的硝酸钾饱和溶液降温至30℃,则杯底 ,溶液为 溶液,溶液的浓稀 。
(填“变浓”、“变稀”、“不变”)有固体析出饱和变稀结论:析出晶体后的溶液一定是该溶质的饱和
溶液,但是溶液的浓稀有可能发生变化。.....硝酸钾....硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.51101381692022461、定义:以温度为横坐标,溶解度为纵坐标形象地描绘出物质的溶解度随温度变化情况的曲线。一、溶解度曲线0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃温度/℃熟石灰的溶解度曲线:讨论:
固体物质溶解度受温度变化影响情况: 大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 少数固体物质溶解度受温度影响不大, 例如食盐。 极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
2.不同的物质溶解度受温度的影响是不同的
⑴大多数物质的溶解度随着温度的升高而增大
①影响很大:如NH4NO3,KNO3,NaNO3等,表现为曲线陡升
②影响不大:如NaCl、KCl、NH4Cl,表现为曲线平缓
⑵极少数物质的溶解度随着温度的升高而减小,如Ca(OH)2、Li2SO4等。表现为曲线下降 100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g59gA.B.3、B点表示什么意思?表示在该点所示的温度下,
NaNO3和KNO3的溶解度相等。 3.溶解度曲线图中的各点的意义(1)曲线上每个点表示某温度下某溶质的溶解度
换句话说: 溶解度曲线上的每个点都是该溶质在该温度下的一种饱和溶液。溶剂为100克。(2)两条曲线的交点,
表示在该温度下两种物质的溶解度相等(3)曲线下方的点表示
对应温度下该溶质的不饱和溶液。(4)曲线上方的点表示:以该数据配置的溶液在该温度下为饱和溶液,且有
未溶解完的溶质(或溶液处于“过饱和”状态)。100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于B.氯化铵、氯化钾、氯化钠、硼酸ABCMNSOtt1t2
1、t20C时,A、B、C的溶解度由大到小的顺序为 ;2、当三种固体物质饱和溶液接近饱和时,采用增加溶质、蒸发溶剂、升高温度的方法可达到饱和的是 ;3、M点的意义是 ;20g4、N点的意义为 ;A、B、CC A、B在 t10C时溶解度相等
A物质在 t20C时溶解度
为20g
二、气体的溶解度1. 概念:气体的溶解度是指某气体在压强为101.3kPa和一定温度时溶解在1体积溶剂中达到饱和状态时的体积2、气体的溶解度受压强和温度影响压强越大,气体的溶解度越大
例如:制汽水时加大压强使更多的二氧化碳溶于水中温度越高,气体的溶解度越小
例如:煮水至未沸之前,水中就有气泡冒出同种溶质在不同的溶 剂中的溶解能力不同不同的溶质在同种溶 剂中的溶解能力不同溶解性物质的溶解度定量描述易溶 、可溶 、 微溶 、 难(不)溶 固体的溶解度气体的溶解度影响因素(温度) 影响因素 (温度、压强)表示方法表示方法小结:
课本P198观察活动一、饱和溶液与不饱和溶液1.定义:在一定温度下,在一定量的溶剂里,不能再溶解某物质的溶液,叫做这种溶质的饱和溶液;还能溶解某物质的溶液,叫做这种溶质的不饱和溶液。注意: (1)饱和溶液是“一定温度”、“一定量溶剂”条件下的饱和溶液。若改变温度或溶剂量,溶液就可能变为不饱和。(3)”饱和”的表现形式是“不能再溶解某种溶质”,即该条件下溶解的最大量。如下图判断溶液是否饱和(2)饱和溶液是一定条件下某一溶质的饱和溶液,但对于其它物质就不一定是饱和溶液了。所以,一定要指明是谁的饱和溶液。t(时间)某物质溶于水后,各阶段所得溶液如图……由c、b知,b中物质还在溶解,b为不饱和溶液;
由、c知,c中物质不再溶解,c、d为饱和溶液。2.溶液饱和的判定:在同种条件下,往溶液中加入少量原溶质 :
①有未溶解的溶质,且不再减少,则为饱和溶液
②没有未溶解的溶质(a.刚好饱和,b.不饱和) :再加少量的原溶质,溶质能继续溶解的是不饱和溶液,不能溶解的是饱和溶液。3.饱和溶液与不饱和溶液的相互转化:(1)对于大多数固体物质来说:(2)特殊情况:二.溶液的饱和与否和溶液浓稀的关系:(1)饱和溶液不一定是浓溶液;
不饱和溶液不一定是稀溶液。(2)同一温度下,某一溶质的
饱和溶液一定比不饱和溶液浓。溶液不限条件粗略分一定条件下分类浓溶液稀溶液饱和溶液不饱和溶液三、溶液的分类:饱和溶液一定是该物质在该温度下最浓的溶液。1、下列说法中,错误的是 ( )
A、在温度不变时,KNO3的饱和溶液不能再溶解KNO3
B、当温度升高时,饱和溶液一定能继续溶解溶质
C、稀溶液一定是不饱和溶液,浓溶液一定是饱和溶液
D、改变温度可以使不饱和溶液变成饱和溶液B、C巩 固 练 习3、室温下,向一定质量的氯化钠溶液中加入10克氯化钠固体,充分搅拌后,尚有部分未溶解,加入10克水后,固体全部溶解。下列判断正确的是 ( )
A、加水前一定是饱和溶液
B、加水前可能是饱和溶液
C、加水后一定是饱和溶液
D、加水后一定是不饱和溶液A4、在一定温度下,将一瓶接近饱和的硝酸钾溶液转化成饱和溶液的方法 ( )①升高温度②降低温度③增加溶质④增加溶剂⑤蒸发溶剂A、①②③B、②③⑤C、②③④D、③④⑤B5、使20℃的饱和食盐溶液变成不饱和溶液,可采取的措施是 ( )
A、加水 B、取出一些食盐溶液
C、加食盐 D、蒸发水A6、在一定温度下,一定量的水中,不断加入食盐晶体,能正确表示溶解的食盐质量m与时间t的关系的图象的是 ( )D7. 下列说法正确的是 ( )
A、凡是均一、稳定的液体都是溶液B、饱和溶液中的溶质一定比不饱和溶液的多C、析出晶体后的溶液一定是饱和溶液D、某物质的饱和溶液不能再溶解任何物质C8、下列有关从海水中提取食盐晶体的说法,错误的是 ( )A、属于化学变化B、属于物理变化C、得到纯净的食盐晶体D、得到不纯净的食盐晶体 AC9.下列有6种操作,选出其代号填入下列转化关系的横线处:
A.加KNO3晶体 B.加水 C.恒温下蒸发掉一些水 D. 升温 E.降温 F.加入较稀的KNO3溶液
KNO3的饱和溶液 KNO3不饱和溶液
B、D、FA、C、E 注意: a.对于大多数物质成立, 氢氧化钙例外。 b.所加溶质必须是同一种溶质。10.判断
①将5ml硝酸钾饱和溶液和5ml氯化钠饱和溶液均匀混合后的溶液仍是饱和溶液。
②从100ml硝酸钾饱和溶液中取出10ml,则该10ml溶液不再是饱和溶液。
③把40℃时的氯化钠饱和溶液降温到10℃,溶液就是10℃时的氯化钠饱和溶液。一、固体物质的溶解度:1.定义:在一定温度下,某固态物质在100g溶剂中达到饱和状态时所溶解的质量,叫做这种物质在这种溶剂中的溶解度。注意:(1)条件:一定温度下(2)标准:100g溶剂(3)状态:饱和状态(4)单位:克(g)四要素,缺一不可2.溶解度的意义:表示在一定温度下,某固态物质在100克水中,
达到饱和状态时溶解的最大克数
例:下列对“20℃时,KNO3的溶解度为
31.6g”的解释正确的是 ( )
A. 20℃时,31.6gKNO3溶解在水里;
B. 20℃时,100g溶液中含有31.6gKNO3;
C. 31.6gKNO3在100g水中达到饱和状态
D. 20℃时,31.6gKNO3溶解在100g水中
恰好达到饱和状态。D(1)内因:溶质和溶剂本身的性质3.影响固体溶解度的因素:(2)外因:只与温度有关4.在一定的温度下,某物质的溶解度用S表示 则在饱和溶液中有:
M质: M剂:M液=S:100:(100+S)练习:1、20 ℃时NaCl溶解度是36克,则20 ℃时,NaCl饱和溶液中,溶质:溶剂:溶液的质量比=___________.
2、20 ℃时KNO3在水中的溶解度为31.6克,则溶剂:_______克,溶质______克,溶液:______克。
3、50 ℃NH4Cl溶解度为50克,则50 ℃时NH4Cl饱和溶液中溶质:溶剂:溶液的质量比_________.36:100:13610031.6131.61:2:3(1)20℃时,36g NaCl能溶解在100g水中,所以说, 20℃时NaCl的溶解度为36g(2)36g NaCl溶解在100g水中,达到饱和状态,所以说, NaCl的溶解度为36g(3)20℃时,18g NaCl溶解在50g水中恰和达到饱和状态,所以说, 20℃时NaCl的溶解度为18g(4)20℃时,18g NaCl溶解在50g水中恰好达到饱和状态,所以说, 20℃时NaCl的溶解度为36g。
4、判断下列说法是否正确,说明理由。5.固体溶解度与溶解性的关系:(1)溶解性:物质的溶解能力叫做溶解性。注意:①溶解性属于物质的物理性质;
②大小跟溶质和溶剂的性质有关;
③分类:难溶、微溶、可溶、易溶。 (2)溶解度和溶解性的关系:1、在200C,NaCl的溶解度是36g。在200C时,把20g NaCl投入50g水中,充分溶解后,下列有关说法不正确的是( )
A、制成了70g饱和溶液
B、制成了68g饱和溶液
C、有18g NaCl发生溶解
D、还剩余2g固体NaCl未溶解A练习3、在30℃时,50g水中最多能溶解8gA物质,在60℃时,100g水中最多能溶解10gB物质,则A比B的溶解度 。
(填“大”、“小”)大2、在200C,NaCl的溶解度是36g。 NaCl属于( )
A、易溶物 B、微溶物
C、可溶物 D、难溶物A5、60℃的硝酸钾饱和溶液蒸发水后再恢复到60℃,则杯底 ,溶液为 溶液,溶液的浓稀 。(填“变浓”、“变稀”、“不变”)有固体析出饱和不变4、60℃的硝酸钾饱和溶液降温至30℃,则杯底 ,溶液为 溶液,溶液的浓稀 。
(填“变浓”、“变稀”、“不变”)有固体析出饱和变稀结论:析出晶体后的溶液一定是该溶质的饱和
溶液,但是溶液的浓稀有可能发生变化。.....硝酸钾....硝酸钾在不同温度时的溶解度:13.331.620.945.863.985.51101381692022461、定义:以温度为横坐标,溶解度为纵坐标形象地描绘出物质的溶解度随温度变化情况的曲线。一、溶解度曲线0.050.100.150.2090704001020506080100300.050.100.150.209070400102050608010030温度/℃温度/℃熟石灰的溶解度曲线:讨论:
固体物质溶解度受温度变化影响情况: 大多数固体物质溶解度随温度升高而增大, 例如 硝酸钠、氯化铵等。 少数固体物质溶解度受温度影响不大, 例如食盐。 极少数固体物质溶解度随温度升高反而减小,例如熟石灰。
2.不同的物质溶解度受温度的影响是不同的
⑴大多数物质的溶解度随着温度的升高而增大
①影响很大:如NH4NO3,KNO3,NaNO3等,表现为曲线陡升
②影响不大:如NaCl、KCl、NH4Cl,表现为曲线平缓
⑵极少数物质的溶解度随着温度的升高而减小,如Ca(OH)2、Li2SO4等。表现为曲线下降 100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:1、横坐标60,纵坐标110 的A点表示什么意义? 练习:2、40℃时氯化铵的溶解度为______, 70℃时氯化铵的溶解度为______。 70℃时氯化钾的溶解度为____。47g44g59gA.B.3、B点表示什么意思?表示在该点所示的温度下,
NaNO3和KNO3的溶解度相等。 3.溶解度曲线图中的各点的意义(1)曲线上每个点表示某温度下某溶质的溶解度
换句话说: 溶解度曲线上的每个点都是该溶质在该温度下的一种饱和溶液。溶剂为100克。(2)两条曲线的交点,
表示在该温度下两种物质的溶解度相等(3)曲线下方的点表示
对应温度下该溶质的不饱和溶液。(4)曲线上方的点表示:以该数据配置的溶液在该温度下为饱和溶液,且有
未溶解完的溶质(或溶液处于“过饱和”状态)。100硼酸硝酸铵硝酸钠硝酸钾氯化铵氯化钾氯化钠6070501020304080901001101801701601501401301201902005010203040090607080温度/℃固体的溶解度曲线:68134g小于B.氯化铵、氯化钾、氯化钠、硼酸ABCMNSOtt1t2
1、t20C时,A、B、C的溶解度由大到小的顺序为 ;2、当三种固体物质饱和溶液接近饱和时,采用增加溶质、蒸发溶剂、升高温度的方法可达到饱和的是 ;3、M点的意义是 ;20g4、N点的意义为 ;A、B、CC A、B在 t10C时溶解度相等
A物质在 t20C时溶解度
为20g
二、气体的溶解度1. 概念:气体的溶解度是指某气体在压强为101.3kPa和一定温度时溶解在1体积溶剂中达到饱和状态时的体积2、气体的溶解度受压强和温度影响压强越大,气体的溶解度越大
例如:制汽水时加大压强使更多的二氧化碳溶于水中温度越高,气体的溶解度越小
例如:煮水至未沸之前,水中就有气泡冒出同种溶质在不同的溶 剂中的溶解能力不同不同的溶质在同种溶 剂中的溶解能力不同溶解性物质的溶解度定量描述易溶 、可溶 、 微溶 、 难(不)溶 固体的溶解度气体的溶解度影响因素(温度) 影响因素 (温度、压强)表示方法表示方法小结:
