科粤化学下册6.2金属的化学性质 课件(36张PPT)
文档属性
| 名称 | 科粤化学下册6.2金属的化学性质 课件(36张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 694.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 12:25:06 | ||
图片预览








文档简介
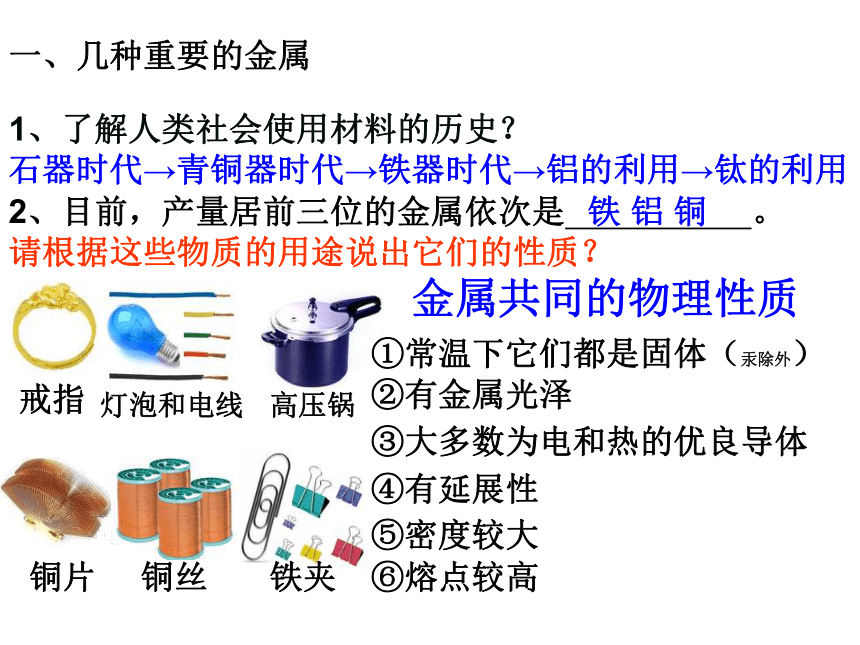
课件36张PPT。金属的化学性质1、了解人类社会使用材料的历史?2、目前,产量居前三位的金属依次是 。石器时代→青铜器时代→铁器时代→铝的利用→钛的利用铁 铝 铜请根据这些物质的用途说出它们的性质?金属共同的物理性质①常温下它们都是固体(汞除外)②有金属光泽③大多数为电和热的优良导体④有延展性⑤密度较大⑥熔点较高一、几种重要的金属问:请说出你是如何分辨出电线中的铜丝和铝丝? 铜呈紫红色,铝呈银白色不同金属的导电性、导热性、密度、熔点、硬度等物理性质 差别也较大。例如大多数金属都是银白色的, 但铜却呈 ,金呈 。
在常温下,大多数金属是固态,但汞是 。紫红色黄色液体(P4资料)地壳中含量最高的金属元素—— 铝Al
人体中含量最高的金属元素—— 钙Ca
目前世界年产量最高的金属—— 铁Fe
导电、导热性最好的金属—— 银Ag
硬度最高的金属—— 铬Cr 熔点最高的金属—— 钨W
熔点最低的金属—— 汞Hg 密度最大的金属—— 锇Os
密度最小的金属—— 锂Li一、金属与氧气的反应从反应条件角度考虑,铁与镁化学性质谁活泼? 铝在空气中可以发生缓慢氧化,在纯氧中点燃剧烈燃烧。(在空气中可以发生缓慢氧化,
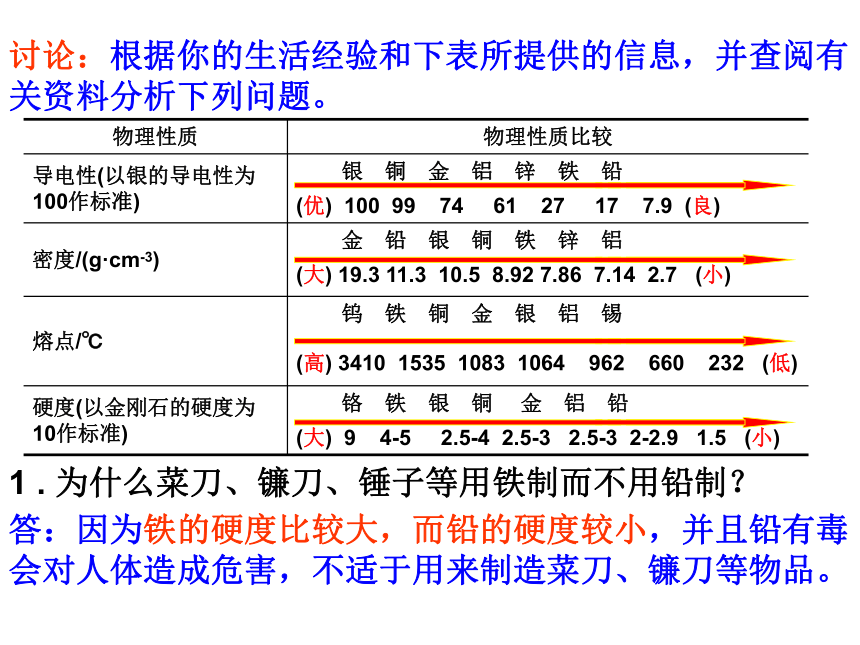
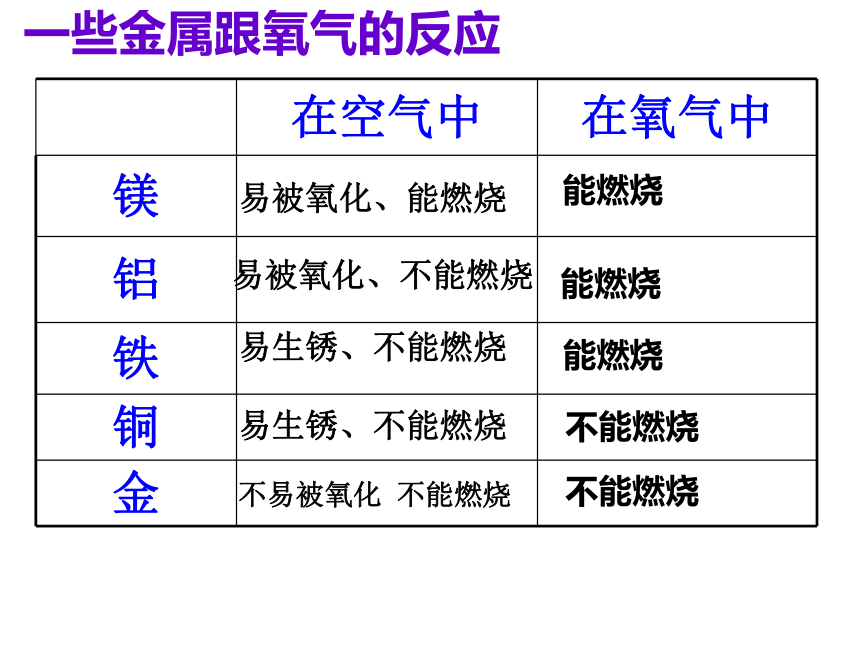
在空气中点燃剧烈燃烧)(在干燥的空气中不易氧化,在潮湿空气中易生锈;在纯氧中点燃剧烈燃烧)“真金不怕火炼”说明了金的化学性质怎样?金难以和氧气反应,说明金的化学性质不活泼点燃点燃点燃从反应条件角度考虑,铁与铝化学性质谁活泼?讨论:根据你的生活经验和下表所提供的信息,并查阅有关资料分析下列问题。1 . 为什么菜刀、镰刀、锤子等用铁制而不用铅制?答:因为铁的硬度比较大,而铅的硬度较小,并且铅有毒会对人体造成危害,不适于用来制造菜刀、镰刀等物品。讨论:根据你的生活经验和下表所提供的信息,并查阅有关资料分析下列问题。2 . 银的导电性比铜好,为什么电线一般用铜制而不用银制?银的价格昂贵,而且银的密度大,不易架设。一些金属跟氧气的反应易被氧化、能燃烧易被氧化、不能燃烧易生锈、不能燃烧易生锈、不能燃烧
能燃烧能燃烧 能燃烧 不能燃烧不易被氧化 不能燃烧 不能燃烧
(1)铝在常温下能与氧气反应,那么为什么我们用的铝制品有很好的抗腐蚀性? 铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3;在其表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢? 若用钢刷擦洗铝制品,容易把氧化薄膜擦掉,从而起不到保护作用。思考:讨论:从以下方程式你能得到哪些信息?(1) 4Al+3O2=2Al2O3 (2)2Cu+O2加热 2CuO (3) 2Mg+O2=2MgO (4)Au + O2 →不反应 (5) 3Fe+2 O2 点燃 Fe3 O4 综合上述信息可知:1.大多数金属都能与_______反应,但反应的难易和剧
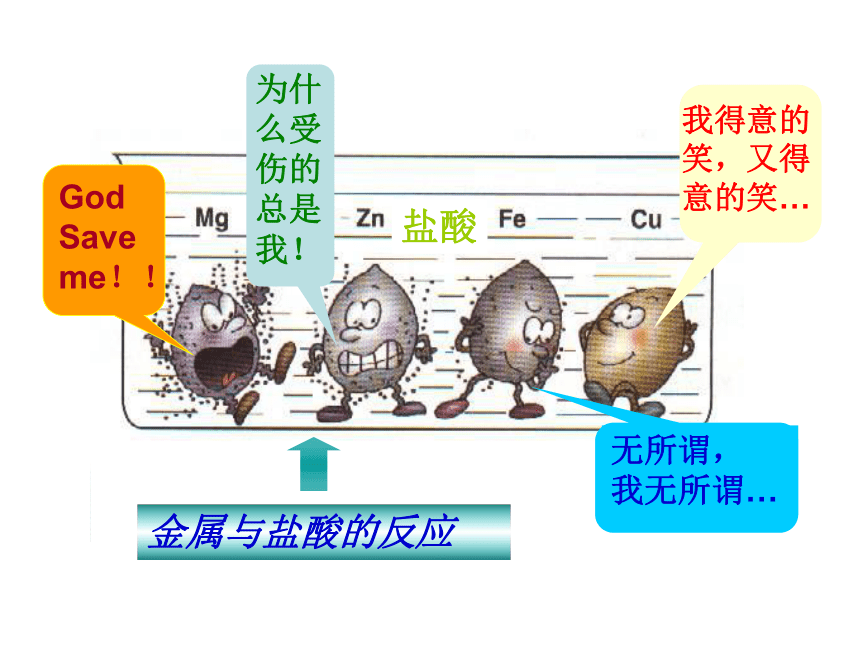
烈程度 ________(相同,不相同)2.金属的活动性:说明 _______ 较活泼,________次之, ______很不活泼 Au氧气不相同Mg、AlFe、Cu 我们能否设计其它的实验去证明Mg、Zn、Fe、Cu活动性的强弱呢?回忆实验室制取氢气的方法.Zn + H2SO4 = ZnSO4 + H2↑ 能否通过金属与酸反应的剧烈程度和放出气体的快慢来判断金属的活动性强弱呢? 在试管中分别加入少量镁带、锌粒、铁粉、铜片,再分别加少量稀盐酸或
硫酸,观察各组物质是否反应,有没有气泡,有没有放热现象,反应速度如何,
完成反应方程式。二、金属和酸的反应活动与探究:活动与探究一总结: 镁、锌、铁、铜与稀盐酸(稀硫酸)的反应P10无无铜有气泡产生,
反应速度慢铁有气泡产生,
反应速度一般锌有气泡产生,剧烈反应镁方程式现象Mg>Zn>Fe>Cu其顺序还可表示为:MgZnFe(H)Cu Ag稀H2SO4、稀盐酸结论:根据反应时是否有氢气产生,将金属分为活泼和不活泼金属 你能否得出金属和化合物溶液反应的一般规律呢?现象:_________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象? 铁钉表面会有红色物质析出,溶液会从蓝色变为
浅绿色。Fe + CuSO4 = Cu + FeSO4 该反应的化学方程式:三、金属与金属化合物溶液的反应铁与硫酸铜溶液的反应:
Fe + CuSO4 == FeSO4 + Cu提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明? 金属 金属的化合物的溶液 金属的化合物的溶液 金属活动与探究:活动与探究二总结:金属与金属化合物溶液的反应活动性:Al>Cu活动性:Cu>Ag活动性:CuCu>Ag金属活动性顺序KCaNaMgAlZnFeSnPb(H)CuHgAgPtAu由强逐渐减弱常见金属的活动性顺序: 1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。勤记忆判断依据与应用越在前面越活泼;
氢前金属置换氢;
金属之间互置换,溶液里面可探寻金属活动性顺序的探究探究活动1:
金属与酸
的反应探究活动2
金属与某些化合物的溶液反应单质化合物化合物单质小结:这种由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
讨论: 对于以上的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有何特点?将这一类反应与化合反应、分解反应进行比较。
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑单质+化合物=另一单质+另一化合物
置换反应:A + BC → AC + B(单换单)镁、锌、铁与酸反应的化学方程式比较Mg + 2 HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应单质+化合物==另一化合物+另一单质小 结:1、金属的化学性质:(1)大多数金属能与O2反应(2)大多数金属能与稀盐酸或稀硫酸反应(3)部分金属能与金属化合物的溶液反应2、判断常见金属活泼性的方法(1)金属与酸反应的剧烈程度(2)金属能否与金属化合物的溶液反应(3)金属与氧气反应的难易程度3、置换反应单质+化合物——新单质+新化合物基础能力训练: 1.判断下列物质间能不能发生置换反应
① Fe + CuSO4 ② Zn + Cu(NO3)2
③ Cu + AgCl(不溶)④ Cu + Mg(NO3)2
⑤ Zn + MgCl2 ⑥ Cu + Hg(NO3)2
2.有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y溶解而Z不溶,则三种金属的活动性顺序是( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B3. A、B、C三种金属,根据下列反应式中的关系:
①A+B(NO3)2 = A (NO3)2 + B
② C+ B(NO3)2 = C (NO3)2 + B
③ A+ H2SO4 (稀硫酸)= ASO4 + H2↑
④ C+ H2SO4 (稀硫酸) 不反应 试推断三种金属的活动顺序为 ( ) A.A>B>C B. A>C>B C.B>C>A D.C>A>B
4、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂是 ( )
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸BBD
友情提示 黄铜(铜锌合金)与黄金的外观很相似,一些不法商贩就会利用这一点,以次充好,贩卖假黄金(实际就是黄铜)。我们有什么方法来识别真金和假金呢?
1、取一小片金属放入稀盐酸( 或稀硫酸),若观察到金属表面有气泡产生、固体部分溶解,则说明这种金属为铜锌合金 ;若无明显现象,则该金属为黄金。2、取一小块金属,用天平称量其质量,用量筒和测定其体积,计算出金属块的密度,与黄金的密度对照,若密度相符,则为真金,若差异较大,则为黄铜。4、取少量金属块置于试管中,向试管中加入适量蓝色硫酸铜溶液,若金属表面出现红色物质且溶液颜色变浅,则原试样为黄铜,若无变化,则原试样为黄金。Zn + CuSO4 = ZnSO4 + Cu巩固训练
1.下列化学变化属于置换反应的有( )
(1)3CO+Fe2O3====2Fe+3CO2
(2)3C+2Fe2O3=====4Fe+3CO2
(3)2H2O2====2H2O+O2
(4)Fe+2AgNO3 ====Fe(NO3)2+2Ag高温高温MnO22、4
2、X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
①Z+YSO4==ZSO4+Y ②X+ YSO4==XSO4+Y
③X+ H2SO4== XSO4+ H2 ④Z+ H2SO4不反应
A、Z>X>Y B、Z>Y>X
C、X>Y>Z D、X>Z>Y
D1.判断下列物质能否发生反应?若能,写出相关
化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe提升训练
2、下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3B评价总结 通过这节课的学习你有哪些收获呢?
你呢?知 识 结 构:金属的化学性质一. 金属与氧气的反应4Al+3O2=2Al2O3
2Mg+O2=2MgO
3Fe+2 O2 点燃 Fe3 O4 二.金属与稀盐酸、稀硫酸反应
( 置换反应 )Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2 SO4 == Fe SO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2 SO4 == Zn SO4 + H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Mg + H2 SO4 == Mg SO4 + H2 ↑三.金属与某些化合物溶液反应
( 置换反应 )2Al + 3 CuSO4 == Al2( SO4 )3+ 3Cu
Cu + 2AgNO3 == Cu (NO3 )2 + 2Ag
Fe + CuSO4 == FeSO4 + Cu四.置换反应:由单质和化合物反应,生成单质和化合物的反应五.金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性,由强逐渐减弱。谢谢光临指导
在常温下,大多数金属是固态,但汞是 。紫红色黄色液体(P4资料)地壳中含量最高的金属元素—— 铝Al
人体中含量最高的金属元素—— 钙Ca
目前世界年产量最高的金属—— 铁Fe
导电、导热性最好的金属—— 银Ag
硬度最高的金属—— 铬Cr 熔点最高的金属—— 钨W
熔点最低的金属—— 汞Hg 密度最大的金属—— 锇Os
密度最小的金属—— 锂Li一、金属与氧气的反应从反应条件角度考虑,铁与镁化学性质谁活泼? 铝在空气中可以发生缓慢氧化,在纯氧中点燃剧烈燃烧。(在空气中可以发生缓慢氧化,
在空气中点燃剧烈燃烧)(在干燥的空气中不易氧化,在潮湿空气中易生锈;在纯氧中点燃剧烈燃烧)“真金不怕火炼”说明了金的化学性质怎样?金难以和氧气反应,说明金的化学性质不活泼点燃点燃点燃从反应条件角度考虑,铁与铝化学性质谁活泼?讨论:根据你的生活经验和下表所提供的信息,并查阅有关资料分析下列问题。1 . 为什么菜刀、镰刀、锤子等用铁制而不用铅制?答:因为铁的硬度比较大,而铅的硬度较小,并且铅有毒会对人体造成危害,不适于用来制造菜刀、镰刀等物品。讨论:根据你的生活经验和下表所提供的信息,并查阅有关资料分析下列问题。2 . 银的导电性比铜好,为什么电线一般用铜制而不用银制?银的价格昂贵,而且银的密度大,不易架设。一些金属跟氧气的反应易被氧化、能燃烧易被氧化、不能燃烧易生锈、不能燃烧易生锈、不能燃烧
能燃烧能燃烧 能燃烧 不能燃烧不易被氧化 不能燃烧 不能燃烧
(1)铝在常温下能与氧气反应,那么为什么我们用的铝制品有很好的抗腐蚀性? 铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3;在其表面形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性。(2)为何不宜用钢刷来擦洗铝制餐具呢? 若用钢刷擦洗铝制品,容易把氧化薄膜擦掉,从而起不到保护作用。思考:讨论:从以下方程式你能得到哪些信息?(1) 4Al+3O2=2Al2O3 (2)2Cu+O2加热 2CuO (3) 2Mg+O2=2MgO (4)Au + O2 →不反应 (5) 3Fe+2 O2 点燃 Fe3 O4 综合上述信息可知:1.大多数金属都能与_______反应,但反应的难易和剧
烈程度 ________(相同,不相同)2.金属的活动性:说明 _______ 较活泼,________次之, ______很不活泼 Au氧气不相同Mg、AlFe、Cu 我们能否设计其它的实验去证明Mg、Zn、Fe、Cu活动性的强弱呢?回忆实验室制取氢气的方法.Zn + H2SO4 = ZnSO4 + H2↑ 能否通过金属与酸反应的剧烈程度和放出气体的快慢来判断金属的活动性强弱呢? 在试管中分别加入少量镁带、锌粒、铁粉、铜片,再分别加少量稀盐酸或
硫酸,观察各组物质是否反应,有没有气泡,有没有放热现象,反应速度如何,
完成反应方程式。二、金属和酸的反应活动与探究:活动与探究一总结: 镁、锌、铁、铜与稀盐酸(稀硫酸)的反应P10无无铜有气泡产生,
反应速度慢铁有气泡产生,
反应速度一般锌有气泡产生,剧烈反应镁方程式现象Mg>Zn>Fe>Cu其顺序还可表示为:MgZnFe(H)Cu Ag稀H2SO4、稀盐酸结论:根据反应时是否有氢气产生,将金属分为活泼和不活泼金属 你能否得出金属和化合物溶液反应的一般规律呢?现象:_________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象? 铁钉表面会有红色物质析出,溶液会从蓝色变为
浅绿色。Fe + CuSO4 = Cu + FeSO4 该反应的化学方程式:三、金属与金属化合物溶液的反应铁与硫酸铜溶液的反应:
Fe + CuSO4 == FeSO4 + Cu提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明? 金属 金属的化合物的溶液 金属的化合物的溶液 金属活动与探究:活动与探究二总结:金属与金属化合物溶液的反应活动性:Al>Cu活动性:Cu>Ag活动性:Cu
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。勤记忆判断依据与应用越在前面越活泼;
氢前金属置换氢;
金属之间互置换,溶液里面可探寻金属活动性顺序的探究探究活动1:
金属与酸
的反应探究活动2
金属与某些化合物的溶液反应单质化合物化合物单质小结:这种由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应叫做置换反应。
讨论: 对于以上的反应,从反应物和生成物的物质类别如单质、化合物的角度分析,这些反应有何特点?将这一类反应与化合反应、分解反应进行比较。
Mg + 2HCl = MgCl2 + H2 ↑
Zn + 2HCl = ZnCl2 + H2 ↑
Fe + 2HCl = FeCl2 + H2 ↑单质+化合物=另一单质+另一化合物
置换反应:A + BC → AC + B(单换单)镁、锌、铁与酸反应的化学方程式比较Mg + 2 HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应单质+化合物==另一化合物+另一单质小 结:1、金属的化学性质:(1)大多数金属能与O2反应(2)大多数金属能与稀盐酸或稀硫酸反应(3)部分金属能与金属化合物的溶液反应2、判断常见金属活泼性的方法(1)金属与酸反应的剧烈程度(2)金属能否与金属化合物的溶液反应(3)金属与氧气反应的难易程度3、置换反应单质+化合物——新单质+新化合物基础能力训练: 1.判断下列物质间能不能发生置换反应
① Fe + CuSO4 ② Zn + Cu(NO3)2
③ Cu + AgCl(不溶)④ Cu + Mg(NO3)2
⑤ Zn + MgCl2 ⑥ Cu + Hg(NO3)2
2.有X、Y、Z三种金属,若将Z放入X的盐溶液中,Z表面覆盖有X,将Y和Z分别投入稀盐酸中,Y溶解而Z不溶,则三种金属的活动性顺序是( )
A. X>Y>Z B. Y>Z>X
C. Y>X>Z D. X>Z>Y
B3. A、B、C三种金属,根据下列反应式中的关系:
①A+B(NO3)2 = A (NO3)2 + B
② C+ B(NO3)2 = C (NO3)2 + B
③ A+ H2SO4 (稀硫酸)= ASO4 + H2↑
④ C+ H2SO4 (稀硫酸) 不反应 试推断三种金属的活动顺序为 ( ) A.A>B>C B. A>C>B C.B>C>A D.C>A>B
4、用实验证明Zn、Cu、Mg这三种金属的活动性顺序,选用的试剂是 ( )
A.MgCl2溶液 B.ZnSO4溶液 C.CuSO4溶液 D.稀硫酸BBD
友情提示 黄铜(铜锌合金)与黄金的外观很相似,一些不法商贩就会利用这一点,以次充好,贩卖假黄金(实际就是黄铜)。我们有什么方法来识别真金和假金呢?
1、取一小片金属放入稀盐酸( 或稀硫酸),若观察到金属表面有气泡产生、固体部分溶解,则说明这种金属为铜锌合金 ;若无明显现象,则该金属为黄金。2、取一小块金属,用天平称量其质量,用量筒和测定其体积,计算出金属块的密度,与黄金的密度对照,若密度相符,则为真金,若差异较大,则为黄铜。4、取少量金属块置于试管中,向试管中加入适量蓝色硫酸铜溶液,若金属表面出现红色物质且溶液颜色变浅,则原试样为黄铜,若无变化,则原试样为黄金。Zn + CuSO4 = ZnSO4 + Cu巩固训练
1.下列化学变化属于置换反应的有( )
(1)3CO+Fe2O3====2Fe+3CO2
(2)3C+2Fe2O3=====4Fe+3CO2
(3)2H2O2====2H2O+O2
(4)Fe+2AgNO3 ====Fe(NO3)2+2Ag高温高温MnO22、4
2、X、Y、Z是三种金属,根据下列有关化学方程式可知,三种金属的活动性顺序是( )
①Z+YSO4==ZSO4+Y ②X+ YSO4==XSO4+Y
③X+ H2SO4== XSO4+ H2 ④Z+ H2SO4不反应
A、Z>X>Y B、Z>Y>X
C、X>Y>Z D、X>Z>Y
D1.判断下列物质能否发生反应?若能,写出相关
化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液
(3)铜与硫酸锌溶液 (4)铝与硝酸银溶液
(5)银与氯化铜溶液 (6)镁与硫酸亚铁溶液
解答:可发生反应的:(2)(4)(6)
化学方程式:(2)Zn + CuSO4 = Cu + ZnSO4(4)Al +3AgNO3 = Al(NO3)3 + 3Ag(6)Mg + FeSO4 = MgSO4 +Fe提升训练
2、下列物质不能由金属和酸反应直接生成的是 ( )
A ZnCl2 B CuSO4
C FeCl2 D Al2(SO4)3B评价总结 通过这节课的学习你有哪些收获呢?
你呢?知 识 结 构:金属的化学性质一. 金属与氧气的反应4Al+3O2=2Al2O3
2Mg+O2=2MgO
3Fe+2 O2 点燃 Fe3 O4 二.金属与稀盐酸、稀硫酸反应
( 置换反应 )Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2 SO4 == Fe SO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2 SO4 == Zn SO4 + H2 ↑
Mg + 2HCl == MgCl2 + H2 ↑
Mg + H2 SO4 == Mg SO4 + H2 ↑三.金属与某些化合物溶液反应
( 置换反应 )2Al + 3 CuSO4 == Al2( SO4 )3+ 3Cu
Cu + 2AgNO3 == Cu (NO3 )2 + 2Ag
Fe + CuSO4 == FeSO4 + Cu四.置换反应:由单质和化合物反应,生成单质和化合物的反应五.金属活动性顺序: K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属活动性,由强逐渐减弱。谢谢光临指导
