科粤化学下册第6章1 金属材料的物理特性共52张PPT
文档属性
| 名称 | 科粤化学下册第6章1 金属材料的物理特性共52张PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 粤教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 16:04:18 | ||
图片预览











文档简介
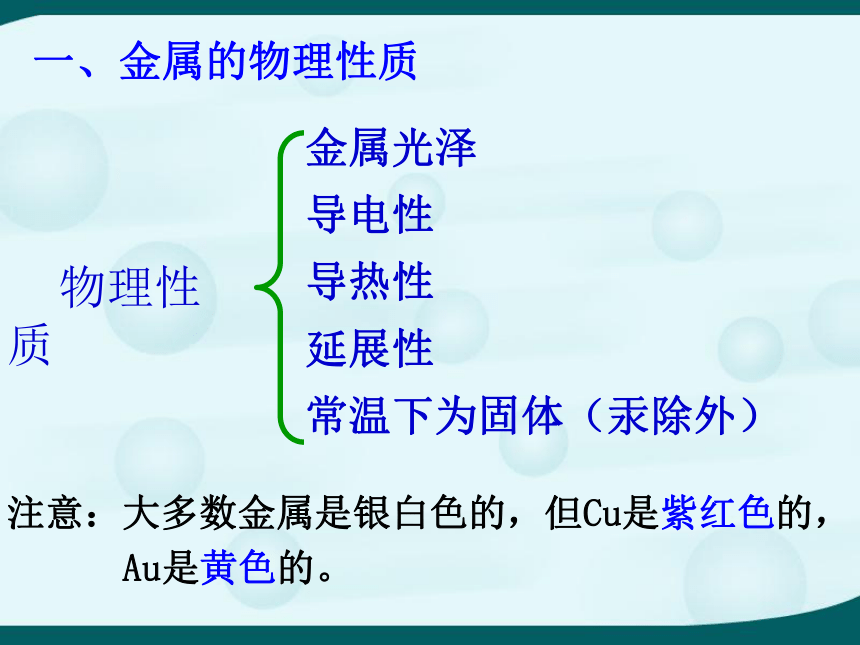
课件52张PPT。6.1 金属材料的物理特性司母戊鼎青铜器时代“青铜之冠”---秦陵铜车马马踏飞燕铁耙 铁器时代20世纪,铝和铝合金的应用衣---拉链,配饰,暗扣食---厨房用品住---建筑材料行---现代化的交通工具☆○☆○☆○☆○☆○☆○☆○☆○☆其实我们知道很多 你知道哪些金属?见过哪些金属?把它们的名称和元素符号写在下表中。思考: 这些金属制品有哪些相似的物理性质?☆○☆○☆○☆○☆○☆○☆○☆○☆有光泽 能导电 能抽成丝能延成薄片 能导热 能弯曲 物理性质金属光泽
导电性
导热性
延展性
常温下为固体(汞除外)注意:大多数金属是银白色的,但Cu是紫红色的,
Au是黄色的。一、金属的物理性质根据上表的信息可以知道:
最难熔的金属是___; 最易熔的金属是___;
最重的金属是_____; 最轻的金属是_____;
最硬的金属是_____; 最软的金属是 _____钨汞锇锂铬铯金属的其他化学之最人类最早发现和冶炼的金属──
目前世界年产量最高的金属──
地壳中含量最高的金属元素──
人体中含量最高的金属元素──
导电性、导热性最好的金属──
延性最好的金属──
展性最好的金属──铜铁铝钙银铂金讨论:1 . 为什么菜刀、镰刀、锤子等用铁制而不用铅制?2 . 银的导电性比铜好,为什么电线一般用铜制而不用银制?3 . 为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?4、为什么有的铁制品如水龙头等要镀铬?
如果镀金会怎样?一些金属的物理性质
考虑物质的用途时,性质不
是唯一因素,还需要考虑什么因素?
是否美观
价格
废料是否
易于回收使用
是否便利
资源对环境的
影响用来铸造硬币的金属材料需要具有什么性质?资源丰富无毒轻便耐磨耐腐蚀美观、易加工1.合金:是由一种金属与其他金属或者非金属熔合而成的具有金属特性的物质。二、神奇的合金特性合金的熔合方式:①金属与金属
②金属与非金属
③金属与金属,非金属2.合金的优点:合金跟组成的金属相比,硬度增大,熔点降低。有的合金还有强度大,耐腐蚀等特性。3.常见的合金:
生铁(Fe,C) 钢(Fe,C) 不锈钢(Fe,Cr,Ni)
黄铜( Cu,Zn)青铜( Cu,Sn)焊锡(Sn,Pb)
18K黄金(Au,Ag,Cu) 铝合金(Al,Cu,Mg,Si) 钛和钛合金被认为是21世纪的重要材料,它具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、机械性能好等。尤其是抗腐蚀性能非常好,即使把它们放在海水中数年,取出后仍光亮如新,其抗腐蚀性能远优于不锈钢,因此被广泛用于火箭、导弹、航天飞机、船舶、化工和通讯设备等。钛金属腕表钛合金 可作人造骨的钛合金形状记忆合金形状记忆合金是具有形状记忆效应的合金,被广泛应用于做人造卫星和宇宙飞船的天线,水暖系统、防火门和电路断电的自动控制开关,以及牙齿矫正等医疗材料。1、金属跟氧气的反应三、金属的化学性质a. Al和O2:常温,Al表面形成一层致密的氧化膜点燃, 铝在纯氧中燃烧发出耀眼的白光4Al + 3O2 ===2Al2O3点燃白色化学方程式:Al和O2化学方程式:3Fe+2O2====Fe3O4b. Fe和O2:常温,Fe在潮湿的空气中,缓慢氧化生成铁锈点燃, Fe在纯氧中燃烧,火星四射、生成黑色
固体、放出大量的热点燃c. Cu和O2: 2Cu + O2====2CuO铜在空气中加热表面变黑:Fe和O2Cu和O22、金属跟稀HCl(或稀硫酸)的反应2Al + 6HCl = 2AlCl3 + 3H2↑Mg + 2HCl = MgCl2 + H2↑Fe + 2HCl = FeCl2 + H2↑Cu + HCl =Zn + 2HCl = ZnCl2 + H2↑Ag + HCl =反应的剧烈
程度依次减弱溶液从无色变成浅绿色结论:能与酸反应并生成氢气的金属是较活泼的金属视频由上述的探究实验知道:铝、铁可以把酸中氢置换出来问:镁、锌与铁具体谁更活泼呢?Fe + CuSO4 = FeSO4 + Cu实验现象:铁钉表面有红色物质生成3、金属跟某些金属化合物溶液的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu蓝色浅绿色Cu+ 2AgNO3 = Cu(NO3)2 + 2AgCu + Al2(SO4)3 =Zn + CuSO4 = ZnSO4 + CuZnFe已知信息:2Al+3CuSO4= Al2(SO4)3+3Cu无明显现象 Cu+2AgNO3=Cu(NO3)2+2Ag铝、铜、银的活动性顺序 。表面有红色
物质生成表面有银白色
物质生成结论:一种金属A能把另一种金属B从他的化合
物溶液中置换出来,则该金属A相对于
金属B是较活泼的金属。铝>铜 > 银不反应,金属活动性:Cu K Ca Na Mg Al Zn Fe Sn Pb (H)Cu Hg Ag Pt Au金 属 活 动 性 由 强 渐 弱结论:
①排在越前的金属元素,金属活动性越强
②排在氢前的金属能与稀HCl(或稀H2SO4)反应生成氢气,越靠前反应速率越快
③排在前面的金属可以把排在后面的金属从他的盐溶液中置换出来。( K,Ca,Na除外)小结:
1.知道金属主要化学性质:
活泼金属多共性,与氧与酸易反应。
位前位后可置换,还要扣除KCaNa。
与盐反应也可以,但要溶液才反应。
2.金属活动性顺序:以氢为界,五字断句。
K Ca Na Mg Al
Zn Fe Sn Pb (H)
Cu Hg Au Pt Au练习1:根据金属活动性顺序判断下列反应能否发生Ag + H2SO4 =Mg + CuCl2 =Sn + HCl =Fe + ZnSO4 =Mg + ZnSO4 =MgSO4 + ZnMgCl2 + Cu练习2.下列盐能由金属与盐酸直接反应得到的是( )
A .CuCl2 B .FeCl3
C .AgCl D .MgCl2D我来看看这些化学方程式Mg + CuSO4 == MgSO4 + Cu
Fe + CuSO4 == FeSO4 + Cu
Zn + CuSO4 == ZnSO4 + Cu
2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
我们从反应物和生成物的类别(如单质、化合物)的角度来分析,这些反应有什么特点?
将这类反应和分解反应化合反应进行比较。单质单质化合物化合物上面的4个反应都属于置换反应你可以给置换反应下个定义吗?定义: 由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应Fe2O3 + 3H2 == 2Fe + 3H2O;
Fe3O4 + 4H2 == 3Fe + 4H2O;
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
2Mg + CO2 === 2MgO + C 这些是什么反应类型?点燃△△置换反应通式:A + BC = AC + B归纳小结与练习
1、金属有哪些主要的化学性质?
2、金属的活泼性可以用什么反应来判断?
3、什么叫做置换反应?它与分解反应和化合反应有哪些不同?金属活动性顺序的应用:例1.下列反应能否发生,为什么?
A. Mg+H2SO4=MgSO4+H2↑
B. Cu+2HCl=CuCl2+ H2↑
C. 2Fe+6HCl=2FeCl3+3H2↑
D. Zn+2HNO3=Zn(NO3)2+ H2↑
E. Cu+2AgCl==CuCl2+2Ag
F. 2Na+CuSO4==Cu+Na2SO4
G. Fe+Zn(NO3)2==Zn+Fe(NO3)21、判断置换反应能否发生例2. X、Y、Z三种金属,分别浸入稀硫酸中,只有Y溶解,X投入Z的盐溶液中有Z析出,则X、Y、Z的活动性关系正确的是( )
A . X>Y>Z B . X>Z>Y
C . Y>X>Z D . Y>Z>XC2、判断金属的活动性顺序例3:有X、Y、Z三种金属
1)X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;
2)将Y放入Z的化合物溶液中无变化;
3)Z放入Y的化合物溶液中有Y析出:
则:(1)X、Y、Z的活动性顺序如何?
(2)科学家将氢的活动性与金属活动性进行比较并排序,当氢也排在里边时,活动性顺序如何?X > Z > YX >H> Z > Y3、判断反应后产物例4. 向硝酸铜溶液中加入一定量的铁粉充分反应,下列情况可能出现的是( )
A . 溶液中有Fe2+、Cu2+ ,不溶物为Cu
B . 溶液中有Fe2+、Cu2+ ,不溶物为Fe
C . 溶液中只有Cu2+ ,不溶物为Fe
D . 溶液中只有Fe2+,不溶物为Fe、 Cu AD例5. 向硝酸银、硝酸铜的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体产生,则滤出的固体一定为( )Ag、Cu、Fe的混合物①一种金属与多种盐溶液反应时,首先发生反应的是活动性最弱的金属离子,待最弱的完全反应后,第二弱的才能反应。例6. 将一包镁铝的混合粉末加入到盛FeCl2溶液的烧杯中,充分反应,下列说法正确的是( )
A.滤液为MgCl2时,滤渣为Fe、Al
B.滤液为MgCl2、FeCl2时,滤渣为Fe、Mg、Al
C.滤液为MgCl2、AlCl3、FeCl2时,滤渣为Fe,Al
D.滤液为MgCl2、AlCl3时,滤渣为FeAD②多种金属与一种盐溶液反应时,首先发生反应的是活动性最强的金属,待最强的完全反应后,第二强的才能反应。4、判断反应后固体或溶液的质量变化例7.把铁片分别放入下列各物质的溶液中
,片刻后取出,溶液质量增加的是( )
A.硫酸铝 B.硫酸铜
C.硫酸 D.硝酸银
Fe→Cu Fe→H2
56 64 56 2
Fe+2AgNO3=Fe(NO3)2+2Ag
56 2×108 C例8.铁钉投入下列溶液中,反应一段时间后固体质量增加的是( )
溶液质量增加的是( )
A.稀硫酸 B.硫酸铜溶液
C.氯化镁溶液 D.稀盐酸
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
Fe+CuSO4=FeSO4+Cu
56 160 152 64BAD5、产生氢气量多少的判断①产生等量的氢气,消耗金属质量的比较例9.把足量的Mg、Al、Fe、Zn分别放入质量分数
完全相同的稀硫酸中,产生氢气的量( )
消耗金属的量( )
2Al → 3H2 Mg → H2
2×27 3×2 24 2
9 1 12 1
Fe → H2 Zn → H2
56 2 65 2
28 1 32.5 1一样多Al﹤Mg﹤Fe﹤Zn②等量的金属与酸反应,产生氢气量的比较例10.把等量的Mg、Al、Fe、Zn分别放入质量分数完全相同的足量的稀硫酸中,产生氢气的量由多到少顺序( )
2Al → 3H2 Mg → H2
2×27 3×2 24 2
1 1/9 1 1/12
Fe → H2 Zn → H2
56 2 65 2
1 1/28 1 1/32.5Al﹥Mg﹥Fe﹥Zn例11.某不纯的铁块5.6g与足量的稀盐酸反应,全部溶解,放出氢气为0.21g,则铁块可能含有的杂质( )
Cu B. Zn C. C D. Mg
Fe → H2 Cu → H2
5.6 0.2 6.4 0.2
Zn → H2 Mg → H2
6.5 0.2 2.4 0.2D6、图象①向足量的稀盐酸中加入等质量的Zn和Fe
②向三分完全相同的稀盐酸中分别投入过量的
Mg、Al、Fe
③等质量的Na、Mg与足量的稀盐酸反应
④向等量的稀盐酸中分别加足量的Na、Mg⑤将质量相等的ABC三种金属同时分别放入三份完全相同的足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图,根据图中提供信息回答:
1)放出氢气质量————
2)相对原子质量————
3)反应速率————
4)金属活动性顺序————等质量的硫酸与足量不同的金属反应,生成的氢气质量相同镁、锌、铁都是活泼金属3种金属的活动性为Mg>Zn>Fe例12.足量的镁、锌、铁分别与相同质量、相同质量分数的稀硫酸充分反应,生成氢气的质量与反应时间的关系如图。分析图像后可得出的结论有:下课啦
导电性
导热性
延展性
常温下为固体(汞除外)注意:大多数金属是银白色的,但Cu是紫红色的,
Au是黄色的。一、金属的物理性质根据上表的信息可以知道:
最难熔的金属是___; 最易熔的金属是___;
最重的金属是_____; 最轻的金属是_____;
最硬的金属是_____; 最软的金属是 _____钨汞锇锂铬铯金属的其他化学之最人类最早发现和冶炼的金属──
目前世界年产量最高的金属──
地壳中含量最高的金属元素──
人体中含量最高的金属元素──
导电性、导热性最好的金属──
延性最好的金属──
展性最好的金属──铜铁铝钙银铂金讨论:1 . 为什么菜刀、镰刀、锤子等用铁制而不用铅制?2 . 银的导电性比铜好,为什么电线一般用铜制而不用银制?3 . 为什么灯泡里的灯丝用钨制而不用锡制?如果用锡制的话,可能会出现什么情况?4、为什么有的铁制品如水龙头等要镀铬?
如果镀金会怎样?一些金属的物理性质
考虑物质的用途时,性质不
是唯一因素,还需要考虑什么因素?
是否美观
价格
废料是否
易于回收使用
是否便利
资源对环境的
影响用来铸造硬币的金属材料需要具有什么性质?资源丰富无毒轻便耐磨耐腐蚀美观、易加工1.合金:是由一种金属与其他金属或者非金属熔合而成的具有金属特性的物质。二、神奇的合金特性合金的熔合方式:①金属与金属
②金属与非金属
③金属与金属,非金属2.合金的优点:合金跟组成的金属相比,硬度增大,熔点降低。有的合金还有强度大,耐腐蚀等特性。3.常见的合金:
生铁(Fe,C) 钢(Fe,C) 不锈钢(Fe,Cr,Ni)
黄铜( Cu,Zn)青铜( Cu,Sn)焊锡(Sn,Pb)
18K黄金(Au,Ag,Cu) 铝合金(Al,Cu,Mg,Si) 钛和钛合金被认为是21世纪的重要材料,它具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、机械性能好等。尤其是抗腐蚀性能非常好,即使把它们放在海水中数年,取出后仍光亮如新,其抗腐蚀性能远优于不锈钢,因此被广泛用于火箭、导弹、航天飞机、船舶、化工和通讯设备等。钛金属腕表钛合金 可作人造骨的钛合金形状记忆合金形状记忆合金是具有形状记忆效应的合金,被广泛应用于做人造卫星和宇宙飞船的天线,水暖系统、防火门和电路断电的自动控制开关,以及牙齿矫正等医疗材料。1、金属跟氧气的反应三、金属的化学性质a. Al和O2:常温,Al表面形成一层致密的氧化膜点燃, 铝在纯氧中燃烧发出耀眼的白光4Al + 3O2 ===2Al2O3点燃白色化学方程式:Al和O2化学方程式:3Fe+2O2====Fe3O4b. Fe和O2:常温,Fe在潮湿的空气中,缓慢氧化生成铁锈点燃, Fe在纯氧中燃烧,火星四射、生成黑色
固体、放出大量的热点燃c. Cu和O2: 2Cu + O2====2CuO铜在空气中加热表面变黑:Fe和O2Cu和O22、金属跟稀HCl(或稀硫酸)的反应2Al + 6HCl = 2AlCl3 + 3H2↑Mg + 2HCl = MgCl2 + H2↑Fe + 2HCl = FeCl2 + H2↑Cu + HCl =Zn + 2HCl = ZnCl2 + H2↑Ag + HCl =反应的剧烈
程度依次减弱溶液从无色变成浅绿色结论:能与酸反应并生成氢气的金属是较活泼的金属视频由上述的探究实验知道:铝、铁可以把酸中氢置换出来问:镁、锌与铁具体谁更活泼呢?Fe + CuSO4 = FeSO4 + Cu实验现象:铁钉表面有红色物质生成3、金属跟某些金属化合物溶液的反应2Al + 3CuSO4 = Al2(SO4)3 + 3Cu蓝色浅绿色Cu+ 2AgNO3 = Cu(NO3)2 + 2AgCu + Al2(SO4)3 =Zn + CuSO4 = ZnSO4 + CuZnFe已知信息:2Al+3CuSO4= Al2(SO4)3+3Cu无明显现象 Cu+2AgNO3=Cu(NO3)2+2Ag铝、铜、银的活动性顺序 。表面有红色
物质生成表面有银白色
物质生成结论:一种金属A能把另一种金属B从他的化合
物溶液中置换出来,则该金属A相对于
金属B是较活泼的金属。铝>铜 > 银不反应,金属活动性:Cu
①排在越前的金属元素,金属活动性越强
②排在氢前的金属能与稀HCl(或稀H2SO4)反应生成氢气,越靠前反应速率越快
③排在前面的金属可以把排在后面的金属从他的盐溶液中置换出来。( K,Ca,Na除外)小结:
1.知道金属主要化学性质:
活泼金属多共性,与氧与酸易反应。
位前位后可置换,还要扣除KCaNa。
与盐反应也可以,但要溶液才反应。
2.金属活动性顺序:以氢为界,五字断句。
K Ca Na Mg Al
Zn Fe Sn Pb (H)
Cu Hg Au Pt Au练习1:根据金属活动性顺序判断下列反应能否发生Ag + H2SO4 =Mg + CuCl2 =Sn + HCl =Fe + ZnSO4 =Mg + ZnSO4 =MgSO4 + ZnMgCl2 + Cu练习2.下列盐能由金属与盐酸直接反应得到的是( )
A .CuCl2 B .FeCl3
C .AgCl D .MgCl2D我来看看这些化学方程式Mg + CuSO4 == MgSO4 + Cu
Fe + CuSO4 == FeSO4 + Cu
Zn + CuSO4 == ZnSO4 + Cu
2Al + 3CuSO4 == Al2(SO4)3 + 3Cu
我们从反应物和生成物的类别(如单质、化合物)的角度来分析,这些反应有什么特点?
将这类反应和分解反应化合反应进行比较。单质单质化合物化合物上面的4个反应都属于置换反应你可以给置换反应下个定义吗?定义: 由一种单质跟一种化合物作用生成另一种单质和另一种化合物,这样的反应叫做置换反应Fe2O3 + 3H2 == 2Fe + 3H2O;
Fe3O4 + 4H2 == 3Fe + 4H2O;
Cu + 2AgNO3 == Cu(NO3)2 + 2Ag
2Mg + CO2 === 2MgO + C 这些是什么反应类型?点燃△△置换反应通式:A + BC = AC + B归纳小结与练习
1、金属有哪些主要的化学性质?
2、金属的活泼性可以用什么反应来判断?
3、什么叫做置换反应?它与分解反应和化合反应有哪些不同?金属活动性顺序的应用:例1.下列反应能否发生,为什么?
A. Mg+H2SO4=MgSO4+H2↑
B. Cu+2HCl=CuCl2+ H2↑
C. 2Fe+6HCl=2FeCl3+3H2↑
D. Zn+2HNO3=Zn(NO3)2+ H2↑
E. Cu+2AgCl==CuCl2+2Ag
F. 2Na+CuSO4==Cu+Na2SO4
G. Fe+Zn(NO3)2==Zn+Fe(NO3)21、判断置换反应能否发生例2. X、Y、Z三种金属,分别浸入稀硫酸中,只有Y溶解,X投入Z的盐溶液中有Z析出,则X、Y、Z的活动性关系正确的是( )
A . X>Y>Z B . X>Z>Y
C . Y>X>Z D . Y>Z>XC2、判断金属的活动性顺序例3:有X、Y、Z三种金属
1)X、Y、Z分别放入稀盐酸中,X溶解并放出氢气,Y、Z无变化;
2)将Y放入Z的化合物溶液中无变化;
3)Z放入Y的化合物溶液中有Y析出:
则:(1)X、Y、Z的活动性顺序如何?
(2)科学家将氢的活动性与金属活动性进行比较并排序,当氢也排在里边时,活动性顺序如何?X > Z > YX >H> Z > Y3、判断反应后产物例4. 向硝酸铜溶液中加入一定量的铁粉充分反应,下列情况可能出现的是( )
A . 溶液中有Fe2+、Cu2+ ,不溶物为Cu
B . 溶液中有Fe2+、Cu2+ ,不溶物为Fe
C . 溶液中只有Cu2+ ,不溶物为Fe
D . 溶液中只有Fe2+,不溶物为Fe、 Cu AD例5. 向硝酸银、硝酸铜的混合溶液中加入一定量的铁粉,充分反应后过滤,向滤出的固体中滴加稀硫酸,有气体产生,则滤出的固体一定为( )Ag、Cu、Fe的混合物①一种金属与多种盐溶液反应时,首先发生反应的是活动性最弱的金属离子,待最弱的完全反应后,第二弱的才能反应。例6. 将一包镁铝的混合粉末加入到盛FeCl2溶液的烧杯中,充分反应,下列说法正确的是( )
A.滤液为MgCl2时,滤渣为Fe、Al
B.滤液为MgCl2、FeCl2时,滤渣为Fe、Mg、Al
C.滤液为MgCl2、AlCl3、FeCl2时,滤渣为Fe,Al
D.滤液为MgCl2、AlCl3时,滤渣为FeAD②多种金属与一种盐溶液反应时,首先发生反应的是活动性最强的金属,待最强的完全反应后,第二强的才能反应。4、判断反应后固体或溶液的质量变化例7.把铁片分别放入下列各物质的溶液中
,片刻后取出,溶液质量增加的是( )
A.硫酸铝 B.硫酸铜
C.硫酸 D.硝酸银
Fe→Cu Fe→H2
56 64 56 2
Fe+2AgNO3=Fe(NO3)2+2Ag
56 2×108 C例8.铁钉投入下列溶液中,反应一段时间后固体质量增加的是( )
溶液质量增加的是( )
A.稀硫酸 B.硫酸铜溶液
C.氯化镁溶液 D.稀盐酸
Fe+H2SO4=FeSO4+H2↑
56 98 152 2
Fe+CuSO4=FeSO4+Cu
56 160 152 64BAD5、产生氢气量多少的判断①产生等量的氢气,消耗金属质量的比较例9.把足量的Mg、Al、Fe、Zn分别放入质量分数
完全相同的稀硫酸中,产生氢气的量( )
消耗金属的量( )
2Al → 3H2 Mg → H2
2×27 3×2 24 2
9 1 12 1
Fe → H2 Zn → H2
56 2 65 2
28 1 32.5 1一样多Al﹤Mg﹤Fe﹤Zn②等量的金属与酸反应,产生氢气量的比较例10.把等量的Mg、Al、Fe、Zn分别放入质量分数完全相同的足量的稀硫酸中,产生氢气的量由多到少顺序( )
2Al → 3H2 Mg → H2
2×27 3×2 24 2
1 1/9 1 1/12
Fe → H2 Zn → H2
56 2 65 2
1 1/28 1 1/32.5Al﹥Mg﹥Fe﹥Zn例11.某不纯的铁块5.6g与足量的稀盐酸反应,全部溶解,放出氢气为0.21g,则铁块可能含有的杂质( )
Cu B. Zn C. C D. Mg
Fe → H2 Cu → H2
5.6 0.2 6.4 0.2
Zn → H2 Mg → H2
6.5 0.2 2.4 0.2D6、图象①向足量的稀盐酸中加入等质量的Zn和Fe
②向三分完全相同的稀盐酸中分别投入过量的
Mg、Al、Fe
③等质量的Na、Mg与足量的稀盐酸反应
④向等量的稀盐酸中分别加足量的Na、Mg⑤将质量相等的ABC三种金属同时分别放入三份完全相同的足量的稀盐酸中,反应生成氢气的质量与反应时间的关系如图,根据图中提供信息回答:
1)放出氢气质量————
2)相对原子质量————
3)反应速率————
4)金属活动性顺序————等质量的硫酸与足量不同的金属反应,生成的氢气质量相同镁、锌、铁都是活泼金属3种金属的活动性为Mg>Zn>Fe例12.足量的镁、锌、铁分别与相同质量、相同质量分数的稀硫酸充分反应,生成氢气的质量与反应时间的关系如图。分析图像后可得出的结论有:下课啦
