人教版 选修3 高二化学 第一章 1.1原子结构 教学课件(共41张ppt)
文档属性
| 名称 | 人教版 选修3 高二化学 第一章 1.1原子结构 教学课件(共41张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 10:50:54 | ||
图片预览











文档简介
(共41张PPT)
大千世界无所不有
导入新课
为什么它们会拥有不同的性质?
想一想
?
回忆
1. 化学变化中最小的微粒是什么?
2. 原子能否再分呢?原子如何构成?
3. 原子和原子核的相对空间位置是怎样的呢?它们体积大小如何?
4. 原子核的构成如何?
5. 质子、中子、电子的特点如何?
1.1.1 原子的诞生
1.1.2 能层与能级
1.1.3 构造原理与电子排布式
1.1.4 能量最低原理、
基态与激发态、光谱
1.1.5 电子云和电子轨道
1.1.6 泡利原理和洪特规则
第一节 原子结构
4.了解泡沫原理和洪特规则。
1.根据构造原理写出1~36号元素原子的电子排布式;
2. 核外电子的运动状态,电子云和电子轨道;
3.基态、激发态与光谱;
1.知识与能力
教学目标
2.过程与方法
充分利用教材提供的图、表等资料,借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。
在分析原子结构时,鼓励主动与他人进行交流和讨 论,清楚地表达自己的观点,逐步形成良好的学习习惯和学习方法。
3.情感态度与价值观
从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
重点
根据构造原理写出1~36号元素原子的电子排布式;核外电子的运动状态,电子云和电子轨道;泡利原理、洪特规则。
难点
1.电子云与原子轨道;
2.基态、激发态与光谱。
教学重难点
宇宙大爆炸促使氢、氦原子合成其它原子!
1.1.1 原子的诞生
原子结构理论模型发展史:
道尔顿的原子模型 (错)
——微小的、不可再分的实心球体。
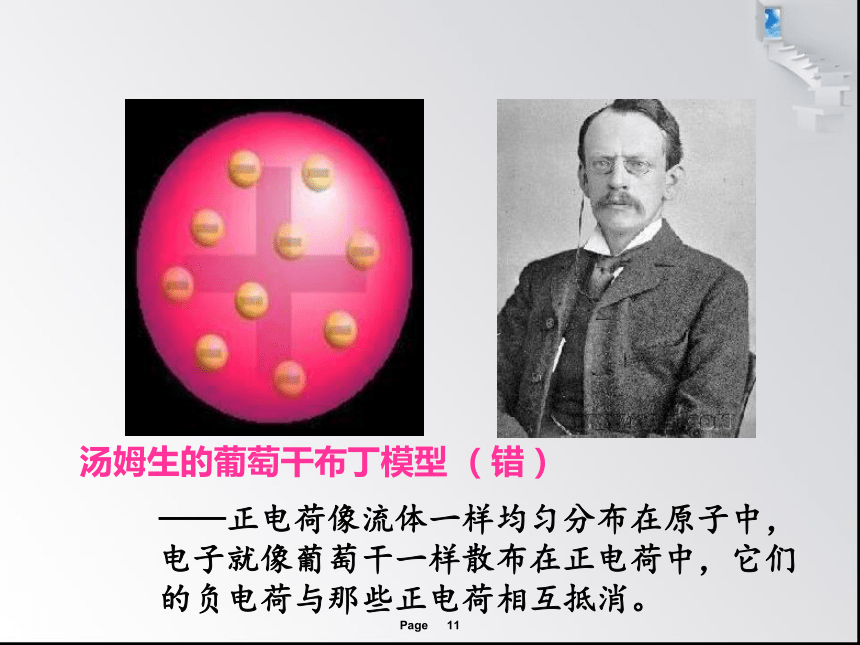
汤姆生的葡萄干布丁模型 (错)
——正电荷像流体一样均匀分布在原子中,电子就像葡萄干一样散布在正电荷中,它们的负电荷与那些正电荷相互抵消。
日本科学家的土星模型(错)
——电子并不是均匀分布,而是集中分布在原子核外围的一个固定轨道上。
卢瑟福的核式结构模型( )
——原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部,带负电的电子在核空间进行高速的绕核运动。
1.1.2 能层与能级
能层是将核外电子按电子能量差异分成的
能层 一 二 三 四 五 六 七 、、、
符号 K L M O P Q 、、、 、、、
最多电子数 2 18 32 50 、、、 、、、 、、、 、、、
每一能层容纳最多电子数
能级与最多容纳电子数
现代量子力学模型
德布罗意
薛定谔
海森堡
——众多物理学家经过13年的艰苦论证而得。
(1)各电子层最多能容纳2n2个电子。
即:电子层序号 1 2 3 4 5 6 7
代表符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(2)最外层电子数目不超过8个(K层为最外层时
不超过2个);次外层电子数最多不超过18
个;倒数第三层不超过32个。
原子核外电子排布规律:
(3)核外电子总是尽先排满能量最低、离核最近
的电子层,然后才由里往外,依次排在能量
较高电子层。而失电子总是先失最外层电子。
注意:
以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。
微粒符号 质子数 电子数
NH4+ 11 10
H2O 10 10
OH- 9 10
例如:
1.1.3 构造原理与电子排布式
随着原子核数的增加,绝大多数元素的核外电子的排布将遵循右图的排布顺序,称为构造原理。
部分元素原子的电子排布式
1.1.4 能量最低原理、
基态与激发态、光谱
能量最低原理:
原子的电子排不遵循构造原理能使整个原子的能量处于最低状态。
基态原子
吸收能量
激发态原子
释放能量
光是释放能量的重要形式之一。日常生活中,许多可见光(焰火、灯光、激光等)都与原子核外电子发生跃迁释放能量有关。
不同元素的原子发生跃迁时会吸收或释放光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,称为原子光谱。
利用原子光谱上的特征谱线来鉴定元素,被称为光谱分析。
1913年,玻尔第一次认识到氢原子光谱是氢原子的电子跃迁产生的,通过纯粹的理论计算得到氢原子光谱的谱线玻长。
1.1.5 电子云和电子轨道
现代量子力学否定了玻尔建立的原子行星模型,并指出原子的核外电子只能确定其在核外各处出现的概率。
氢原子电子云
1.核外电子运动的特征
1. 核外电子质量小,运动空间小,运动速率大。
2. 无确定的轨道,无法描述其运动轨迹。
3.无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会多少。
核外电子运动特征:
自身质量和体积:可以忽略
运动范围:核外很小的空间
运动速度:高速运动
所以没有固定的轨道,不能同时测出某时的速度和位置。描述电子在核外运动状态的方法:用一种能够表示电子在一定时间内在核外空间各处出现几率的模型(电子云)来描述电子在核外的运动。
2.原子核外电子排布规律
电子云分布几率的几种表示方法
电子轨道
S电子的原子轨道是圆形的能层序数的n越大,原子轨道的半径越大。
和s不同,p电子的原子轨道是纺锤形的,每个p层有三个能级轨道,他们互相垂直,而且p电子原子轨道的平均半径也随n的增大而增大。
观察能级图可看出:ns,np,nd,nf、、、、能级分别最多容纳2x1,2x3,2x5,2x7、、、、、、个电子。其1,3,5,7、、、、、、是其原子轨道数,分别乘以2是由于每个轨道里最多容纳2个电子。
注意
氦原子有两个原子,按照能量最低原则,两电子都应当排布在1s轨道上,电子排布式为1s2。如果用个圆圈(或方框、短线)表示满意一个给定量子数的原子轨道,这两个电子就有两种状态:自旋相同 或自旋相反。事实确定,基态氦原子的电子排布是,这也是我们对电子在原子轨道上进行排布必须要遵循的另一个原则――泡利不相容原理。
1.1.6 泡利原理和洪特规则
原理内容:一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反;或者说,一个原子中不会存在四个量子数完全相同的电子。
C:最外层的p能级上有三个规道
可能写出的基态C原子最外层p能级上两个电子的可能排布:
①2p:
②2p:
③2p:
④2p
p有3个轨道,而碳原子2p能层上只有两个电子,电子应优先分占,而不是挤入一个轨道,C原子最外层p能级上两个电子的排布应如①所示,这就是洪特规则。
↑
↑
↑
↑
↓↑
↓
↓
一、原子的构成
原子
原子核
核外电子
质子
中子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位的负电荷)
原子一般都是由质子、中子、核外电子构成,但有一种氢原子中只有一个质子和一个核外电子,没有中子,即并不是所有原子里都有中子 。
课堂小结
二、原子及离子中各种基本微粒间的关系
原子种类 微粒之间的关系
中性原子 原子序数=核电荷数=质子数=核外电子数
质量数(A)=质子数(Z)+中子数(N)
阳离子 原子序数=核电荷数=质子数=核外电子数+n
阴离子 原子序数=核电荷数=质子数=核外电子数-m
1. 原子核外电子的每一个能层上最多可容纳的代女子数为_______。
2. 每个能层所具有的能级数等于能层的序数_________。
3. 英文字母相同的不同能级中所容纳的最多电子数_________。
2n2
n
相同
课堂练习
4.下列不包含p能级的是( )
A. N B. M
C. L D.K
D
5.若某基态电子的外围电子排布为4d1 5s2,则下列说法正确的是( )
A.该元素位于周期表第5周期第IB族
B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子
D.该元素原子M层上8个电子
B
1.A、D 2.D 3.B 4.C 5.D
6.C是Mg的基态原子的电子排布式,而A、B、D都不是基态原子的电子排布。
7.
原子序数 电子排布式 电子层数 最外电子数
9 F: 2 7
17 Cl: 3 7
35 Br: 4 7
习题答案
8.
元素 电子排布式 电子排布图 最高化合价 最低化合价
Na Na: Na:1s
2s
2p
3s +1 0
S S: S:1s 2s
2p
3s
3p +6 -2
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
大千世界无所不有
导入新课
为什么它们会拥有不同的性质?
想一想
?
回忆
1. 化学变化中最小的微粒是什么?
2. 原子能否再分呢?原子如何构成?
3. 原子和原子核的相对空间位置是怎样的呢?它们体积大小如何?
4. 原子核的构成如何?
5. 质子、中子、电子的特点如何?
1.1.1 原子的诞生
1.1.2 能层与能级
1.1.3 构造原理与电子排布式
1.1.4 能量最低原理、
基态与激发态、光谱
1.1.5 电子云和电子轨道
1.1.6 泡利原理和洪特规则
第一节 原子结构
4.了解泡沫原理和洪特规则。
1.根据构造原理写出1~36号元素原子的电子排布式;
2. 核外电子的运动状态,电子云和电子轨道;
3.基态、激发态与光谱;
1.知识与能力
教学目标
2.过程与方法
充分利用教材提供的图、表等资料,借助多媒体等教学手段,初步学会运用类比、想象、归纳、概括等方法获取信息并进行加工。
在分析原子结构时,鼓励主动与他人进行交流和讨 论,清楚地表达自己的观点,逐步形成良好的学习习惯和学习方法。
3.情感态度与价值观
从科学家探索物质构成奥秘的史实中体会科学探究的过程和方法,在抽象思维、理论分析的过程中逐步形成科学的价值观。
重点
根据构造原理写出1~36号元素原子的电子排布式;核外电子的运动状态,电子云和电子轨道;泡利原理、洪特规则。
难点
1.电子云与原子轨道;
2.基态、激发态与光谱。
教学重难点
宇宙大爆炸促使氢、氦原子合成其它原子!
1.1.1 原子的诞生
原子结构理论模型发展史:
道尔顿的原子模型 (错)
——微小的、不可再分的实心球体。
汤姆生的葡萄干布丁模型 (错)
——正电荷像流体一样均匀分布在原子中,电子就像葡萄干一样散布在正电荷中,它们的负电荷与那些正电荷相互抵消。
日本科学家的土星模型(错)
——电子并不是均匀分布,而是集中分布在原子核外围的一个固定轨道上。
卢瑟福的核式结构模型( )
——原子的全部正电荷在原子核内,且几乎全部质量均集中在原子核内部,带负电的电子在核空间进行高速的绕核运动。
1.1.2 能层与能级
能层是将核外电子按电子能量差异分成的
能层 一 二 三 四 五 六 七 、、、
符号 K L M O P Q 、、、 、、、
最多电子数 2 18 32 50 、、、 、、、 、、、 、、、
每一能层容纳最多电子数
能级与最多容纳电子数
现代量子力学模型
德布罗意
薛定谔
海森堡
——众多物理学家经过13年的艰苦论证而得。
(1)各电子层最多能容纳2n2个电子。
即:电子层序号 1 2 3 4 5 6 7
代表符号 K L M N O P Q
最多电子数 2 8 18 32 50 72 98
(2)最外层电子数目不超过8个(K层为最外层时
不超过2个);次外层电子数最多不超过18
个;倒数第三层不超过32个。
原子核外电子排布规律:
(3)核外电子总是尽先排满能量最低、离核最近
的电子层,然后才由里往外,依次排在能量
较高电子层。而失电子总是先失最外层电子。
注意:
以上几点是相互联系的,不能孤立地理解,必须同时满足各项要求。
微粒符号 质子数 电子数
NH4+ 11 10
H2O 10 10
OH- 9 10
例如:
1.1.3 构造原理与电子排布式
随着原子核数的增加,绝大多数元素的核外电子的排布将遵循右图的排布顺序,称为构造原理。
部分元素原子的电子排布式
1.1.4 能量最低原理、
基态与激发态、光谱
能量最低原理:
原子的电子排不遵循构造原理能使整个原子的能量处于最低状态。
基态原子
吸收能量
激发态原子
释放能量
光是释放能量的重要形式之一。日常生活中,许多可见光(焰火、灯光、激光等)都与原子核外电子发生跃迁释放能量有关。
不同元素的原子发生跃迁时会吸收或释放光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,称为原子光谱。
利用原子光谱上的特征谱线来鉴定元素,被称为光谱分析。
1913年,玻尔第一次认识到氢原子光谱是氢原子的电子跃迁产生的,通过纯粹的理论计算得到氢原子光谱的谱线玻长。
1.1.5 电子云和电子轨道
现代量子力学否定了玻尔建立的原子行星模型,并指出原子的核外电子只能确定其在核外各处出现的概率。
氢原子电子云
1.核外电子运动的特征
1. 核外电子质量小,运动空间小,运动速率大。
2. 无确定的轨道,无法描述其运动轨迹。
3.无法计算电子在某一刻所在的位置,只能指出其在核外空间某处出现的机会多少。
核外电子运动特征:
自身质量和体积:可以忽略
运动范围:核外很小的空间
运动速度:高速运动
所以没有固定的轨道,不能同时测出某时的速度和位置。描述电子在核外运动状态的方法:用一种能够表示电子在一定时间内在核外空间各处出现几率的模型(电子云)来描述电子在核外的运动。
2.原子核外电子排布规律
电子云分布几率的几种表示方法
电子轨道
S电子的原子轨道是圆形的能层序数的n越大,原子轨道的半径越大。
和s不同,p电子的原子轨道是纺锤形的,每个p层有三个能级轨道,他们互相垂直,而且p电子原子轨道的平均半径也随n的增大而增大。
观察能级图可看出:ns,np,nd,nf、、、、能级分别最多容纳2x1,2x3,2x5,2x7、、、、、、个电子。其1,3,5,7、、、、、、是其原子轨道数,分别乘以2是由于每个轨道里最多容纳2个电子。
注意
氦原子有两个原子,按照能量最低原则,两电子都应当排布在1s轨道上,电子排布式为1s2。如果用个圆圈(或方框、短线)表示满意一个给定量子数的原子轨道,这两个电子就有两种状态:自旋相同 或自旋相反。事实确定,基态氦原子的电子排布是,这也是我们对电子在原子轨道上进行排布必须要遵循的另一个原则――泡利不相容原理。
1.1.6 泡利原理和洪特规则
原理内容:一个原子轨道中最多只能容纳两个电子,并且这两个电子的自旋方向必须相反;或者说,一个原子中不会存在四个量子数完全相同的电子。
C:最外层的p能级上有三个规道
可能写出的基态C原子最外层p能级上两个电子的可能排布:
①2p:
②2p:
③2p:
④2p
p有3个轨道,而碳原子2p能层上只有两个电子,电子应优先分占,而不是挤入一个轨道,C原子最外层p能级上两个电子的排布应如①所示,这就是洪特规则。
↑
↑
↑
↑
↓↑
↓
↓
一、原子的构成
原子
原子核
核外电子
质子
中子
(每个质子带一个单位正电荷)
(不带电)
(每个电子带一个单位的负电荷)
原子一般都是由质子、中子、核外电子构成,但有一种氢原子中只有一个质子和一个核外电子,没有中子,即并不是所有原子里都有中子 。
课堂小结
二、原子及离子中各种基本微粒间的关系
原子种类 微粒之间的关系
中性原子 原子序数=核电荷数=质子数=核外电子数
质量数(A)=质子数(Z)+中子数(N)
阳离子 原子序数=核电荷数=质子数=核外电子数+n
阴离子 原子序数=核电荷数=质子数=核外电子数-m
1. 原子核外电子的每一个能层上最多可容纳的代女子数为_______。
2. 每个能层所具有的能级数等于能层的序数_________。
3. 英文字母相同的不同能级中所容纳的最多电子数_________。
2n2
n
相同
课堂练习
4.下列不包含p能级的是( )
A. N B. M
C. L D.K
D
5.若某基态电子的外围电子排布为4d1 5s2,则下列说法正确的是( )
A.该元素位于周期表第5周期第IB族
B.该元素原子核外有5个电子层
C.该元素原子最外层共有3个电子
D.该元素原子M层上8个电子
B
1.A、D 2.D 3.B 4.C 5.D
6.C是Mg的基态原子的电子排布式,而A、B、D都不是基态原子的电子排布。
7.
原子序数 电子排布式 电子层数 最外电子数
9 F: 2 7
17 Cl: 3 7
35 Br: 4 7
习题答案
8.
元素 电子排布式 电子排布图 最高化合价 最低化合价
Na Na: Na:1s
2s
2p
3s +1 0
S S: S:1s 2s
2p
3s
3p +6 -2
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
↓↑
