人教版 选修3 高二化学 第二章 2.1共价键 教学课件(共35张ppt)
文档属性
| 名称 | 人教版 选修3 高二化学 第二章 2.1共价键 教学课件(共35张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 00:00:00 | ||
图片预览











文档简介
(共35张PPT)
分子中相邻原子之间是靠什么
作用而结合在一起?
导入新课
什么是化学键?
什么是离子键?
什么是共价键?
化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的
化学键。
共价键:原子间通过共用电子对形成的化学键。
你能用电子式表示H2、HCl、Cl2
分子的形成过程吗?
为什么不可能有H3、H2Cl、Cl3
分子的形成?
2
1
2.1共价键
知道共价键的主要类型σ键和π键,理解键能、键长、键角等与简单分子的某些性质的关系。
知识与能力
过程与方法
学习抽象概念的方法:可以运用类比、归纳、判断、推理的方法,注意各概念的区别与联系,熟悉掌握各知识点的共性和差异性。
教学目标
情感态度与价值观
使学生感受到:在分子水平上进一步形成有关物质结构的基本观念,能从物质结构决定性质的视角解释分子的某些性质,并预测物质的有关性质,体验科学的魅力,进一步形成科学的价值观。
重点
1.σ 键和π键的特征和性质。
2.用键能、键长、键角等说明简单风姿的某些性质。
难点
1.σ键和π键的特征。
2.键角。
教学重难点
共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就共价键的“饱和性”。H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子。
2.1.1 共价键
价键理论的要点
1.电子配对原理
2.最大重叠原理
两原子各自提供1个自旋方向相反的电子彼此配对。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
共价键的形成
相互靠拢
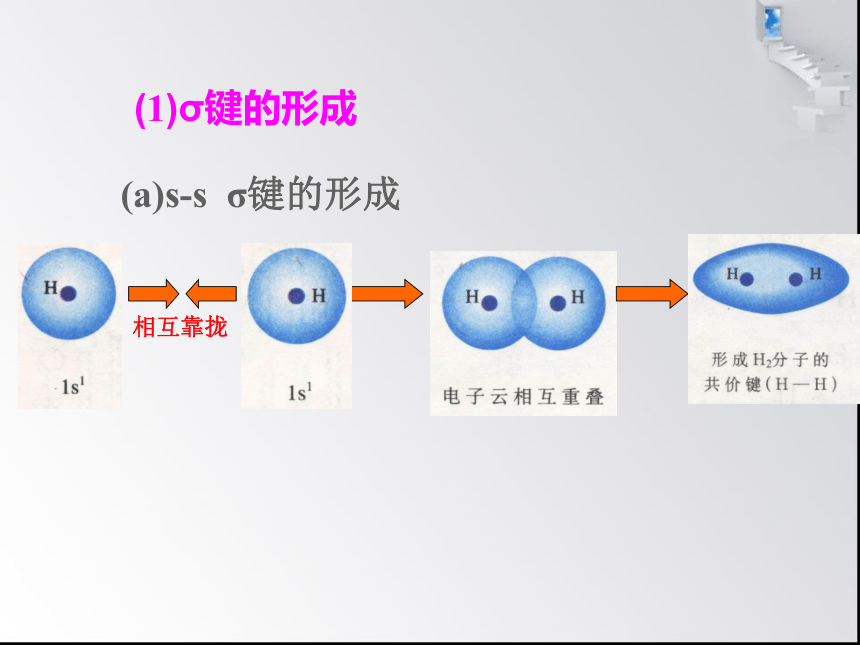
(1)σ键的形成
(a)s-s σ键的形成
未成对电子的
电子云相互靠拢
电子云相互重叠
(b)s-p σ键的形成
未成对电子的
电子云相互靠拢
电子云相互重叠
(c)p-p σ键的形成
X
s—s
X
px—s
X
px—px
轴对称
形成σ键的电子
称为σ电子。
σ键:“头顶头”
两个原子
相互接近
电子云重叠
π键的电子云
(2)π键的形成
X
Z
Z
pZ—pZ
形成π键的电子称为π电子。
镜像对称
π键:“肩并肩”
2.1.2 键参数——键能、键长与键角
键能
键能是气态基态原子级形成1mol化学键释放的能量;
键能越大,即形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。
通常键能的数据使用热化学方法由实验测定的。
某些共价键键能
键长
键长是衡量共价键稳定性的另一个参数,是形成共价键的两个原子之间的核间距。
键长越短,往往键能越大,表明共价键越稳定。
通常用光谱或衍射等实验方法来测定键长。
某些共价键键长
键角
在原子数超过2的分子中,两个共价键之间的夹角称为键角。
键角是表示分子立体结构的一个重要参数 。
键角理论上可用量子力学算出但实际上是通过光谱、衍射等实验测定而算出。
O
H
H
O = C = O
104°30′(折线型)
180°(直线型)
H
H
H
H
C
109°28′(正四面体)
H
H
H
N
107°18′(三角锥形)
三者的联系
键能和键长两个参数可定量的描述化学键的性质;
键长和键角可用于确定分子的几何构型。
已知CO2的C=O键长是0.116nm,O-C-O键角等于180°,就可知CO2是直线形的非极性分子。
2.1.3 等电子原理
像一氧化碳和氮分子这样具有相同电子数(指分子或离子中全部电子总数或价电子总数)和相同原子数的两个或两个以上的分子或离子,它们的分子结构相似,性质相似。这条规律就叫做等电子原理。具有等电子的物质,如一氧化碳和氮分子就彼此叫做等电子体。
互为等电子体应该满足的条件:
①在微粒的组成上,微粒所含原子数目相同。
②在微粒的构成上,微粒所含电子数目相同。
③在微粒的结构上,微粒中原子的空间排列方式相同。
应用:
应用等电子原理,可利用已知的分子的构型(几何构型、电子构型)和物理性质对相应等电子分子的构型和物理性质进行预测。
典型事例:
① (BN)x与(C2)x,N2O与CO2等也是等电子体 。
②硅和锗是良好的半导体材料,他们的等电子体磷化铝(AlP)砷化镓(GaAs)也是很好的半导体材料 。
③白锡(β—Sn2)与锑化锢是等电子体,它们在低温下都可转变为超导体 。
④SiCl4、SiO44-、SO42-的原子数目和价电子总数都相等,它们互为等电子体,中心原子都是sp3杂化,都形成正四面体立体构型。
键型
项目 σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
共价单键是σ键,共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。
课堂小结
共价键类型
电子云重叠方式:σ键、π键
共用电子对数目:单键、双键、三键
按提供电子对方式:一般共价键、配位键
按电子对是否偏移:极性共价键、非极性共价键
共价键键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
1.下列说法正确的是 ( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
2.氮分子中的化学键是( )
A. 3个σ键 B. 1个σ键,2个π键
C. 3 个π键 D. 1个σ键,1个π键
B
B
课堂练习
3.下列说法中正确的是( )
p轨道之间以“肩并肩”重叠可形成σ键
B. p轨道之间以“头对头”重叠可形成π键
C.s和p轨道以“头对头”重叠可形成σ键
D. 共价键是两个原子轨道以“头对头”重叠形成的
C
4.在氯化氢分子中,形成共价键的原子轨道是( )
A. 氯原子的2p轨道和氢原子的1s轨道
B. 氯原子的2p轨道和氢原子的2p轨道
C. 氯原子的3p轨道和氢原子的1s轨道
D. 氯原子的3p轨道和氢原子的3p轨道
C
5.下列不互不等电子体的是( )
A.N2O和CO2 B.O3和NO2- C.CH4和NH4+ D.OH-和NH2?
D
1.(略)
2.氧原子最外层有6个电子,还差两个电子达到8eˉ稳定结构,氢原子只有一个电子,差一个电子达到2eˉ稳定结构,所以一个氧原子只能与两个氢原子成键,氢气和氧气化合生成的分子为H2O。
习题答案
3. 2个 2个
4.键能和键长都是对共价键稳定性程度的描述,Cl2、Br2、I2的键能依次下降键长哦依次增大,表明Cl2、Br2、I2分子中的共价键的牢固程度依次减弱。
5.键能数据表明,N≡N键能大于N-N键能的3倍,N=N键能大于N-N键能的两倍;而C ≡ C键能却小于C-C键能的3倍,C=C键能小于C-C键能的两倍,说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应。而氮分子中N≡N非常牢固,所以氮分子不易发生加成反应。
键 键长/pm 键能/(kJ·mol) HX在1273K的分解百分数
H–Cl 127.4 431.8 0.0014
H–Br 141.4 366 0.5
H–I 169 298.7 33
6.
上述数据表明:共价键的键长越小,键能越大,该共价键越稳定。
分子中相邻原子之间是靠什么
作用而结合在一起?
导入新课
什么是化学键?
什么是离子键?
什么是共价键?
化学键:分子中相邻原子之间强烈的相互作用。
离子键:阴、阳离子之间通过静电作用形成的
化学键。
共价键:原子间通过共用电子对形成的化学键。
你能用电子式表示H2、HCl、Cl2
分子的形成过程吗?
为什么不可能有H3、H2Cl、Cl3
分子的形成?
2
1
2.1共价键
知道共价键的主要类型σ键和π键,理解键能、键长、键角等与简单分子的某些性质的关系。
知识与能力
过程与方法
学习抽象概念的方法:可以运用类比、归纳、判断、推理的方法,注意各概念的区别与联系,熟悉掌握各知识点的共性和差异性。
教学目标
情感态度与价值观
使学生感受到:在分子水平上进一步形成有关物质结构的基本观念,能从物质结构决定性质的视角解释分子的某些性质,并预测物质的有关性质,体验科学的魅力,进一步形成科学的价值观。
重点
1.σ 键和π键的特征和性质。
2.用键能、键长、键角等说明简单风姿的某些性质。
难点
1.σ键和π键的特征。
2.键角。
教学重难点
共价键具有饱和性
按照共价键的共用电子对理论,一个原子有几个未成对电子,便可和几个自旋相反的电子配对成键,这就共价键的“饱和性”。H 原子、Cl原子都只有一个未成对电子,因而只能形成H2、HCl、Cl2分子,不能形成H3、H2Cl、Cl3分子。
2.1.1 共价键
价键理论的要点
1.电子配对原理
2.最大重叠原理
两原子各自提供1个自旋方向相反的电子彼此配对。
两个原子轨道重叠部分越大,两核间电子的概率密度越大,形成的共价键越牢固,分子越稳定。
电子云在两个原子核间重叠,意味着电子出现在核间的概率增大,电子带负电,因而可以形象的说,核间电子好比在核间架起一座带负电的桥梁,把带正电的两个原子核“黏结”在一起了。
共价键的形成
相互靠拢
(1)σ键的形成
(a)s-s σ键的形成
未成对电子的
电子云相互靠拢
电子云相互重叠
(b)s-p σ键的形成
未成对电子的
电子云相互靠拢
电子云相互重叠
(c)p-p σ键的形成
X
s—s
X
px—s
X
px—px
轴对称
形成σ键的电子
称为σ电子。
σ键:“头顶头”
两个原子
相互接近
电子云重叠
π键的电子云
(2)π键的形成
X
Z
Z
pZ—pZ
形成π键的电子称为π电子。
镜像对称
π键:“肩并肩”
2.1.2 键参数——键能、键长与键角
键能
键能是气态基态原子级形成1mol化学键释放的能量;
键能越大,即形成化学键时放出的能量越多,意味着这个化学键越稳定,越不容易被打断。
通常键能的数据使用热化学方法由实验测定的。
某些共价键键能
键长
键长是衡量共价键稳定性的另一个参数,是形成共价键的两个原子之间的核间距。
键长越短,往往键能越大,表明共价键越稳定。
通常用光谱或衍射等实验方法来测定键长。
某些共价键键长
键角
在原子数超过2的分子中,两个共价键之间的夹角称为键角。
键角是表示分子立体结构的一个重要参数 。
键角理论上可用量子力学算出但实际上是通过光谱、衍射等实验测定而算出。
O
H
H
O = C = O
104°30′(折线型)
180°(直线型)
H
H
H
H
C
109°28′(正四面体)
H
H
H
N
107°18′(三角锥形)
三者的联系
键能和键长两个参数可定量的描述化学键的性质;
键长和键角可用于确定分子的几何构型。
已知CO2的C=O键长是0.116nm,O-C-O键角等于180°,就可知CO2是直线形的非极性分子。
2.1.3 等电子原理
像一氧化碳和氮分子这样具有相同电子数(指分子或离子中全部电子总数或价电子总数)和相同原子数的两个或两个以上的分子或离子,它们的分子结构相似,性质相似。这条规律就叫做等电子原理。具有等电子的物质,如一氧化碳和氮分子就彼此叫做等电子体。
互为等电子体应该满足的条件:
①在微粒的组成上,微粒所含原子数目相同。
②在微粒的构成上,微粒所含电子数目相同。
③在微粒的结构上,微粒中原子的空间排列方式相同。
应用:
应用等电子原理,可利用已知的分子的构型(几何构型、电子构型)和物理性质对相应等电子分子的构型和物理性质进行预测。
典型事例:
① (BN)x与(C2)x,N2O与CO2等也是等电子体 。
②硅和锗是良好的半导体材料,他们的等电子体磷化铝(AlP)砷化镓(GaAs)也是很好的半导体材料 。
③白锡(β—Sn2)与锑化锢是等电子体,它们在低温下都可转变为超导体 。
④SiCl4、SiO44-、SO42-的原子数目和价电子总数都相等,它们互为等电子体,中心原子都是sp3杂化,都形成正四面体立体构型。
键型
项目 σ键 π键
成键方向
电子云形状
牢固程度
成键判断规律
沿轴方向“头碰头”
平行方向“肩并肩”
轴对称
镜像对称
强度大,不易断裂
强度较小,易断裂
共价单键是σ键,共价双键中一个是 σ键,另一个是π键,共价三键中一个是σ键,另两个为π键。
课堂小结
共价键类型
电子云重叠方式:σ键、π键
共用电子对数目:单键、双键、三键
按提供电子对方式:一般共价键、配位键
按电子对是否偏移:极性共价键、非极性共价键
共价键键参数
键能
键长
键角
衡量化学键稳定性
描述分子的立体结构的重要因素
1.下列说法正确的是 ( )
A.含有共价键的化合物一定是共价化合物
B.分子中只有共价键的化合物一定是共价化合物
C.由共价键形成的分子一定是共价化合物
D.只有非金属原子间才能形成共价键
2.氮分子中的化学键是( )
A. 3个σ键 B. 1个σ键,2个π键
C. 3 个π键 D. 1个σ键,1个π键
B
B
课堂练习
3.下列说法中正确的是( )
p轨道之间以“肩并肩”重叠可形成σ键
B. p轨道之间以“头对头”重叠可形成π键
C.s和p轨道以“头对头”重叠可形成σ键
D. 共价键是两个原子轨道以“头对头”重叠形成的
C
4.在氯化氢分子中,形成共价键的原子轨道是( )
A. 氯原子的2p轨道和氢原子的1s轨道
B. 氯原子的2p轨道和氢原子的2p轨道
C. 氯原子的3p轨道和氢原子的1s轨道
D. 氯原子的3p轨道和氢原子的3p轨道
C
5.下列不互不等电子体的是( )
A.N2O和CO2 B.O3和NO2- C.CH4和NH4+ D.OH-和NH2?
D
1.(略)
2.氧原子最外层有6个电子,还差两个电子达到8eˉ稳定结构,氢原子只有一个电子,差一个电子达到2eˉ稳定结构,所以一个氧原子只能与两个氢原子成键,氢气和氧气化合生成的分子为H2O。
习题答案
3. 2个 2个
4.键能和键长都是对共价键稳定性程度的描述,Cl2、Br2、I2的键能依次下降键长哦依次增大,表明Cl2、Br2、I2分子中的共价键的牢固程度依次减弱。
5.键能数据表明,N≡N键能大于N-N键能的3倍,N=N键能大于N-N键能的两倍;而C ≡ C键能却小于C-C键能的3倍,C=C键能小于C-C键能的两倍,说明乙烯和乙炔中的π键不牢固,容易被试剂进攻,故易发生加成反应。而氮分子中N≡N非常牢固,所以氮分子不易发生加成反应。
键 键长/pm 键能/(kJ·mol) HX在1273K的分解百分数
H–Cl 127.4 431.8 0.0014
H–Br 141.4 366 0.5
H–I 169 298.7 33
6.
上述数据表明:共价键的键长越小,键能越大,该共价键越稳定。
