人教版 选修3 高二化学 第二章 2.2分子的立体结构 教学课件(共45张ppt)
文档属性
| 名称 | 人教版 选修3 高二化学 第二章 2.2分子的立体结构 教学课件(共45张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 11:08:02 | ||
图片预览








文档简介
(共45张PPT)
导入新课
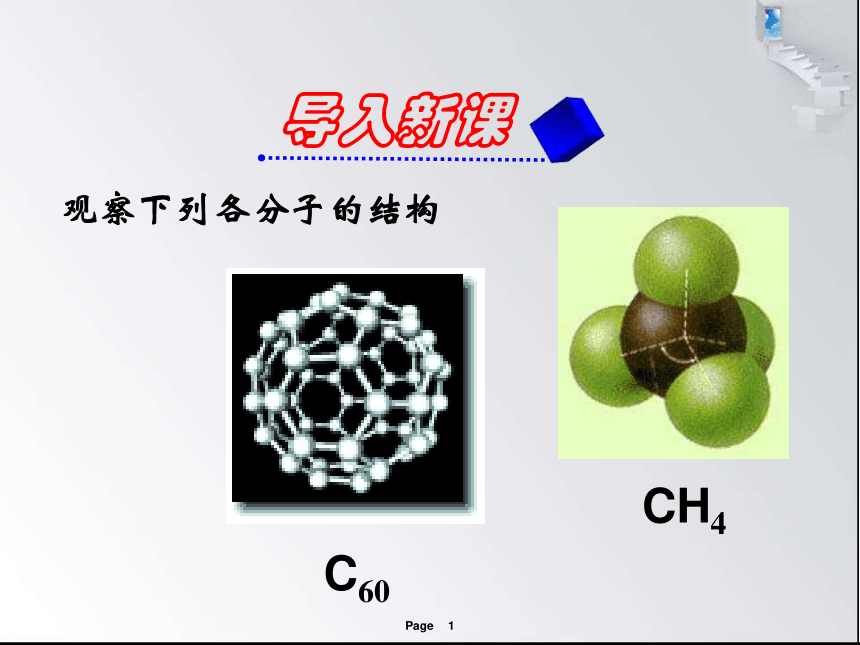
CH4
观察下列各分子的结构
C60
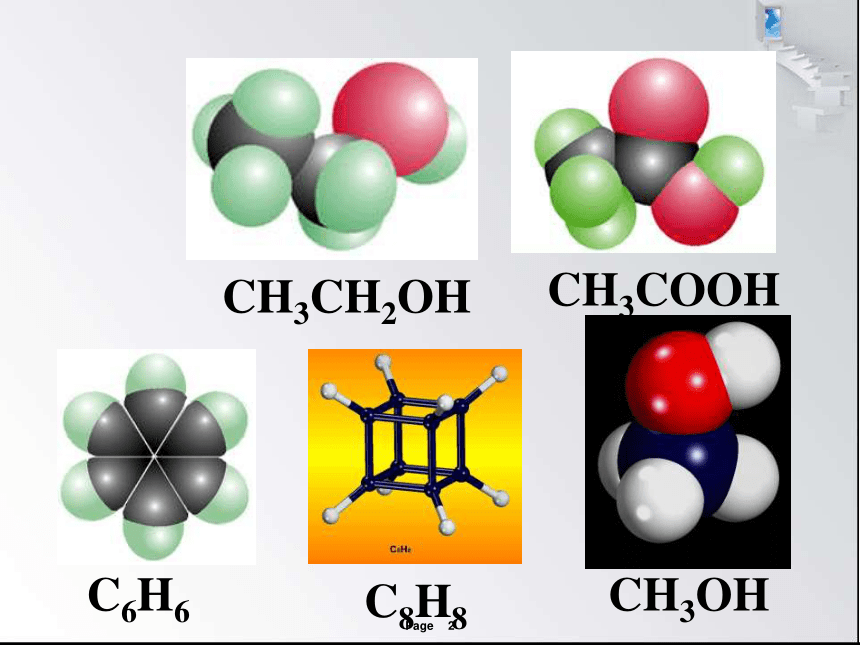
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
思考:
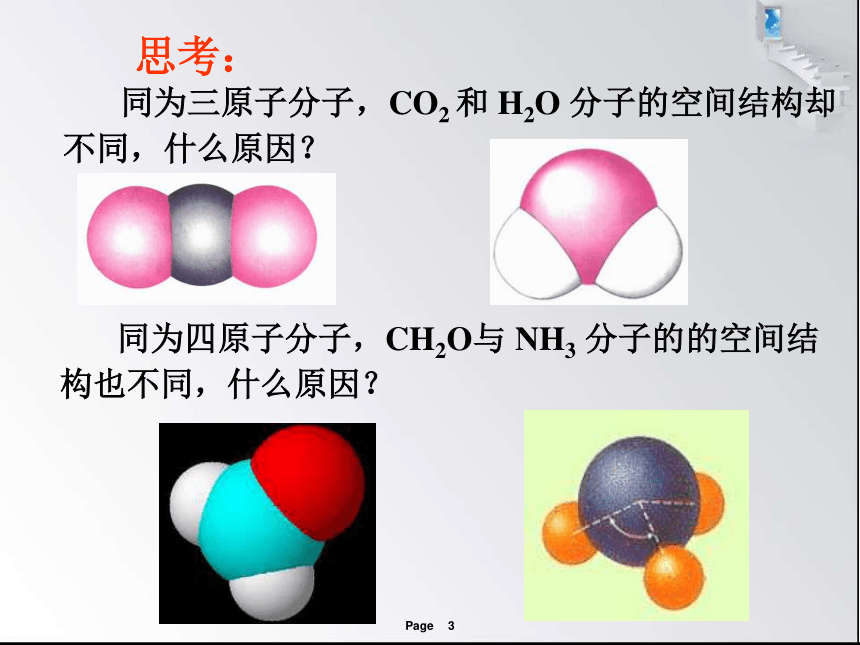
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
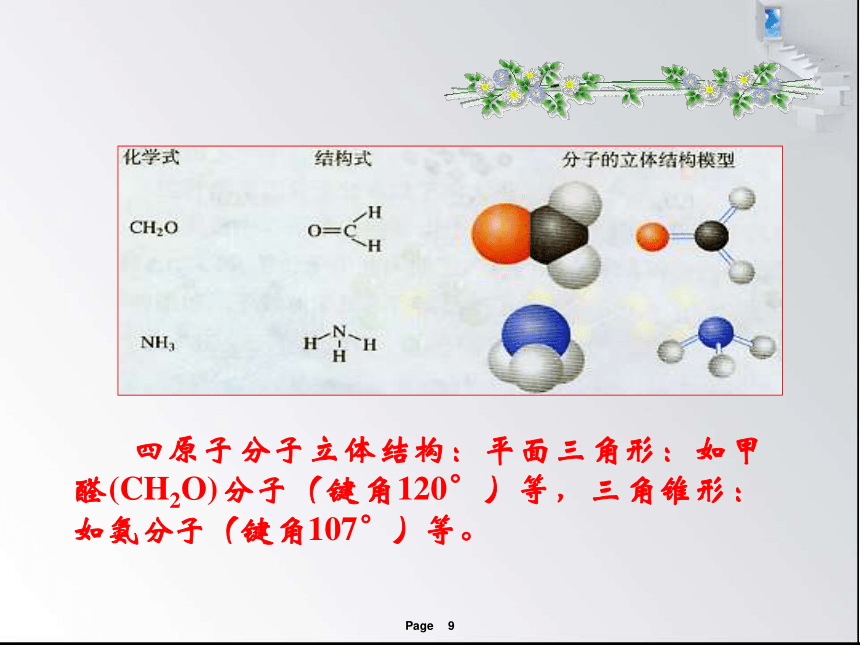
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
2.2分子的立体结构
知识与能力?
教学目标
1.认识共价分子结构的多样性和复杂性。
2.能根据价层电子对互斥理论和杂化轨道,理论判断简单分子或离子的构型。
3.能说明简单配合物的成键情况。
过程与方法
1.利用模型,多媒体等资料切实的认识分子的结构。
情感态度与价值观
在分子构型上进一步了解有关物质结构,能从理论的角度解释物质结构,体验科学的魅力,进一步形成科学的价值观。
2.与同学讨论并交流对杂化轨道理论的理解,培养科学、严谨的学习方法。
重点
1.分子的立体结构模型。
2.价层电子对互斥理论、杂化轨道理论和配位键。
难点
1.分子的立体结构型。
2.价层电子对互斥理论、杂化轨道理论。
教学重难点
2.2.1形形色色的分子
三原子分子立体结构:有直线形CO2 、CS2等,V形如H2O、SO2等。
四原子分子立体结构:平面三角形:如甲醛(CH2O)分子(键角120°)等,三角锥形:如氨分子(键角107°)等。
五原子分子立体结构:正四面体形如甲烷、P4等。
形形色色的分子
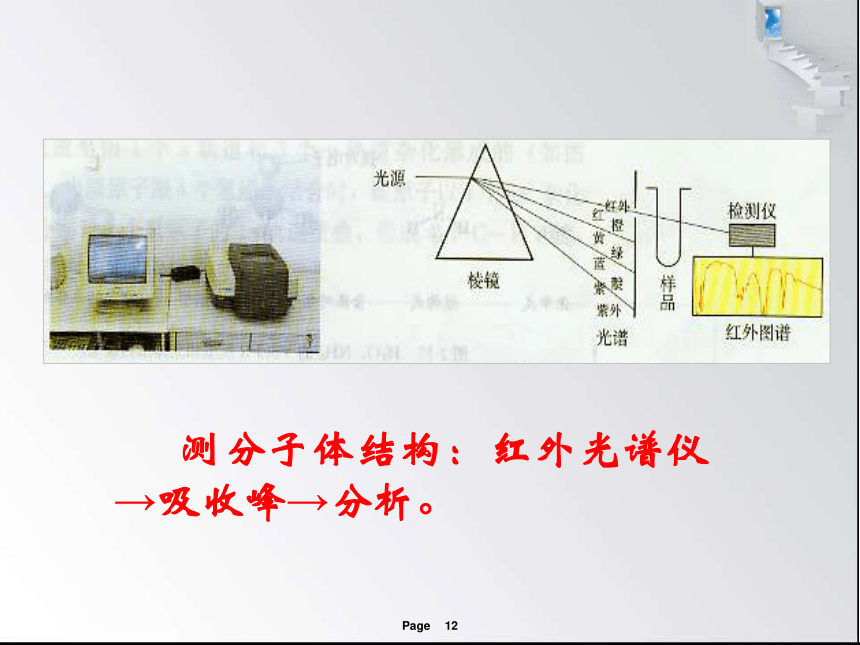
测分子体结构:红外光谱仪→吸收峰→分析。
基本要点
ABn 型分子(离子)中的中心原子A周围的价层电子对的几何构型,主要取决于价层电子对数(n),价电子对尽量远离,使它们之间斥力最小,能量最低,物质才能最稳定。
2.2.2 价层电子对互斥模型
(VSEPR)
价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体
(1)一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子。
直线型
平面三角型
四面体
BeCl2 HgCl2
BF3 BCl3 CH2O
CH4 CCl4 NH4+
中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数 n 来预测,概括如下:
ABn 立体结构 范例
n=2
n=3
n=4
直线形
平面三角形
正四面体形
BeCl2 HgCl2
BF3 BCl3 CH2O
CH4 CCl4 NH4+
(2)另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。
例如,H2O和NH3的中心原子分别有2 对和 l 对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
2.2.3 杂化轨道理论简介
杂化轨道理论是指在形成分子时,由于原子的相互影响,若干不同类型(主要是s,p轨道)能量相近的原子轨道混合起来,重新组合成一组新轨道,这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道 。
常见的杂化轨道类型: 由于ns,np能级接近,往往采用sp型杂化,而sp型杂化又分为:
杂化
杂化
杂化
分子构型与杂化类型的关系
(1) 杂化-----四面体形
用2s与3个2p轨道混杂,形成四个完全相同的新轨道,称为等性 杂化。
每个 杂化轨道都含有s和p的成分, 杂化轨道间的夹角为109°28’。空间构型为空间正四面体形。如CH4分子的结构如图
而O,N因为有孤对电子采取的是不等性 杂化,故四个轨道成空间四面体,而分子的空间构型则成V形和三角锥形 。
(2) 杂化——平面三角形: 杂化轨道是由一个ns轨道和两个np轨道组合而成的,每个 杂化轨道都含有s和p成分,杂化轨道间的夹角为120°,呈平面三角形如:BF3分子 。
sp2杂化轨道示意图
HF3分子结构示意图
(3) 杂化——直线形: 型杂化轨道是由一个ns轨道和一个np轨道组合而成的,每个 杂化轨道含有s和p的成分,轨道间的夹角为180°呈直线形。
BeCl分子形成示意图
思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?
2.2.4 配合物理简介
CuSO4 CuCl·2H2O CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
Cu
OH2
H2O
H2O
H2O
2+
配位化合物,简称配合物,通常是由中心离子(或原子) 与配位体(某些分子或阴离子) 以配位键的形式结合而成的复杂离子或分子。
2+
Cu
NH3
H3N
NH3
NH3
实验2-2 已知氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+ ,其结构简式为:
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3·H2O [Cu(NH3) 4]2+ +2OH-+4H2O
蓝色沉淀
深蓝色溶液
实验2-3
Fe 3+ +SCN— [Fe (SCN) ]2+
硫氰酸根
血红色
由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
练习书写:
向硝酸银溶液中逐渐滴加氨水的离子方程式。
配合物的组成
1.中心离子或原子(也称形成体) 有空轨道
主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子;
或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子;
碱金属、碱土金属等可作为螯合物的形成体。
[Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。
2. 配位体和配位原子 有孤对电子
a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO ;
含氧配位体 H2O, OH- ,羧酸,醇,醚等。
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en;
乙二胺四乙酸根(EDTA)等。
3.配位数
(与中心离子直接以配位键结合的配位原子个数)
例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6
* 中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
* 中心离子半径越大,其周围可容纳配体就越多,配位数越大。
配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4]
4. 配离子的电荷
配位化合物的命名
配位数—配位体名称—合—中心离子(用罗马数字表示氧化数)。
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
配合物的盐与复盐的比较
复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O
配合物盐,是在配合物的溶液或晶体中,十分明确地存在着含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O
代表物 中心原子
结合的原子数 分子类型 空间构型
中心原子
无孤对电子 CO2 2 AB2
CH2O 3 AB3
CH4 4 AB4
中心原子
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
价层电子对互斥模型
课堂小结
杂化轨道中sp型杂化分为:
杂化: 一个s轨道和一个p轨道间的杂化。
杂化: 一个s轨道和两个这轨道间的杂化。
杂化: 一个s轨道和三个p轨道间的杂化。
配位键形成条件:
“电子对给予体”——含有孤电子对
“接受体”——含有空轨道
过渡金属配合物比主族金属配合物多。
1.下列分子的立体结构,其中属于直线型分子的是 ( )
A. H2O B. CO2
C. C2H2 D. P4
BC
2.用VSEPR模型预测,下列分子中键角不是1200的是 ( )
A.C2H2 B.C6H6
C.BF3 D.NH3
DA
课堂练习
3.Co(NH3)5BrSO4可形成两种钴的配合物 ,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4 和[Co(SO4)(NH3)5]Br。
(1) 若在第一种配合物的溶液中加BaCl2 溶液时, 产生_____________________现象;
(2) 如果在第二种配合物的溶液中加入BaCl2溶液时,产生_________________________现象;
(3) 若在第二种配合物的溶液中加入 AgNO3溶液时,产生____________________________现象。
白色沉淀
无明显现象
淡黄色沉淀
4.判断以下常见分子的中心原子的杂化轨道类型(用序号填空)
①[NH4]+ ②CH2O ③NH3 ④SO2 ⑤BeCl2
⑥H2O ⑦CO2
sp3 杂化的是 ,sp2 杂化的是 , 杂化的是 。
5、7
1、3、6
2、4
5.为什么H2O分子的键角既不是90°也不是109°28′而是104.5°?
答案:不等性 杂化
6.把CoCl2溶解于水后加氨水,直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使之生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种配合物其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2molAgCl。 通过计算,确定此配合物的化学式。
答案:[Co(NH3)5Cl]Cl2
ABn 分子的立体构型 典型例子
n=2 直线形 CO2、HCN
n=3 平面三角形 CH2O、BF3
n=4 正四面体 CH4、CCl4
1.
习题答案
2.在乙炔分子中,2个碳原子各以1个sp杂化轨道与氢原子形成1个碳氢σ键,同时又各以其另1个sp杂化轨道形成1个碳碳σ键,除此之外,每个碳原子通过2个未参加杂化的p轨道(互相垂直)形成2个π键,因此,乙炔的三键中有1个键和2个π键。
3.甲醛分子的立体构型:
碳原子采取sp2杂化,甲醛分子中有2个C-H σ键,而C-O之间有1个σ键和1个π键。
4.氢离子接受水分子中氧原子上的孤电子对以配位键形成H3O + ,电子对给予体是H2O,接受体是氢离子 。
5.银离子与氯离子形成难溶于水的沉淀。加入氨水以后,银离子接受氨分子中氮原子给出的孤电子对以配位键形成[ Ag(NH3)2]+,由于生成了可溶性的[ Ag(NH3)2]+ ,继续加入氨水时氯化银就溶解了。
导入新课
CH4
观察下列各分子的结构
C60
CH3CH2OH
CH3COOH
C6H6
C8H8
CH3OH
思考:
同为三原子分子,CO2 和 H2O 分子的空间结构却不同,什么原因?
同为四原子分子,CH2O与 NH3 分子的的空间结构也不同,什么原因?
2.2分子的立体结构
知识与能力?
教学目标
1.认识共价分子结构的多样性和复杂性。
2.能根据价层电子对互斥理论和杂化轨道,理论判断简单分子或离子的构型。
3.能说明简单配合物的成键情况。
过程与方法
1.利用模型,多媒体等资料切实的认识分子的结构。
情感态度与价值观
在分子构型上进一步了解有关物质结构,能从理论的角度解释物质结构,体验科学的魅力,进一步形成科学的价值观。
2.与同学讨论并交流对杂化轨道理论的理解,培养科学、严谨的学习方法。
重点
1.分子的立体结构模型。
2.价层电子对互斥理论、杂化轨道理论和配位键。
难点
1.分子的立体结构型。
2.价层电子对互斥理论、杂化轨道理论。
教学重难点
2.2.1形形色色的分子
三原子分子立体结构:有直线形CO2 、CS2等,V形如H2O、SO2等。
四原子分子立体结构:平面三角形:如甲醛(CH2O)分子(键角120°)等,三角锥形:如氨分子(键角107°)等。
五原子分子立体结构:正四面体形如甲烷、P4等。
形形色色的分子
测分子体结构:红外光谱仪→吸收峰→分析。
基本要点
ABn 型分子(离子)中的中心原子A周围的价层电子对的几何构型,主要取决于价层电子对数(n),价电子对尽量远离,使它们之间斥力最小,能量最低,物质才能最稳定。
2.2.2 价层电子对互斥模型
(VSEPR)
价电子对的数目决定了一个分子或离子中的价层电子对在空间的分布(与分子立体构型不同):
2 3 4 5 6
直线形 平面三角形 正四面体 三角双锥体 正八面体
(1)一类是中心原子上的价电子都用于形成共价键,如CO2、CH2O、CH4等分子中的碳原子。
直线型
平面三角型
四面体
BeCl2 HgCl2
BF3 BCl3 CH2O
CH4 CCl4 NH4+
中心原子上的价电子都用于形成共价键,它们的立体结构可用中心原子周围的原子数 n 来预测,概括如下:
ABn 立体结构 范例
n=2
n=3
n=4
直线形
平面三角形
正四面体形
BeCl2 HgCl2
BF3 BCl3 CH2O
CH4 CCl4 NH4+
(2)另一类是中心原子上有孤对电子(未用于形成共价键的电子对)的分子,如H2O和NH3,中心原子上的孤对电子也要占据中心原子周围的空间,并与成键电子对互相排斥。
例如,H2O和NH3的中心原子分别有2 对和 l 对孤对电子,跟中心原子周围的σ键加起来都是4,它们相互排斥,形成四面体,因而H2O分子呈V形,NH3分子呈三角锥形。
2.2.3 杂化轨道理论简介
杂化轨道理论是指在形成分子时,由于原子的相互影响,若干不同类型(主要是s,p轨道)能量相近的原子轨道混合起来,重新组合成一组新轨道,这种轨道重新组合的过程叫做杂化,所形成的新轨道就称为杂化轨道 。
常见的杂化轨道类型: 由于ns,np能级接近,往往采用sp型杂化,而sp型杂化又分为:
杂化
杂化
杂化
分子构型与杂化类型的关系
(1) 杂化-----四面体形
用2s与3个2p轨道混杂,形成四个完全相同的新轨道,称为等性 杂化。
每个 杂化轨道都含有s和p的成分, 杂化轨道间的夹角为109°28’。空间构型为空间正四面体形。如CH4分子的结构如图
而O,N因为有孤对电子采取的是不等性 杂化,故四个轨道成空间四面体,而分子的空间构型则成V形和三角锥形 。
(2) 杂化——平面三角形: 杂化轨道是由一个ns轨道和两个np轨道组合而成的,每个 杂化轨道都含有s和p成分,杂化轨道间的夹角为120°,呈平面三角形如:BF3分子 。
sp2杂化轨道示意图
HF3分子结构示意图
(3) 杂化——直线形: 型杂化轨道是由一个ns轨道和一个np轨道组合而成的,每个 杂化轨道含有s和p的成分,轨道间的夹角为180°呈直线形。
BeCl分子形成示意图
思考:前三种溶液呈天蓝色大概与什么物质有关?依据是什么?
2.2.4 配合物理简介
CuSO4 CuCl·2H2O CuBr2 NaCl K2SO4 KBr
固体颜色 白色 绿色 深褐色 白色 白色 白色
溶液颜色 天蓝色 天蓝色 天蓝色 无色 无色 无色
Cu
OH2
H2O
H2O
H2O
2+
配位化合物,简称配合物,通常是由中心离子(或原子) 与配位体(某些分子或阴离子) 以配位键的形式结合而成的复杂离子或分子。
2+
Cu
NH3
H3N
NH3
NH3
实验2-2 已知氢氧化铜与足量氨水反应后溶解是因为生成[Cu(NH3)4]2+ ,其结构简式为:
试写出实验中发生的两个反应的离子方程式?
Cu 2+ +2NH3 .H2O Cu(OH)2 +2 NH4 +
Cu(OH)2 + 4NH3·H2O [Cu(NH3) 4]2+ +2OH-+4H2O
蓝色沉淀
深蓝色溶液
实验2-3
Fe 3+ +SCN— [Fe (SCN) ]2+
硫氰酸根
血红色
由于该离子的颜色极似血液,常被用于电影特技和魔术表演。
练习书写:
向硝酸银溶液中逐渐滴加氨水的离子方程式。
配合物的组成
1.中心离子或原子(也称形成体) 有空轨道
主要是一些过渡金属,如铁、钴、镍、铜、银、金、铂等金 属元素的离子;
或是具有高氧化数的非金属元素,硼,硅、磷等,如Na[BF4] 中的B(Ⅲ)、K2[SiF6]中的Si(Ⅳ)和NH4[PF6]中的P(Ⅴ);
或是不带电荷的中性原子,如[Ni(CO)4], [Fe(CO)5]中的Ni, Fe都是中性原子;
碱金属、碱土金属等可作为螯合物的形成体。
[Cu(NH3)4]SO4中,NH3是配位体,N为配位原子。
2. 配位体和配位原子 有孤对电子
a. 单齿配位体(一个配位体中只有一个配位原子)
含氮配位体 NH3 , NCS - ;含硫配位体 SCN- ;
含卤素配位体 F- , Cl- , Br- , I- ; 含碳配位体 CN- , CO ;
含氧配位体 H2O, OH- ,羧酸,醇,醚等。
b. 多齿配位体(有两个或两个以上的配位原子)
乙二胺 NH2一CH2一CH2一NH2 简写为en;
乙二胺四乙酸根(EDTA)等。
3.配位数
(与中心离子直接以配位键结合的配位原子个数)
例:[AlF6]3- 配位数6 、 [Cu(NH3)4]SO4 配位数4 、
[Co(NH3)2(en)2](NO3)3 配位数6
* 中心离子的电荷高,对配位体的吸引力较强,有利于形成配位数较高的配合物。
常见的配位数与中心离子的电荷数有如下的关系:
中心离子的电荷:+1 +2 +3 +4
常见的配位数: 2 4(或6) 6(或4) 6(或8)
* 中心离子半径越大,其周围可容纳配体就越多,配位数越大。
配离子的电荷等于中心离子电荷与配位体总电荷的代数和。 如 K2[PtCl4]
4. 配离子的电荷
配位化合物的命名
配位数—配位体名称—合—中心离子(用罗马数字表示氧化数)。
用二、三、四等数字表示配位体数。不同配位名称之间用圆点“·”分开。 阴离子次序为:简单离子——复杂离子——有机酸根离子。
中性分子次序为:NH3—H2O—有机分子。
配合物的盐与复盐的比较
复盐, 能电离出两种或两种以上阳离子的盐如明矾 KAl(SO4)2·12H2O、光卤石 KCl · MgCl2· 6H2O等,仅在固态时稳定存在,一旦溶于水,几乎全部解离成各组分离子:
KAl(SO4)2·12H2O (溶于水) → K+ +Al3++ 2SO42- +12 H2O
KCl · MgCl2 · 6H2O (溶于水) → K+ +Mg2+ + 3Cl- + 6H2O
配合物盐,是在配合物的溶液或晶体中,十分明确地存在着含有配位键的、能独立存在的复杂组成的离子:
[Cu(NH3)4]SO4·H2O → [Cu(NH3)4]2+ + SO42- + H2O
代表物 中心原子
结合的原子数 分子类型 空间构型
中心原子
无孤对电子 CO2 2 AB2
CH2O 3 AB3
CH4 4 AB4
中心原子
有孤对电子 H2O 2 AB2
NH3 3 AB3
直线形
平面三角形
正四面体
V 形
三角锥形
价层电子对互斥模型
课堂小结
杂化轨道中sp型杂化分为:
杂化: 一个s轨道和一个p轨道间的杂化。
杂化: 一个s轨道和两个这轨道间的杂化。
杂化: 一个s轨道和三个p轨道间的杂化。
配位键形成条件:
“电子对给予体”——含有孤电子对
“接受体”——含有空轨道
过渡金属配合物比主族金属配合物多。
1.下列分子的立体结构,其中属于直线型分子的是 ( )
A. H2O B. CO2
C. C2H2 D. P4
BC
2.用VSEPR模型预测,下列分子中键角不是1200的是 ( )
A.C2H2 B.C6H6
C.BF3 D.NH3
DA
课堂练习
3.Co(NH3)5BrSO4可形成两种钴的配合物 ,已知两种配合物的分子式分别为[Co(NH3)5Br]SO4 和[Co(SO4)(NH3)5]Br。
(1) 若在第一种配合物的溶液中加BaCl2 溶液时, 产生_____________________现象;
(2) 如果在第二种配合物的溶液中加入BaCl2溶液时,产生_________________________现象;
(3) 若在第二种配合物的溶液中加入 AgNO3溶液时,产生____________________________现象。
白色沉淀
无明显现象
淡黄色沉淀
4.判断以下常见分子的中心原子的杂化轨道类型(用序号填空)
①[NH4]+ ②CH2O ③NH3 ④SO2 ⑤BeCl2
⑥H2O ⑦CO2
sp3 杂化的是 ,sp2 杂化的是 , 杂化的是 。
5、7
1、3、6
2、4
5.为什么H2O分子的键角既不是90°也不是109°28′而是104.5°?
答案:不等性 杂化
6.把CoCl2溶解于水后加氨水,直到先生成的Co(OH)2沉淀又溶解后,再加氨水,使之生成[Co(NH3)6]2+。此时向溶液中通入空气,得到的产物中有一种配合物其组成可用CoCl3·5NH3表示。把分离出的CoCl3·5NH3溶于水后立即加硝酸银溶液,则析出AgCl沉淀。经测定,每1mol CoCl3·5NH3只生成2molAgCl。 通过计算,确定此配合物的化学式。
答案:[Co(NH3)5Cl]Cl2
ABn 分子的立体构型 典型例子
n=2 直线形 CO2、HCN
n=3 平面三角形 CH2O、BF3
n=4 正四面体 CH4、CCl4
1.
习题答案
2.在乙炔分子中,2个碳原子各以1个sp杂化轨道与氢原子形成1个碳氢σ键,同时又各以其另1个sp杂化轨道形成1个碳碳σ键,除此之外,每个碳原子通过2个未参加杂化的p轨道(互相垂直)形成2个π键,因此,乙炔的三键中有1个键和2个π键。
3.甲醛分子的立体构型:
碳原子采取sp2杂化,甲醛分子中有2个C-H σ键,而C-O之间有1个σ键和1个π键。
4.氢离子接受水分子中氧原子上的孤电子对以配位键形成H3O + ,电子对给予体是H2O,接受体是氢离子 。
5.银离子与氯离子形成难溶于水的沉淀。加入氨水以后,银离子接受氨分子中氮原子给出的孤电子对以配位键形成[ Ag(NH3)2]+,由于生成了可溶性的[ Ag(NH3)2]+ ,继续加入氨水时氯化银就溶解了。
