人教版 选修3 高二化学 第二章 2.3 分子性质 教学课件(共39张ppt)
文档属性
| 名称 | 人教版 选修3 高二化学 第二章 2.3 分子性质 教学课件(共39张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-01 11:09:51 | ||
图片预览











文档简介
(共39张PPT)
为什么等浓度的硫酸酸性大于亚硫酸的酸性?
导入新课
为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?
碘
蔗糖
氨水
萘
2.3分子的性质
知识与能力
1.了解极性共价键和非极性共价键、极性分子和非极性分子的概念。
2.了解化学键的极性与分子的极性的关系。
3.结合常见物质分子立体结构,判断极性分子和非极性分子。
4.知道“相似相溶”规则的实际应用和运用分子结构的知识解释无机含氧酸分子的酸性。
5.了解手性分子在生命科学等方面的应用。
6.知道怎样比较无机含氧酸的酸性 。
教学目标
过程与方法
通过引导学生观察、对比、分析、实验、建立模型和抽象思维,向学生渗透化学学科研究的基本思想方法:
①从宏观到微观,探究“结构决定性质,性质反映结构”的关系;
②从现象到本质,加强实验和理论的结合,协同揭示化学中的“因果”关系。
?
情感态度与价值观
1.培养学生求实、合作、进取的优良品质和严谨认真的科学态度。
2.通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
重点
1.极性分子和非极性分子。
2.分子间作用力、氢键及其对物质性质的影响。
难点
1.手性分子。
2.无机含氧酸的酸性。
教学重难点
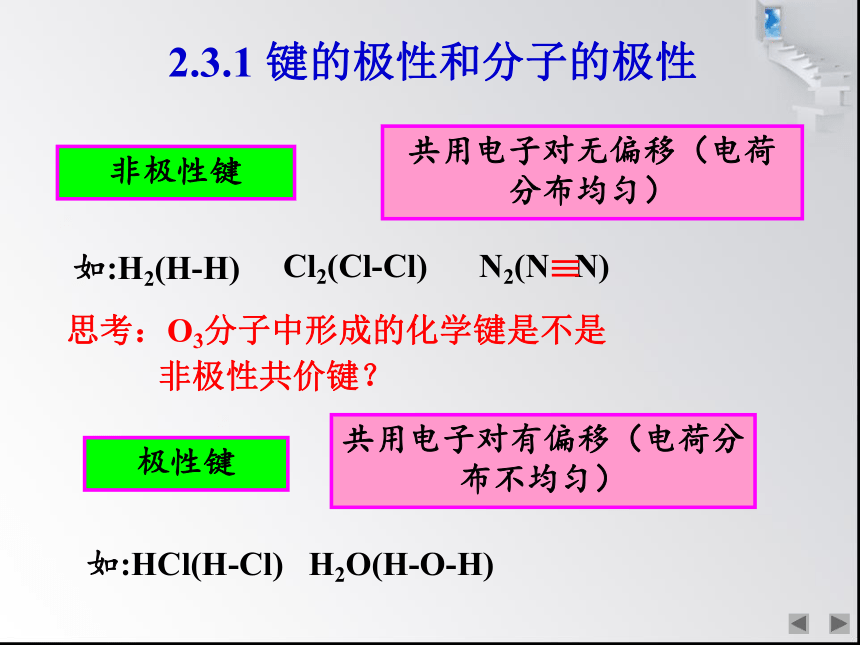
非极性键
共用电子对无偏移(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏移(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
思考:O3分子中形成的化学键是不是
非极性共价键?
2.3.1 键的极性和分子的极性
(一)键的极性(判断方法)
同种非金属元素原子间形成的共价键。
不同种非金属元素原子间形成的共价键。
1.非极性键:
2.极性键:
指出下列物质中的共价键类型
1.O2
2.CH4
3.CO2
4.H2O2
5.Na2O2
6.NaOH
非极性键
极性键
极性键
极性键 非极性键
非极性键
极性键
(二)分子的极性(化学键的极性向量和)
1.含义:
假设分子中存在一个正电荷中心和负电荷中心,那么这两个中心是否重合,就决定了分子是否有极性。
若重合,则为非极性分子;
若不重合,为极性分子。
非极性分子
电荷分布均匀对称的分子
只含有非极性键的分子一定是非极性分子。
极性分子
电荷分布不均匀对称的分子
H
Cl
共用电子对
H
Cl
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子。
δ+
δ-
以极性键结合的双原子分子为极性分子
2.3.2 范德华力及其对物质性质的影响
范德华力是指分子间的相互作用力。
范德华力分为三种力:
(1)取向力 存在于极性分子与极性分子之间,这是由极性分子的取向而产生的。
(2)诱导力 存在于极性分子与非极性分子和极性分子与极性分子之间,这是由诱导偶极而产生的力。
(3)色散力 存在于非极性分子之间。
对范德华力的理解
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、圆子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。
氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
2.3.3 氢键及其对物质性质的影响
氢键的存在
氢键可分为分子间氢键和分子内氢键两大类。一个分子中的X-H与另一个分子的Y结合而成的氢键成为分子间氢键。如:水分子之间、甲酸分子之间,以及氨分子与水分子之间等。一般成直线型,在某些分子里,如:邻羟基苯甲醛分子中,O-H与相邻的醛基中的O形成的氢键在分子内部,故称分子内氢键。不能在一条直线上。
氢键的形成对化合物性质的影响
(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。
2.3.4 溶解性
相似相溶原理:
“凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律。
由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”
利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。
例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H2O是极性分子,所以它是极性溶剂。
Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2SO4是强极性分手,易溶于水而难溶于CCl4。
相似相溶同样适用于分子结构相似的物质
例如:乙醇的-OH与水分子的-OH相近,因而乙醇和水能互溶。丁醇的羟基与水的-OH相似性小的多,以至于它在水中的溶解度较小。
氢键对溶解性的影响
若溶剂和溶质间存在氢键作用力,那么氢键作用力越大,溶解性就越好;相反,没有氢键相互作用的 溶质在有氢键的溶剂中的溶解度就小。
相似相溶(水和甲醇)
↗
氢键
2.3.5 手性
具有完全相同的组成和原子排列的一对分子,互为镜像却在三维中不能重叠,互称手性异构体。
手性异构体犹如左手和右手
例如:乳酸分子CH3CHOHCOOH有以下两种异构体:
判断分子是否手性的依据:
※凡具有对称 面、对称中心的分子,都是非手性分子。
※有无对称轴,对分子是否有手性无决定作用。
一般:
※当分子中只有一个C* ,分子一定有手性。
※当分子中有多个手性中心时,要借助对称因素。 无对称面,又无对称中心的分子,必是手性分子。
科学史话:巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!
2.3.6 无机含氧酸分子的酸性
把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)。
含氧酸的通式为(HO)m ROn,如果R相同,则n越大,R的正电性越高,导致R-O-H中的O的电子向R偏移,所以在水的作用下,电离出H+越容易,也就是酸性越强。
无机含氧酸强度的变化本质
含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
H2SiO4 H3PO4 H2SO4 HClO4
HClO HClO3 HClO4
HClO HBrO HIO
练习:比较下列含氧酸酸性的强弱
无机含氧酸强度的变化规律
同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。
同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。
同一元素不同价态的含氧酸酸性高价强于低价 。
键的极性与分子极性的关系:
课堂小结
A.都是由非极性键构成的分子一定是极性分子。
B.极性键结合形成的双原子分子一定为极性分子。
C.极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D.多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
溶质分子与溶剂分子的结构越相似,相互溶解越容易。
溶质分子的分子间力与溶剂分子的分子间力越相似,越易互溶。
范德华力相对分子质量越大,越大;分子的极性越大,范德华力越大。
通常情况下,范德华力较大者,熔点和沸点较高,溶解度也较高。
对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
氢键分为分子间氢键和分子内氢键。
分子间氢键可使熔沸点升高,分子内氢键可使熔沸点降低。
氢键可增强溶解度。
手性分子的原子组成和排列相同并且互为镜像,却不能重叠。手性分子之间的化学性质不完全相同。
1.通常情况下,氮气不易发生化学反应的原因是 ( )
A. N2是非极性分子
B. N2的相对分子质量较小
C. N2分子由N≡N键结合而成,键能大
D. 氮的非金属性比氧弱
2.下列元素的最高价氧化物所对应的水化物中酸性最强的是 ( )
A.氟 B.碳
C.氮 D.氯
C
D
课堂练习
3.NO是空气污染物之一。近年来发现许多生物体组织存在少量NO,它有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点。请回答下列问题:
(1)NO在大气层中可发生反应 NO + O3 → NO2 + O ; NO2 + O → NO + O2从反应过程和最终结果看,NO是一种__________。
A. 氧化剂 B. 还原剂 C. 还原产物 D. 氧化产物 E. 催化剂
(2)若使NO转化为无毒气体,可选用NH3消除NO对环境造成的污染。写出该反应出电子转移的总数__________e-。
BCE
12
1.水是V形分子,氢氧键为极性键,所以水分子中正电荷的中心和负电荷的中心不重合,为极性分子。而二氧化碳为直线型分子,虽然碳氧键为极性键,但分子的正电荷中心和负电荷中心重合,所以为非极性分子。
习题答案
2.低碳醇如甲醇或乙醇,其中的-OH与水分子的-OH相近,因而能与水互溶,而高碳醇的羟基较大,使其中的-OH与水分子的-OH的相似因素少多了,因而它们在水中的溶解度明显减小。
3.水是极性分子,而汽油是非极性分子,根据“相似相溶”规则,汽油在水中的溶解度应很小。
4.(1)氢键不是化学键,而是较强的分子间作用力。
(2)由于甲烷中的碳不是电负性很强的元素,故甲烷与水分子间一般不形成氢键。
(3)乙醇与水分子键不但存在范德华力,也存在氢键。
(4)碘化氢的沸点比氯化氢高是由于碘化氢的相对分子质量大于氯化氢的,相对分子质量越大,范德华力越大,沸点越高。
5.两张图表明气态氢化物的沸点一般随相对分子质量增加而增大的,这是由于相对分子质量越大,范德华力越大,沸点越高。但氟化氢、水和氨的沸点反常地高,表明在它们的分子之间存在较强的相互作用,即氢键。
6.对羟基苯甲酸的沸点高。因为对羟基苯甲酸在分子间形成氢键,而邻羟基苯甲酸在分子内形成了氢键,分子之间不存在氢键。
为什么等浓度的硫酸酸性大于亚硫酸的酸性?
导入新课
为什么蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水?
碘
蔗糖
氨水
萘
2.3分子的性质
知识与能力
1.了解极性共价键和非极性共价键、极性分子和非极性分子的概念。
2.了解化学键的极性与分子的极性的关系。
3.结合常见物质分子立体结构,判断极性分子和非极性分子。
4.知道“相似相溶”规则的实际应用和运用分子结构的知识解释无机含氧酸分子的酸性。
5.了解手性分子在生命科学等方面的应用。
6.知道怎样比较无机含氧酸的酸性 。
教学目标
过程与方法
通过引导学生观察、对比、分析、实验、建立模型和抽象思维,向学生渗透化学学科研究的基本思想方法:
①从宏观到微观,探究“结构决定性质,性质反映结构”的关系;
②从现象到本质,加强实验和理论的结合,协同揭示化学中的“因果”关系。
?
情感态度与价值观
1.培养学生求实、合作、进取的优良品质和严谨认真的科学态度。
2.通过揭示物质之间的普遍联系,培养学生运用辩证唯物主义观点分析化学现象。
重点
1.极性分子和非极性分子。
2.分子间作用力、氢键及其对物质性质的影响。
难点
1.手性分子。
2.无机含氧酸的酸性。
教学重难点
非极性键
共用电子对无偏移(电荷分布均匀)
如:H2(H-H)
Cl2(Cl-Cl)
N2(N N)
极性键
共用电子对有偏移(电荷分布不均匀)
如:HCl(H-Cl) H2O(H-O-H)
思考:O3分子中形成的化学键是不是
非极性共价键?
2.3.1 键的极性和分子的极性
(一)键的极性(判断方法)
同种非金属元素原子间形成的共价键。
不同种非金属元素原子间形成的共价键。
1.非极性键:
2.极性键:
指出下列物质中的共价键类型
1.O2
2.CH4
3.CO2
4.H2O2
5.Na2O2
6.NaOH
非极性键
极性键
极性键
极性键 非极性键
非极性键
极性键
(二)分子的极性(化学键的极性向量和)
1.含义:
假设分子中存在一个正电荷中心和负电荷中心,那么这两个中心是否重合,就决定了分子是否有极性。
若重合,则为非极性分子;
若不重合,为极性分子。
非极性分子
电荷分布均匀对称的分子
只含有非极性键的分子一定是非极性分子。
极性分子
电荷分布不均匀对称的分子
H
Cl
共用电子对
H
Cl
HCl分子中,共用电子对偏向Cl原子,∴Cl原子一端相对地显负电性,H原子一端相对地显正电性,整个分子的电荷分布不均匀,∴为极性分子。
δ+
δ-
以极性键结合的双原子分子为极性分子
2.3.2 范德华力及其对物质性质的影响
范德华力是指分子间的相互作用力。
范德华力分为三种力:
(1)取向力 存在于极性分子与极性分子之间,这是由极性分子的取向而产生的。
(2)诱导力 存在于极性分子与非极性分子和极性分子与极性分子之间,这是由诱导偶极而产生的力。
(3)色散力 存在于非极性分子之间。
对范德华力的理解
①分子间作用力比化学键弱得多,它主要影响物质的熔点、沸点、溶解性等物理性质,而化学键主要影响物质的化学性质。
②分子间作用力只存在于由分子构成的物质之间,离子化合物、圆子化合物、金属之间不存在范德华力。
③分子间作用力范围很小,即分子充分接近时才有相互间的作用力。
④分子的大小、分子的极性对范德华力有显著影响。结构相似的分子,相对分子质量越大范德华力越大;分子的极性越大,范德华力也越大。
氢键的本质
氢原子与电负性大的原子X以共价键结合时,H原子还能够跟另外一个电负性大的原子Y之间产生静电引力的作用,成为氢键,表示为:X-H…Y(X、Y为N、O、F)。
氢键的特征
氢键既有方向性(X-H…Y尽可能在同一条直线上),又有饱和性(X-H只能和一个Y原子结合)。氢键的大小,介于化学键与范德华力之间,不属于化学键。但也有键长、键能。
2.3.3 氢键及其对物质性质的影响
氢键的存在
氢键可分为分子间氢键和分子内氢键两大类。一个分子中的X-H与另一个分子的Y结合而成的氢键成为分子间氢键。如:水分子之间、甲酸分子之间,以及氨分子与水分子之间等。一般成直线型,在某些分子里,如:邻羟基苯甲醛分子中,O-H与相邻的醛基中的O形成的氢键在分子内部,故称分子内氢键。不能在一条直线上。
氢键的形成对化合物性质的影响
(1)对沸点和熔点的影响
分子间氢键使物质熔、沸点升高。而分子内氢键使物质的沸点和熔点降低。
(2)对溶解度的影响
极性溶剂里,溶质分子与溶剂分子间的氢键使溶质溶解度增大,而当溶质分子形成分子间氢键使恰好相反。
2.3.4 溶解性
相似相溶原理:
“凡是分子结构相似的物质,都是易于互相溶解的。”这是从大量事实总结出来的一条规律。
由于分子的极性是否相似对溶解性影响很大,所以,相似相溶原理又可以理解为“极性分子易溶于极性溶剂中,非极性分子易溶于非极性溶剂中。”
利用相似相溶原理,有助于我们判断物质在不同溶剂中的溶解性。
例如:CCl4是非极性分子,作为溶剂它就是非极性溶剂;而H2O是极性分子,所以它是极性溶剂。
Br2、I2等都是非极性分子,所以易溶于CCl4、苯等非极性溶剂,而在水这一极性溶剂中溶解度就很小。相反,盐类(NaCl等)这些离子化合物可看做是极性最强的,它们就易溶于水而不溶于CCl4、苯等非极性溶剂。HCl、H2SO4是强极性分手,易溶于水而难溶于CCl4。
相似相溶同样适用于分子结构相似的物质
例如:乙醇的-OH与水分子的-OH相近,因而乙醇和水能互溶。丁醇的羟基与水的-OH相似性小的多,以至于它在水中的溶解度较小。
氢键对溶解性的影响
若溶剂和溶质间存在氢键作用力,那么氢键作用力越大,溶解性就越好;相反,没有氢键相互作用的 溶质在有氢键的溶剂中的溶解度就小。
相似相溶(水和甲醇)
↗
氢键
2.3.5 手性
具有完全相同的组成和原子排列的一对分子,互为镜像却在三维中不能重叠,互称手性异构体。
手性异构体犹如左手和右手
例如:乳酸分子CH3CHOHCOOH有以下两种异构体:
判断分子是否手性的依据:
※凡具有对称 面、对称中心的分子,都是非手性分子。
※有无对称轴,对分子是否有手性无决定作用。
一般:
※当分子中只有一个C* ,分子一定有手性。
※当分子中有多个手性中心时,要借助对称因素。 无对称面,又无对称中心的分子,必是手性分子。
科学史话:巴斯德实验室合成的有机物酒石酸盐并制得手性机物酒石酸盐过程。
多美的晶体啊!
2.3.6 无机含氧酸分子的酸性
把含氧酸的化学式写成(HO)m ROn,
就能根据n值判断常见含氧酸的强弱。
n=0,极弱酸,如硼酸(H3BO3)。
n=1,弱酸,如亚硫酸(H2SO3)。
n=2,强酸,如硫酸(H2SO4)、硝酸(HNO3)
n=3,极强酸,如高氯酸(HClO4)。
含氧酸的通式为(HO)m ROn,如果R相同,则n越大,R的正电性越高,导致R-O-H中的O的电子向R偏移,所以在水的作用下,电离出H+越容易,也就是酸性越强。
无机含氧酸强度的变化本质
含氧酸的强度取决于中心原子的电负性、原子半径、氧化数。
当中心原子的电负性大、原子半径小、氧化数高时,使O-H键减弱,酸性增强。
H2SiO4 H3PO4 H2SO4 HClO4
HClO HClO3 HClO4
HClO HBrO HIO
练习:比较下列含氧酸酸性的强弱
无机含氧酸强度的变化规律
同周期的含氧酸,自左至右,随中心原子原子序数增大 ,酸性增强。
同一族的含氧酸,自上而下,随中心原子原子序数增大 ,酸性减弱。
同一元素不同价态的含氧酸酸性高价强于低价 。
键的极性与分子极性的关系:
课堂小结
A.都是由非极性键构成的分子一定是极性分子。
B.极性键结合形成的双原子分子一定为极性分子。
C.极性键结合形成的多原子分子,可能为 非极性分子,也可能为极性分子。
D.多原子分子的极性,应有键的极性和分子的空间构型共同来决定。
溶质分子与溶剂分子的结构越相似,相互溶解越容易。
溶质分子的分子间力与溶剂分子的分子间力越相似,越易互溶。
范德华力相对分子质量越大,越大;分子的极性越大,范德华力越大。
通常情况下,范德华力较大者,熔点和沸点较高,溶解度也较高。
对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强。
氢键分为分子间氢键和分子内氢键。
分子间氢键可使熔沸点升高,分子内氢键可使熔沸点降低。
氢键可增强溶解度。
手性分子的原子组成和排列相同并且互为镜像,却不能重叠。手性分子之间的化学性质不完全相同。
1.通常情况下,氮气不易发生化学反应的原因是 ( )
A. N2是非极性分子
B. N2的相对分子质量较小
C. N2分子由N≡N键结合而成,键能大
D. 氮的非金属性比氧弱
2.下列元素的最高价氧化物所对应的水化物中酸性最强的是 ( )
A.氟 B.碳
C.氮 D.氯
C
D
课堂练习
3.NO是空气污染物之一。近年来发现许多生物体组织存在少量NO,它有扩张血管、免疫、增强记忆的功能,成为当前生命科学的研究热点。请回答下列问题:
(1)NO在大气层中可发生反应 NO + O3 → NO2 + O ; NO2 + O → NO + O2从反应过程和最终结果看,NO是一种__________。
A. 氧化剂 B. 还原剂 C. 还原产物 D. 氧化产物 E. 催化剂
(2)若使NO转化为无毒气体,可选用NH3消除NO对环境造成的污染。写出该反应出电子转移的总数__________e-。
BCE
12
1.水是V形分子,氢氧键为极性键,所以水分子中正电荷的中心和负电荷的中心不重合,为极性分子。而二氧化碳为直线型分子,虽然碳氧键为极性键,但分子的正电荷中心和负电荷中心重合,所以为非极性分子。
习题答案
2.低碳醇如甲醇或乙醇,其中的-OH与水分子的-OH相近,因而能与水互溶,而高碳醇的羟基较大,使其中的-OH与水分子的-OH的相似因素少多了,因而它们在水中的溶解度明显减小。
3.水是极性分子,而汽油是非极性分子,根据“相似相溶”规则,汽油在水中的溶解度应很小。
4.(1)氢键不是化学键,而是较强的分子间作用力。
(2)由于甲烷中的碳不是电负性很强的元素,故甲烷与水分子间一般不形成氢键。
(3)乙醇与水分子键不但存在范德华力,也存在氢键。
(4)碘化氢的沸点比氯化氢高是由于碘化氢的相对分子质量大于氯化氢的,相对分子质量越大,范德华力越大,沸点越高。
5.两张图表明气态氢化物的沸点一般随相对分子质量增加而增大的,这是由于相对分子质量越大,范德华力越大,沸点越高。但氟化氢、水和氨的沸点反常地高,表明在它们的分子之间存在较强的相互作用,即氢键。
6.对羟基苯甲酸的沸点高。因为对羟基苯甲酸在分子间形成氢键,而邻羟基苯甲酸在分子内形成了氢键,分子之间不存在氢键。
