广东省汕头市汕头华侨中学高一化学第四章第一节硅(共36张PPT)
文档属性
| 名称 | 广东省汕头市汕头华侨中学高一化学第四章第一节硅(共36张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-04 00:00:00 | ||
图片预览









文档简介
(共36张PPT)
1 无机非金属材料的主角——硅
第四章非金属及其化合物
硅与碳一样,最外层电子数是4,既不易失去电子也不易得到电子(p74)
一、硅原子结构
C
Si
硅的化学性质不活泼,主要形成四价化合物。
结构
性质
决 定
1、二氧化硅(SiO2)
2、硅酸盐
思考:为什么自然界不存在游离态的单质硅?
硅是一种亲氧元素,在自然界中它总是与氧相互化合的(与碳不同) (p74)
二、硅元素自然界存在形式
硅是构成岩石与许多矿物的基本元素 (p74)
硅的氧化物和硅酸盐构成了地壳中大部分的岩石、沙子和土壤,约在地壳质量的90%以上。(p74)
?硅在自然界分布极广,仅次于氧。
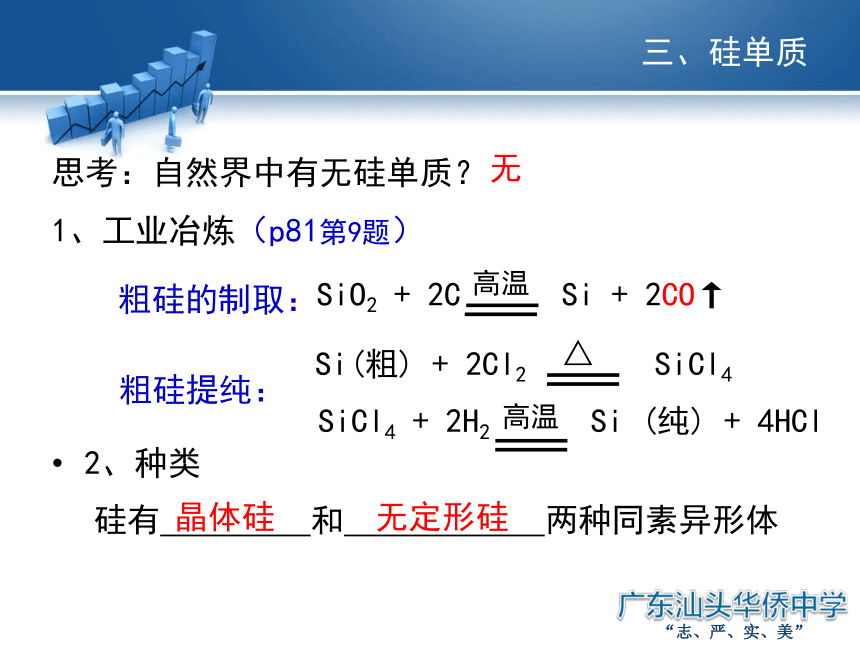
思考:自然界中有无硅单质?
1、工业冶炼(p81第9题)
2、种类
三、硅单质
硅有 和 两种同素异形体
晶体硅
无定形硅
粗硅的制取:
粗硅提纯:
无
3、晶体硅的物理性质
有金属光泽的灰黑色固体
结构类似金刚石,熔点高(1410℃),硬度大,有脆性
重要的半导体材料,导电性介于导体和绝缘体之间
三、硅单质
三、硅单质
4、化学性质
常温下硅单质的化学性质不活泼,只能跟O2、Cl2、HF和NaOH溶液反应
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Si + 4HF = SiF4↑ + 2H2↑
还原剂
氧化剂
(SiF4为无色气体)
硅酸钠
5、主要用途
①信息技术的关键材料,如硅芯片、
晶体管。
②制成光电池,将光能(太阳能)直
接转换为电能。
三、硅单质
——利用硅的半导体性能
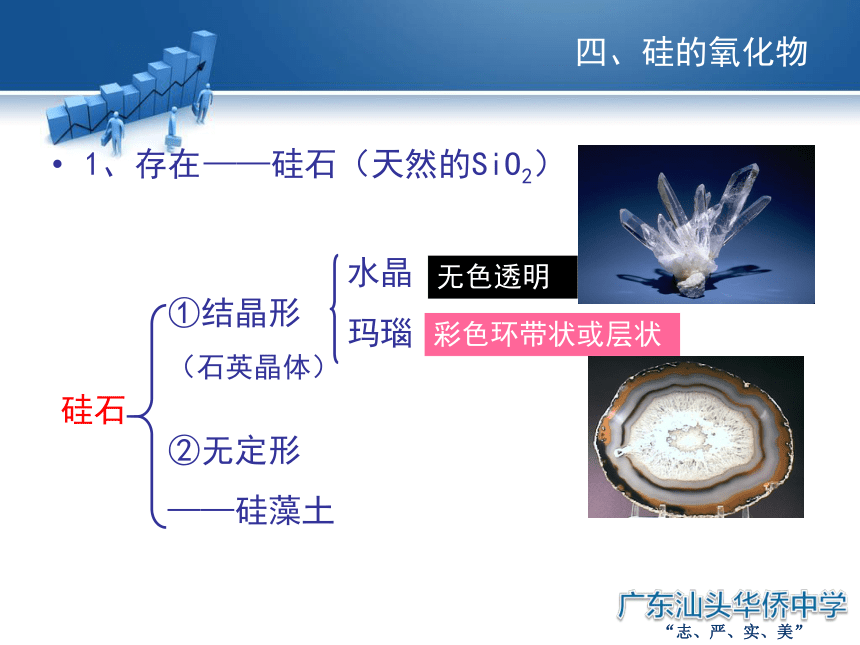
1、存在
①结晶形
(石英晶体)
②无定形
——硅藻土
水晶
玛瑙
——硅石(天然的SiO2)
硅石
无色透明
彩色环带状或层状
四、硅的氧化物
四、硅的氧化物
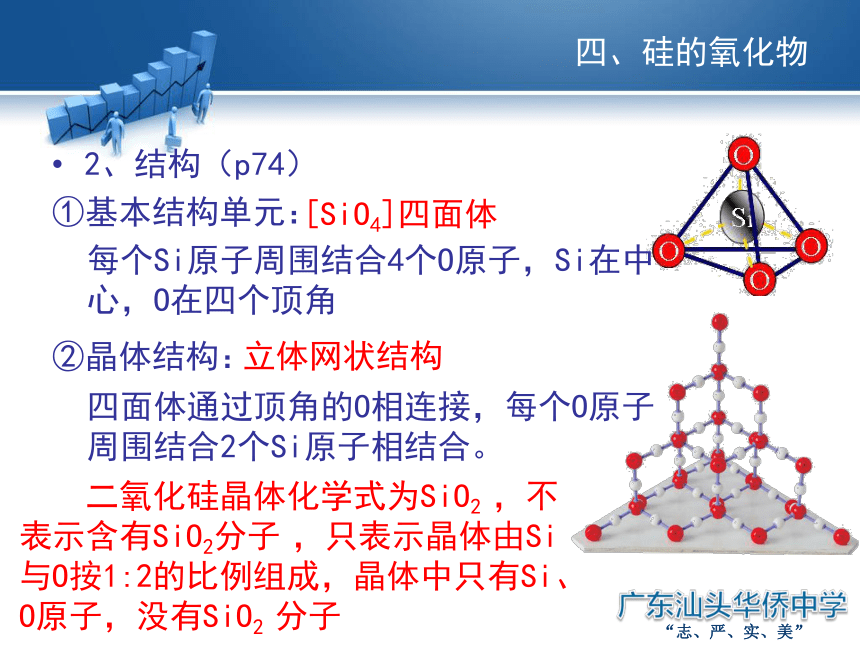
2、结构(p74)
基本结构单元:
晶体结构:
二氧化硅晶体化学式为SiO2 ,不表示含有SiO2分子 ,只表示晶体由Si与O按1:2的比例组成,晶体中只有Si、O原子,没有SiO2 分子
每个Si原子周围结合4个O原子,Si在中心,O在四个顶角
四面体通过顶角的O相连接,每个O原子周围结合2个Si原子相结合。
[SiO4]四面体
立体网状结构
P76[思考与交流]
SiO2具有哪些物理性质和化学性质?SiO2的性质由什么决定?
由结构决定的,是空间立体网状结构,因此性质很稳定。
物理性质:_____________________________
化学性质:_________________________
稳定,除HF外不与其它酸反应,可以与强碱如NaOH等反应,属酸性氧化物
硬度大、熔点高、难溶于水
观察下图,思考为何盛放NaOH溶液和氢氟酸溶液的试剂瓶与其他溶液不同?
四、硅的氧化物
CuSO4溶液 FeCl3溶液 NaOH溶液 氢氟酸
四、硅的氧化物
3、化学性质
(1)通性——具有酸性氧化物的性质
① 与强碱反应生成盐和水
② 与碱性氧化物反应生成盐
(有粘性,其溶液俗称水玻璃)
玻璃中含有SiO2,但光滑的玻璃与NaOH溶液几乎不反应,而磨砂的玻璃会与NaOH溶液反应生成Na2SiO3,使玻璃瓶塞与试剂瓶粘在一起。
(通常很不活泼)
(2)特性——氢氟酸是唯一可以与之反应的酸
(3)在高温下能与还原剂反应,表现弱氧化性
此反应常用于雕刻玻璃
四、硅的氧化物
与水反应
与碱性氧
化物反应
(CaO)
与碱反应
(NaOH)
CO2 + H2O = H2CO3
CO2 + 2NaOH =
Na2CO3 + H2O
CO2 + CaO = CaCO3
不能反应
SiO2 + CaO = CaSiO3
高温
SiO2 + 2NaOH =
Na2SiO3 + H2O
与酸反应
SiO2 + 4HF = SiF4↑ + 2H2O
二氧化硅和二氧化碳的化学性质比较
——
二氧化碳 CO2 二氧化硅 SiO2
4、用途
石英玻璃
耐磨材料——轴承、耐磨器皿
电子器件——压电开关、石英钟表、光学仪器
四、硅的氧化物
④工艺品——水晶、玛瑙
⑤光导纤维
四、硅的氧化物
光导纤维就是比头发丝还细的、能传导光信号的玻璃丝,能对光进行全反射传导,信号损失率极低。
四、硅的氧化物
⑥制普通硅酸盐玻璃的原料:
石灰石、纯碱、石英
制备玻璃原理:
玻璃成分:
CaSiO3、Na2SiO3 、SiO2
五、硅酸(H2SiO3 )
1、制取 (实验4-1)
溶液颜色由无色变成 色
红
Na2SiO3 + 2HCl=
2NaCl + H2SiO3(胶体)
红
无
白色胶状沉淀
大于
碱
Na2SiO3溶液呈 性
溶液颜色由 色逐渐变成 色,最后出现
化学方程式:
酸性强弱:
盐酸 硅酸
原理:强酸制弱酸
实验步骤 实验现象 结论和解释
在试管中加入2ml饱和Na2SiO3溶液,滴入1-2滴酚酞溶液
再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液颜色变浅并接近消失时停止。
五、硅酸(H2SiO3 )
2、性质
①物理性质:
②化学性质:
弱酸性:
不稳定性:
白色,胶状,不溶于水的物质
酸性比碳酸弱,不能使酸碱指示剂变色。
Na2SiO3 + CO2 + H2O = H2SiO3(胶体)+ Na2CO3
五、硅酸(H2SiO3 )
3、硅胶
硅胶用于干燥剂(吸水)、吸附剂(多孔)、催化剂的载体
H2SiO3
硅酸溶胶
硅酸凝胶
硅胶
聚合
干燥脱水
浓度较大
(SiO2)
六、硅酸盐
1、含义
硅酸盐是由硅、氧和金属元素组成的化合物的总称 。
2、特点:
除Na2SiO3等少数硅酸盐外,一般为结构复杂固态化合物,不溶于水,化学性质很稳定。
六、硅酸盐
3、表示方法(p77)
化学式法: 一般用于组成较简单的硅酸盐。
如硅酸钠( Na2SiO3 )、硅酸钙( CaSiO3 )
氧化物法:针对结构复杂的硅酸盐
如石棉: CaO·3MgO·4SiO2
(普通玻璃的大致组成: Na2O·CaO·6SiO2 )
注:硅酸盐并不是由氧化物组成
3、硅酸钠( Na2SiO3 )
俗称泡花碱,其水溶液即水玻璃,碱性粘稠状。
用于制作木材防火、黏胶剂、硅胶、肥皂填料。
六、硅酸盐
燃烧
不易燃烧
用水玻璃浸泡过的物质可防火
现象
结论
点燃被浸泡过水的木条
点燃被Na2SiO3溶液浸泡过的木条
实验4—2
七、硅酸盐工业
1、传统硅酸盐工业
以含硅物质为原料,经过高温加热制成硅酸盐产品的工业。
如制造水泥、玻璃、陶瓷等产品的工业。
2、新型无机非金属材料
金刚砂(SiC):
硅钢(硅的合金):
硅橡胶:
分子筛:
硬度大,用作磨料
具有导磁性
耐高温、耐低温、良好的弹性、绝缘性
催化剂、吸附性
七、硅酸盐工业
⑴ 玻璃工业
原料 ——
普通玻璃的成分 ——
性质 ——
(2)陶瓷工业
原料 ——
主要成分 ——
没有固定的熔点,只是在一定范围内逐渐软化
纯碱、石灰石、石英
Na2SiO3、CaSiO3、SiO2
黏土
(硅酸盐岩石长期在水和大气中二氧化碳的侵蚀下,风化为黏土,并且形成土壤胶体p77)
铝硅酸盐
七、硅酸盐工业
(3) 水泥工业
原料 —
成分 —
特性——
石灰石、黏土、辅助原料(石膏)
硅酸三钙 3CaO·SiO2
硅酸二钙 2CaO·SiO2
铝酸三钙 3CaO·Al2O3
水硬性(水泥和水掺和搅拌、静止后变硬的特性。)
水泥的水硬性是化学性质,发生的变化属于化学变化。
2.可以用来制取半导体材料(如大规模集成电路)的是 ( )
A.二氧化硅 B.粗硅
C.高纯硅 D.硅酸盐
下列物质中主要成分不是二氧化硅的是( )
A.硅胶 B.水晶
C.玛瑙 D.硅石
A
C
练习
4.下列物质中,能够与NaOH溶液反应的是 ( ) A.碳酸钠 B.硅酸钠
C.二氧化硅 D.氢氧化铝
3.构成地壳基本骨架的非金属元素是 ( )
A.Al B.O
C. Si D.C
C
CD
练习
5.NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中 ( )
A.具有玻璃塞的细口瓶
B.具有玻璃塞的广口瓶
C.带滴管的滴瓶
D.具有橡胶塞的细口瓶
D
练习
6.二氧化硅的化学性质很不活泼,几乎所有的酸都不与其反应,但有一种酸能够和二氧化硅发生反应,这种酸是 ( )
A.浓盐酸 B.硫酸
C.硝酸 D.氢氟酸
D
练习
7.二氧化硅属于酸性氧化物,理由是( )
A.Si是非金属元素
B.SiO2对应的水化物是可溶性弱酸
C.SiO2与强碱反应生成盐和水
D.SiO2不能与酸反应
C
练习
8.下列几种物质其主要成分不是二氧化硅的是( )
①钻石 ②玛瑙 ③金刚砂 ④石英晶体
⑤硅藻土 ⑥水晶 ⑦大理石 ⑧光导纤维
①③⑦
练习
9.下列不属于传统硅酸盐产品的是( )
A.玻璃 B.水泥
C.光导纤维 D.陶瓷
C
练习
1 无机非金属材料的主角——硅
第四章非金属及其化合物
硅与碳一样,最外层电子数是4,既不易失去电子也不易得到电子(p74)
一、硅原子结构
C
Si
硅的化学性质不活泼,主要形成四价化合物。
结构
性质
决 定
1、二氧化硅(SiO2)
2、硅酸盐
思考:为什么自然界不存在游离态的单质硅?
硅是一种亲氧元素,在自然界中它总是与氧相互化合的(与碳不同) (p74)
二、硅元素自然界存在形式
硅是构成岩石与许多矿物的基本元素 (p74)
硅的氧化物和硅酸盐构成了地壳中大部分的岩石、沙子和土壤,约在地壳质量的90%以上。(p74)
?硅在自然界分布极广,仅次于氧。
思考:自然界中有无硅单质?
1、工业冶炼(p81第9题)
2、种类
三、硅单质
硅有 和 两种同素异形体
晶体硅
无定形硅
粗硅的制取:
粗硅提纯:
无
3、晶体硅的物理性质
有金属光泽的灰黑色固体
结构类似金刚石,熔点高(1410℃),硬度大,有脆性
重要的半导体材料,导电性介于导体和绝缘体之间
三、硅单质
三、硅单质
4、化学性质
常温下硅单质的化学性质不活泼,只能跟O2、Cl2、HF和NaOH溶液反应
Si + 2NaOH + H2O = Na2SiO3 + 2H2↑
Si + 4HF = SiF4↑ + 2H2↑
还原剂
氧化剂
(SiF4为无色气体)
硅酸钠
5、主要用途
①信息技术的关键材料,如硅芯片、
晶体管。
②制成光电池,将光能(太阳能)直
接转换为电能。
三、硅单质
——利用硅的半导体性能
1、存在
①结晶形
(石英晶体)
②无定形
——硅藻土
水晶
玛瑙
——硅石(天然的SiO2)
硅石
无色透明
彩色环带状或层状
四、硅的氧化物
四、硅的氧化物
2、结构(p74)
基本结构单元:
晶体结构:
二氧化硅晶体化学式为SiO2 ,不表示含有SiO2分子 ,只表示晶体由Si与O按1:2的比例组成,晶体中只有Si、O原子,没有SiO2 分子
每个Si原子周围结合4个O原子,Si在中心,O在四个顶角
四面体通过顶角的O相连接,每个O原子周围结合2个Si原子相结合。
[SiO4]四面体
立体网状结构
P76[思考与交流]
SiO2具有哪些物理性质和化学性质?SiO2的性质由什么决定?
由结构决定的,是空间立体网状结构,因此性质很稳定。
物理性质:_____________________________
化学性质:_________________________
稳定,除HF外不与其它酸反应,可以与强碱如NaOH等反应,属酸性氧化物
硬度大、熔点高、难溶于水
观察下图,思考为何盛放NaOH溶液和氢氟酸溶液的试剂瓶与其他溶液不同?
四、硅的氧化物
CuSO4溶液 FeCl3溶液 NaOH溶液 氢氟酸
四、硅的氧化物
3、化学性质
(1)通性——具有酸性氧化物的性质
① 与强碱反应生成盐和水
② 与碱性氧化物反应生成盐
(有粘性,其溶液俗称水玻璃)
玻璃中含有SiO2,但光滑的玻璃与NaOH溶液几乎不反应,而磨砂的玻璃会与NaOH溶液反应生成Na2SiO3,使玻璃瓶塞与试剂瓶粘在一起。
(通常很不活泼)
(2)特性——氢氟酸是唯一可以与之反应的酸
(3)在高温下能与还原剂反应,表现弱氧化性
此反应常用于雕刻玻璃
四、硅的氧化物
与水反应
与碱性氧
化物反应
(CaO)
与碱反应
(NaOH)
CO2 + H2O = H2CO3
CO2 + 2NaOH =
Na2CO3 + H2O
CO2 + CaO = CaCO3
不能反应
SiO2 + CaO = CaSiO3
高温
SiO2 + 2NaOH =
Na2SiO3 + H2O
与酸反应
SiO2 + 4HF = SiF4↑ + 2H2O
二氧化硅和二氧化碳的化学性质比较
——
二氧化碳 CO2 二氧化硅 SiO2
4、用途
石英玻璃
耐磨材料——轴承、耐磨器皿
电子器件——压电开关、石英钟表、光学仪器
四、硅的氧化物
④工艺品——水晶、玛瑙
⑤光导纤维
四、硅的氧化物
光导纤维就是比头发丝还细的、能传导光信号的玻璃丝,能对光进行全反射传导,信号损失率极低。
四、硅的氧化物
⑥制普通硅酸盐玻璃的原料:
石灰石、纯碱、石英
制备玻璃原理:
玻璃成分:
CaSiO3、Na2SiO3 、SiO2
五、硅酸(H2SiO3 )
1、制取 (实验4-1)
溶液颜色由无色变成 色
红
Na2SiO3 + 2HCl=
2NaCl + H2SiO3(胶体)
红
无
白色胶状沉淀
大于
碱
Na2SiO3溶液呈 性
溶液颜色由 色逐渐变成 色,最后出现
化学方程式:
酸性强弱:
盐酸 硅酸
原理:强酸制弱酸
实验步骤 实验现象 结论和解释
在试管中加入2ml饱和Na2SiO3溶液,滴入1-2滴酚酞溶液
再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液颜色变浅并接近消失时停止。
五、硅酸(H2SiO3 )
2、性质
①物理性质:
②化学性质:
弱酸性:
不稳定性:
白色,胶状,不溶于水的物质
酸性比碳酸弱,不能使酸碱指示剂变色。
Na2SiO3 + CO2 + H2O = H2SiO3(胶体)+ Na2CO3
五、硅酸(H2SiO3 )
3、硅胶
硅胶用于干燥剂(吸水)、吸附剂(多孔)、催化剂的载体
H2SiO3
硅酸溶胶
硅酸凝胶
硅胶
聚合
干燥脱水
浓度较大
(SiO2)
六、硅酸盐
1、含义
硅酸盐是由硅、氧和金属元素组成的化合物的总称 。
2、特点:
除Na2SiO3等少数硅酸盐外,一般为结构复杂固态化合物,不溶于水,化学性质很稳定。
六、硅酸盐
3、表示方法(p77)
化学式法: 一般用于组成较简单的硅酸盐。
如硅酸钠( Na2SiO3 )、硅酸钙( CaSiO3 )
氧化物法:针对结构复杂的硅酸盐
如石棉: CaO·3MgO·4SiO2
(普通玻璃的大致组成: Na2O·CaO·6SiO2 )
注:硅酸盐并不是由氧化物组成
3、硅酸钠( Na2SiO3 )
俗称泡花碱,其水溶液即水玻璃,碱性粘稠状。
用于制作木材防火、黏胶剂、硅胶、肥皂填料。
六、硅酸盐
燃烧
不易燃烧
用水玻璃浸泡过的物质可防火
现象
结论
点燃被浸泡过水的木条
点燃被Na2SiO3溶液浸泡过的木条
实验4—2
七、硅酸盐工业
1、传统硅酸盐工业
以含硅物质为原料,经过高温加热制成硅酸盐产品的工业。
如制造水泥、玻璃、陶瓷等产品的工业。
2、新型无机非金属材料
金刚砂(SiC):
硅钢(硅的合金):
硅橡胶:
分子筛:
硬度大,用作磨料
具有导磁性
耐高温、耐低温、良好的弹性、绝缘性
催化剂、吸附性
七、硅酸盐工业
⑴ 玻璃工业
原料 ——
普通玻璃的成分 ——
性质 ——
(2)陶瓷工业
原料 ——
主要成分 ——
没有固定的熔点,只是在一定范围内逐渐软化
纯碱、石灰石、石英
Na2SiO3、CaSiO3、SiO2
黏土
(硅酸盐岩石长期在水和大气中二氧化碳的侵蚀下,风化为黏土,并且形成土壤胶体p77)
铝硅酸盐
七、硅酸盐工业
(3) 水泥工业
原料 —
成分 —
特性——
石灰石、黏土、辅助原料(石膏)
硅酸三钙 3CaO·SiO2
硅酸二钙 2CaO·SiO2
铝酸三钙 3CaO·Al2O3
水硬性(水泥和水掺和搅拌、静止后变硬的特性。)
水泥的水硬性是化学性质,发生的变化属于化学变化。
2.可以用来制取半导体材料(如大规模集成电路)的是 ( )
A.二氧化硅 B.粗硅
C.高纯硅 D.硅酸盐
下列物质中主要成分不是二氧化硅的是( )
A.硅胶 B.水晶
C.玛瑙 D.硅石
A
C
练习
4.下列物质中,能够与NaOH溶液反应的是 ( ) A.碳酸钠 B.硅酸钠
C.二氧化硅 D.氢氧化铝
3.构成地壳基本骨架的非金属元素是 ( )
A.Al B.O
C. Si D.C
C
CD
练习
5.NaOH、KOH等碱性溶液可以贮存在下列哪种试剂瓶中 ( )
A.具有玻璃塞的细口瓶
B.具有玻璃塞的广口瓶
C.带滴管的滴瓶
D.具有橡胶塞的细口瓶
D
练习
6.二氧化硅的化学性质很不活泼,几乎所有的酸都不与其反应,但有一种酸能够和二氧化硅发生反应,这种酸是 ( )
A.浓盐酸 B.硫酸
C.硝酸 D.氢氟酸
D
练习
7.二氧化硅属于酸性氧化物,理由是( )
A.Si是非金属元素
B.SiO2对应的水化物是可溶性弱酸
C.SiO2与强碱反应生成盐和水
D.SiO2不能与酸反应
C
练习
8.下列几种物质其主要成分不是二氧化硅的是( )
①钻石 ②玛瑙 ③金刚砂 ④石英晶体
⑤硅藻土 ⑥水晶 ⑦大理石 ⑧光导纤维
①③⑦
练习
9.下列不属于传统硅酸盐产品的是( )
A.玻璃 B.水泥
C.光导纤维 D.陶瓷
C
练习
