鲁教版九年级化学第三单元溶液复习总结课件 (共20张PPT)
文档属性
| 名称 | 鲁教版九年级化学第三单元溶液复习总结课件 (共20张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 467.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-04 00:00:00 | ||
图片预览








文档简介
(共21张PPT)
这次的顶岗实习,过作业完成情况可以一定程度上了解学生的品行,找出是否存在抄袭的现象,一经发现应采取相依措施来杜绝抄袭的再次发生,在此分享体会。下面是美文阅读网小编为大家收集整理的顶岗实习体会,欢迎大家阅读。 顶岗实习体会篇1 12月28日,我怀着激动的心情踏上了期待已久的顶岗实习之路,当我坐上离开学校的的班车那一刻起,我就知道我将经历一段特殊的不平凡的并且充满收获的人生旅程,那旅程必定在我的生命中写下浓墨重彩的一笔,必定会在我的生命中留下绚烂多彩的回忆,并定会给我带来生命中无与伦比的财富。那时候对自己的未来充满希望,希望在那里能大展拳脚,实现自己的抱负。那时候想的是多么多么的好啊,直到此刻我才觉得我当时是那么的幼稚,不可能你刚出来什么都没有就让你做好的岗位。 是的,顶岗实习的生活是充满艰辛的挑战的。当我们来到实习点面对一间间产房和一条条流水线时,很多人后悔为什么当初选择了到海信科龙顶岗实习,但是我想说,这是我所预料到的,这也是我想要的,因为我知道人只有在艰苦的环境中才能磨练出坚强的意志,我也知道吃得苦中苦,方为人上认得道理,我自然还不是人上人,但是我相信在这个世界上每一个人
第三单元溶 液
复习课
复习目标
1、理解溶液的概念、特征及组成。
2、理解饱和溶液、不饱和溶液的概念,知道饱和溶液与不饱和溶液相互转化的条件。
3、理解溶解度的概念,认识溶解度曲线并会正确使用。
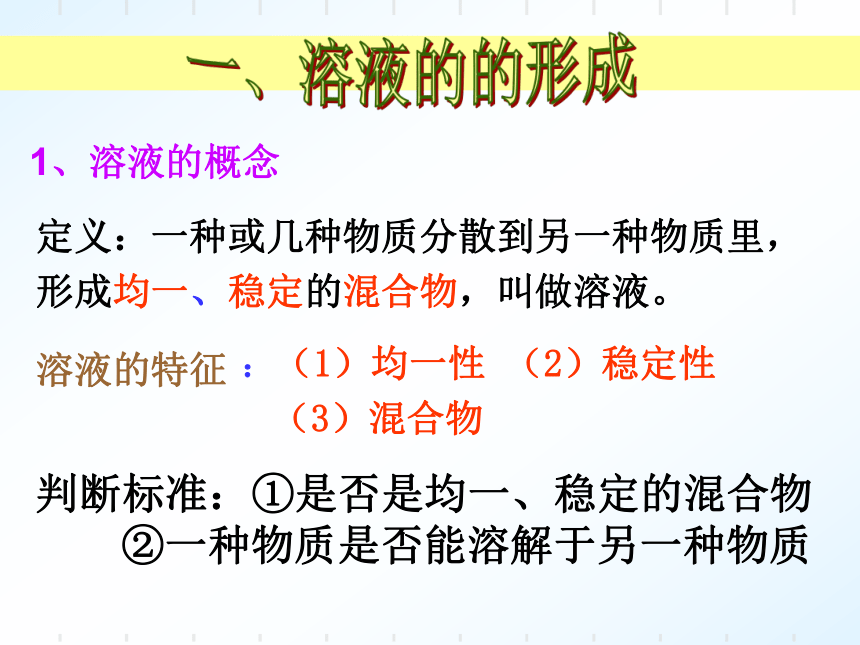
定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液。
溶液的特征
:(1)均一性 (2)稳定性
(3)混合物
1、溶液的概念
判断标准:①是否是均一、稳定的混合物
②一种物质是否能溶解于另一种物质
练习一:判断正误
1、溶液是无色的液体。
2、冰水混合物是溶液。
3、把食盐溶液倒掉一半后,变稀了。
4、在温度不变,水不蒸发的条件下,
蔗糖溶液中的蔗糖会从水中分离出来。
(×)
(×)
(×)
(×)
溶质质量 + 溶剂质量 = 溶液质量
但溶质体积+ 溶剂体积≠ 溶液体积
溶质——被溶解的物质。
溶剂——能溶解其它物质的物质。
2、溶液的组成
(1)若是固体或气体与液体互溶解,习惯
将固体或气体看作溶质,液体看作溶剂。
如果其中有一种是水,无论水量多少,
把水均看作溶剂。
量少的为溶质
(2)如果两种液体互相混合时
量多的为溶剂
3.溶液中溶质、溶剂的判断
1、若加入的溶质没有完全溶解,那么溶质只是
实际溶解的部分。
注:溶液中的溶质可能有多种,但溶剂只有一种。
如:把80g的蔗糖加入100g水中,只是溶解了30g蔗糖,则蔗糖溶液中,溶质只是 3 蔗糖。
2、当两种物质完全反应后,新生成的物质是溶质,析出的沉淀或逸散的气体不是溶质。
如:将大理石加到稀盐酸中恰好完全反应,此时溶液中溶质是 。
但是如果盐酸过量,则溶质为 和 。
注意:
0g
氯化钙
HCl
氯化钙
4、溶解时的吸热或放热现象
物质溶解过程中常常伴随着吸热或放热现象。
NH4NO3、NH4Cl等
NaOH、浓硫酸、生石灰等
如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是 ( )
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
请简述你选择此项的理由:
C
1.概念
(1)饱和溶液和不饱和溶液:在 下,在 里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)浓溶液和稀溶液:粗略地表示溶液里溶质含量的多少
一定温度
一定量溶剂
2.判断方法
(1)当溶液中有固态溶质时,若固体_________,那么该溶液是饱和的,若固体________,那么该溶液是不饱和的;
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质__________,则原溶液是饱和的,若溶质__________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再溶解
继续溶解
不再溶解
继续溶解
知识回顾
3、饱和溶液和不饱和溶液的相互转化关系
?
一般规律:不饱和溶液 饱和溶液
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
记准
降温、蒸发溶剂、加溶质
升温、加溶剂
升温、蒸发溶剂、加溶质
降温、加溶剂
知识回顾
1.物质的溶解度
在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
【例1】下列关于溶解度的叙述中,正确的是( )
① 将36gNaCl溶于100g水中制成饱和溶液,NaCl的溶解度为36g。
②20℃时,100克NaCl饱和溶液中含有26.5克NaCl,因此,NaCl在20℃时的溶解度为26.5克。
③在20℃时,100克水最多能溶解31.6克KNO3,而200克水最多能溶解63.2克 KNO3,因此,KNO3的溶解度随溶剂质量增大而增大。
④在20℃时,100克水中溶解了NaCl 20克,因此NaCl在20℃时的溶解度为20 g。
⑤在20℃时,NaCl的溶解度为36克。
⑥在20℃时,100克水中溶解36克NaCl达到饱和状态,因此,NaCl在20℃的溶解度为解度为36克。
A.①②④ B.②⑥ C.③④⑤⑥ D.⑤⑥
D
2.影响固体溶解度的因素:
温度
4、溶解度曲线
(1)溶解度曲线的意义 :
同一种物质在不同温度时的溶解度;不同物质在同一温度时的溶解度,交点温度下两种物质的溶解度相等;可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;能进行有关的计算。
3、影响气体物质溶解度的因素:
温度、压强
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_________________________
(2)当温度为t1?C,三种物质溶解度由小到大依次为_______,当温度为t3?C时,溶解度最大的是____.
(3)C可能表示哪种物质:
____________________
练习
A和C两种物质在t2?C时的溶解度相同
B>A>C
A
Ca(OH)2或CO2等气体
2.X、Y两种固体物质的溶解度曲线如右图所示。回答下列问题:
(1)由X、Y两种物质的溶解
度曲线可判断,溶解度受温
度影响较大的是 。
(2)40℃时,Y的溶解度
为 g;60℃时,把45g
的X加入50g水中,充分溶解,
得到该温度下X的水溶液是 (填“饱和”或“不饱和”)溶液。
(3)从Y的饱和溶液中提取Y,应采用的方法是
(填“冷却结晶”或“蒸发溶剂”)
X
40
饱和
蒸发溶剂
知识回顾
5、分离混合物
过滤和结晶是常用的混合物分离的方法
从溶液中结晶析出晶体的方法主要有:
①蒸发溶剂法——适用于溶解度受温度影响较小的固体溶质。如蒸发海水获得食盐晶体。
②冷却热饱和溶液法——— 适用于溶解度受温度影响较大的固体溶质。如冷却热的硝酸钾饱和溶液获得硝酸钾晶体。
溶质的质量分数
定义:溶质的质量与溶液的质量之比。
100%
溶质的质量分数用百分数表示。
100%
×
×
溶液的稀释
溶液稀释的方法是补充溶剂:稀释前后溶质质量不变。
1、用固体食盐和水配制一定质量分数的食盐溶液,一般步骤是: 。在以上配制中需要的主要仪器是 。
2、溶液稀释前后, 不变。
3、用98%的浓硫酸配制成20%的稀硫酸,一般步骤是:计算、称量、溶解、装瓶保存。在第三步中,要注意将浓硫酸倒入水中且不断搅拌。该操作和配制食盐水相比,不需要的仪器是 _
计算、称量、溶解、装瓶保存
天平、烧杯、玻璃棒、量筒、药匙、胶头滴管
溶质的质量
天平、药匙
五、配制一定溶质质量分数的溶液
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
这次的顶岗实习,过作业完成情况可以一定程度上了解学生的品行,找出是否存在抄袭的现象,一经发现应采取相依措施来杜绝抄袭的再次发生,在此分享体会。下面是美文阅读网小编为大家收集整理的顶岗实习体会,欢迎大家阅读。 顶岗实习体会篇1 12月28日,我怀着激动的心情踏上了期待已久的顶岗实习之路,当我坐上离开学校的的班车那一刻起,我就知道我将经历一段特殊的不平凡的并且充满收获的人生旅程,那旅程必定在我的生命中写下浓墨重彩的一笔,必定会在我的生命中留下绚烂多彩的回忆,并定会给我带来生命中无与伦比的财富。那时候对自己的未来充满希望,希望在那里能大展拳脚,实现自己的抱负。那时候想的是多么多么的好啊,直到此刻我才觉得我当时是那么的幼稚,不可能你刚出来什么都没有就让你做好的岗位。 是的,顶岗实习的生活是充满艰辛的挑战的。当我们来到实习点面对一间间产房和一条条流水线时,很多人后悔为什么当初选择了到海信科龙顶岗实习,但是我想说,这是我所预料到的,这也是我想要的,因为我知道人只有在艰苦的环境中才能磨练出坚强的意志,我也知道吃得苦中苦,方为人上认得道理,我自然还不是人上人,但是我相信在这个世界上每一个人
第三单元溶 液
复习课
复习目标
1、理解溶液的概念、特征及组成。
2、理解饱和溶液、不饱和溶液的概念,知道饱和溶液与不饱和溶液相互转化的条件。
3、理解溶解度的概念,认识溶解度曲线并会正确使用。
定义:一种或几种物质分散到另一种物质里,形成均一、稳定的混合物,叫做溶液。
溶液的特征
:(1)均一性 (2)稳定性
(3)混合物
1、溶液的概念
判断标准:①是否是均一、稳定的混合物
②一种物质是否能溶解于另一种物质
练习一:判断正误
1、溶液是无色的液体。
2、冰水混合物是溶液。
3、把食盐溶液倒掉一半后,变稀了。
4、在温度不变,水不蒸发的条件下,
蔗糖溶液中的蔗糖会从水中分离出来。
(×)
(×)
(×)
(×)
溶质质量 + 溶剂质量 = 溶液质量
但溶质体积+ 溶剂体积≠ 溶液体积
溶质——被溶解的物质。
溶剂——能溶解其它物质的物质。
2、溶液的组成
(1)若是固体或气体与液体互溶解,习惯
将固体或气体看作溶质,液体看作溶剂。
如果其中有一种是水,无论水量多少,
把水均看作溶剂。
量少的为溶质
(2)如果两种液体互相混合时
量多的为溶剂
3.溶液中溶质、溶剂的判断
1、若加入的溶质没有完全溶解,那么溶质只是
实际溶解的部分。
注:溶液中的溶质可能有多种,但溶剂只有一种。
如:把80g的蔗糖加入100g水中,只是溶解了30g蔗糖,则蔗糖溶液中,溶质只是 3 蔗糖。
2、当两种物质完全反应后,新生成的物质是溶质,析出的沉淀或逸散的气体不是溶质。
如:将大理石加到稀盐酸中恰好完全反应,此时溶液中溶质是 。
但是如果盐酸过量,则溶质为 和 。
注意:
0g
氯化钙
HCl
氯化钙
4、溶解时的吸热或放热现象
物质溶解过程中常常伴随着吸热或放热现象。
NH4NO3、NH4Cl等
NaOH、浓硫酸、生石灰等
如右图向试管里的水中加入某种物质后,原来U型管内两臂在同一水平上的红墨水,右边液面降低了些,左边的液面上升了些,则加入的物质是 ( )
A、活性炭 B、生石灰
C、硝酸铵 D、氢氧化钠
请简述你选择此项的理由:
C
1.概念
(1)饱和溶液和不饱和溶液:在 下,在 里,不能再溶解某种溶质的溶液,叫做这种溶质的饱和溶液,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)浓溶液和稀溶液:粗略地表示溶液里溶质含量的多少
一定温度
一定量溶剂
2.判断方法
(1)当溶液中有固态溶质时,若固体_________,那么该溶液是饱和的,若固体________,那么该溶液是不饱和的;
(2)当溶液中没有固态溶质时,向溶液中加入少量相应的溶质,若溶质__________,则原溶液是饱和的,若溶质__________,则原溶液是不饱和的。
(3)当溶液中有晶体析出时,析出晶体后的溶液一定是饱和溶液。
不再溶解
继续溶解
不再溶解
继续溶解
知识回顾
3、饱和溶液和不饱和溶液的相互转化关系
?
一般规律:不饱和溶液 饱和溶液
特殊溶质Ca(OH)2不饱和溶液 饱和溶液
记准
降温、蒸发溶剂、加溶质
升温、加溶剂
升温、蒸发溶剂、加溶质
降温、加溶剂
知识回顾
1.物质的溶解度
在一定温度下,某固态物质在100克溶剂里达到饱和状态时所溶解的质量。
【例1】下列关于溶解度的叙述中,正确的是( )
① 将36gNaCl溶于100g水中制成饱和溶液,NaCl的溶解度为36g。
②20℃时,100克NaCl饱和溶液中含有26.5克NaCl,因此,NaCl在20℃时的溶解度为26.5克。
③在20℃时,100克水最多能溶解31.6克KNO3,而200克水最多能溶解63.2克 KNO3,因此,KNO3的溶解度随溶剂质量增大而增大。
④在20℃时,100克水中溶解了NaCl 20克,因此NaCl在20℃时的溶解度为20 g。
⑤在20℃时,NaCl的溶解度为36克。
⑥在20℃时,100克水中溶解36克NaCl达到饱和状态,因此,NaCl在20℃的溶解度为解度为36克。
A.①②④ B.②⑥ C.③④⑤⑥ D.⑤⑥
D
2.影响固体溶解度的因素:
温度
4、溶解度曲线
(1)溶解度曲线的意义 :
同一种物质在不同温度时的溶解度;不同物质在同一温度时的溶解度,交点温度下两种物质的溶解度相等;可以确定从饱和溶液中析出晶体或进行混合物分离提纯的方法;能进行有关的计算。
3、影响气体物质溶解度的因素:
温度、压强
1、如图是A、B、C三种物质在水中的溶解度曲线,请回答:
(1)M点的含义是_________________________
(2)当温度为t1?C,三种物质溶解度由小到大依次为_______,当温度为t3?C时,溶解度最大的是____.
(3)C可能表示哪种物质:
____________________
练习
A和C两种物质在t2?C时的溶解度相同
B>A>C
A
Ca(OH)2或CO2等气体
2.X、Y两种固体物质的溶解度曲线如右图所示。回答下列问题:
(1)由X、Y两种物质的溶解
度曲线可判断,溶解度受温
度影响较大的是 。
(2)40℃时,Y的溶解度
为 g;60℃时,把45g
的X加入50g水中,充分溶解,
得到该温度下X的水溶液是 (填“饱和”或“不饱和”)溶液。
(3)从Y的饱和溶液中提取Y,应采用的方法是
(填“冷却结晶”或“蒸发溶剂”)
X
40
饱和
蒸发溶剂
知识回顾
5、分离混合物
过滤和结晶是常用的混合物分离的方法
从溶液中结晶析出晶体的方法主要有:
①蒸发溶剂法——适用于溶解度受温度影响较小的固体溶质。如蒸发海水获得食盐晶体。
②冷却热饱和溶液法——— 适用于溶解度受温度影响较大的固体溶质。如冷却热的硝酸钾饱和溶液获得硝酸钾晶体。
溶质的质量分数
定义:溶质的质量与溶液的质量之比。
100%
溶质的质量分数用百分数表示。
100%
×
×
溶液的稀释
溶液稀释的方法是补充溶剂:稀释前后溶质质量不变。
1、用固体食盐和水配制一定质量分数的食盐溶液,一般步骤是: 。在以上配制中需要的主要仪器是 。
2、溶液稀释前后, 不变。
3、用98%的浓硫酸配制成20%的稀硫酸,一般步骤是:计算、称量、溶解、装瓶保存。在第三步中,要注意将浓硫酸倒入水中且不断搅拌。该操作和配制食盐水相比,不需要的仪器是 _
计算、称量、溶解、装瓶保存
天平、烧杯、玻璃棒、量筒、药匙、胶头滴管
溶质的质量
天平、药匙
五、配制一定溶质质量分数的溶液
练习:下面是一位同学配制一定溶质质量分数的氯化钠溶液时的流程图,请找出其中的错误,并说明理由。
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
