人教版初中化学九年级下册第8单元 课題2 金属的化学性质
文档属性
| 名称 | 人教版初中化学九年级下册第8单元 课題2 金属的化学性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 124.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-04 00:00:00 | ||
图片预览




文档简介
《金属的化学性质》教学设计(第1课时)
一、教学目标
(一)知识与技能
1.知道铁、铝、铜等常见金属与氧气的反应。
2.初步认识常见金属与盐酸、硫酸的置换反应。能用置换反
应解释一些与日常生活有关的化学问题。
(二)过程与方法
1. 通过金属和酸反应,学习利用控制变量法进行科学探究,
2.根据金属和酸反应的剧烈程度判断金属活动性顺序
(三)情感态度与价值观
在实验操作中,获得科学方法的体验,养成实事求是的科学精神和严谨的科学态度,激发学习化学兴趣
二、教学重点
金属和酸的置换反应
三、教学难点
判断金属活动性强弱
四、教学准备
教学设备(投影仪,计算机)、试管、试管架、稀盐酸、稀硫酸、镁片、锌片、铁片、铜片
五、教学过程环节 教师活动 学生活动 设计意图
? ?新课导入2分钟 出示一块金条,你能用简单的方法辨别真假吗? 学生回答用测密度(两者的密度不同)、硬度、测熔点(熔点不同)。等等 ? ? 从生活中的现象入手引入新课,激发学生学习兴趣。
这些方法都是一些物理方法,在现场不容易实现,我们可以用一些化学方法来鉴别黄金的真伪。学完本课,你就会用化学方法鉴别黄金的真伪。 ? ? ?
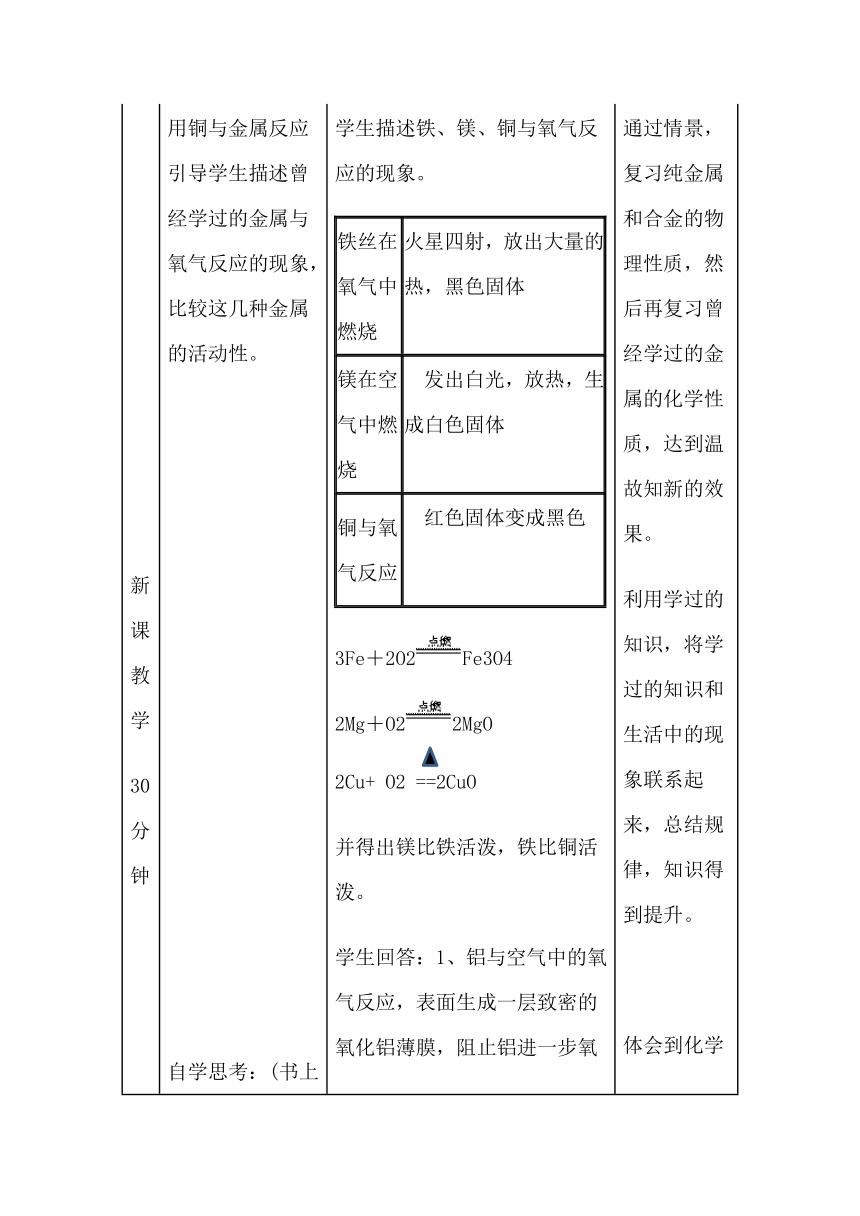
? ? ? ? ? ? ?新课教学30分钟 用铜与金属反应引导学生描述曾经学过的金属与氧气反应的现象,比较这几种金属的活动性。 ? ? ? ? ? 自学思考:(书上9页) 1、铝在常温下就能与氧气反应,为什么我们日常用的铝锅等铝制品却经久耐用?2、写出铝被氧化的化学方程式。 3、当铝锅等铝制品用久了有污物时,能不能用钢刷去擦除表面的污物? 学生描述铁、镁、铜与氧气反应的现象。铁丝在氧气中燃烧火星四射,放出大量的热,黑色固体 镁在空气中燃烧 ?发出白光,放热,生成白色固体 铜与氧气反应?红色固体变成黑色 3Fe+2O2Fe3O42Mg+O22MgO2Cu+ O2 ==2CuO 并得出镁比铁活泼,铁比铜活泼。 学生回答:1、铝与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。 2、 4Al+3O2= 2 Al2 O3(致密的氧化膜) 3、生回答氧化膜的保护作用,不能被擦去。 通过情景,复习纯金属和合金的物理性质,然后再复习曾经学过的金属的化学性质,达到温故知新的效果。 利用学过的知识,将学过的知识和生活中的现象联系起来,总结规律,知识得到提升。 体会到化学来源于生活,并服务于生活。??
提出问题,所有的金属都可以和氧气发生反应吗?用生活中的例子来说明。 学生回答:黄金饰品不变色,说明金不和氧气反应。(古代用金银做为货币,说明金银一般不和氧气发生反应。)
1、将金条放在酒精灯火焰上加热,观察现象。 ?2、请说说你对“真金不怕火炼”的理解。 ?? 学生回答:即使在很高的温度下,金也不和氧气发生反应。金的化学性质稳定 注重理论与实践相结合,培养学生分析问题的能力。
组织学生讨论金属与氧气反应的规律,得出镁、铁、铜、金的活动性 得出结论:大多数的金属能够和氧气发生反应,但是反应的难易和剧烈程度不同。金在高温下也不和氧气发生反应 ___Mg > Fe___ > _ Cu __ > __Au 培养学生总结归纳能力。
我们学过锌和稀硫酸反应,那么其他的金属可以和稀硫酸反应吗? 师设计实验实验注意事项:1、每两人做一种金属与酸反应的实验。镁与酸反应最后做。(便于比较现象,感受放热)
2、镁、铁、铜、锌各取两片,酸取2至3毫升。
3、金属与酸反应时放在试管架上,8人共同观察。
4、实验现象可以看、摸试管外壁、闻等多角度描述。 思考、讨论能与盐酸,稀硫酸反应的金属是( )不能与盐酸,稀硫酸反应的金属是( )
2、实验室制氢气最好选哪种金属? 3、镁、锌、铁、铜四种金属的活动性是( )> ( )>( ) >( ) .4、从反应物和生成物的物质类别上分析反应的化学方程式有哪些共同点? 引出置换反应定义 你还能列举两个学过且属于置换反应的例子吗?写出它们的化学方程式. 学生猜想并设计实验,探究镁、锌、铁、铜和稀盐酸 、稀硫酸反应,观察现象。 实验结束后,写出反应的化学方程式。 ?Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑ Zn+2HCl =ZnCl2 +H2↑ Zn +H2SO4 =ZnSO4 +H2↑ Fe +2HCl =FeCl2 + H2↑ Fe +H2SO4 =FeSO4 +H2↑ ? 学生根据现象回答:镁、锌、铁都可以和盐酸、稀硫酸反应,但是反应的剧烈程度不同,铜不和盐酸、稀硫酸反应,所以这四种金属的镁最活泼,其次是锌、铁,铜。根据金属和酸反应的剧烈程度来判断金属的活动性顺序。 Fe +2HC l = FeCl2 + H2↑ Fe +H2SO4 =FeSO4 +H2↑ 单质 化合物 化合物 单质 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。 C+2CuO高温2Cu+CO2↑ Fe+CuSO4=Cu+FeSO4 培养学生猜想能力、实验操作能力、观察能力书写化学用语的能力。 培养学生分析问题和总结归纳能力。 培养学生利用所学知识解决问题的能力
课堂小结:让学生谈收获。 ? 1.大部分金属可以和氧气反应,金在高温下也不和氧气反应。根据与氧气反应的难易和剧烈程度比较金属的活动性强弱
2.活泼金属可以和盐酸或稀硫酸反应。根据金属能否和酸反应及反应剧烈程度比较金属的活动性强弱。
3、单质与化合物反应生成新单质和化合物属于置换反应。这也是基本反应类型。
随堂练习 1.铝在空气中能够稳定存在的原因是( )。
A.铝的活泼性差
B.铝的还原性差
C.铝与氧气不反应
D.铝表面有氧化膜?
2.下列物质能不能通过酸与金属单质直接反应得到的是( )
A.ZnCl2 B .FeCl3 C.MgCl2 D.AlCl3
3.下列是探究金属化学性质的部分实验,对于操作或实验现象或实验结论的叙述中,不正确的是( )。
A .镁条燃烧前应打磨,以除去表面的保护膜
B .铁在空气中燃烧,火星四射,生成黑色的固体
C. 铜丝在空气中加热,表面由红色变为黑色
D. 实验室采用锌制氢气,一个原因是反应速率适中
4.试判断下列化学反应的基本类型: 化学反应基本类型Zn+H2SO4?=?ZnSO4+H2↑ C+2CuO高温2Cu+CO2↑H2+CuO??加热?????Cu+H2O 3CO+Fe2O3??高温???2?Fe?+?3CO2 5、黄金与黄铜(铜锌合金)的外观很相似,通过这 堂课我们可以用哪些方法鉴别黄金与黄铜? 学生思考并回答:(1)取样品,放在酒精灯火焰上灼烧,变成黑色的是假黄金,不变色的是真金。(2)把样品置于稀盐酸或稀硫酸中,有气泡产生,则该是假黄金,无现象是真金。 利用所学知识解决生活中的问题,提高学生解释一些与日常生活有关的化学问题的能力。?
课后反思 ?
一、教学目标
(一)知识与技能
1.知道铁、铝、铜等常见金属与氧气的反应。
2.初步认识常见金属与盐酸、硫酸的置换反应。能用置换反
应解释一些与日常生活有关的化学问题。
(二)过程与方法
1. 通过金属和酸反应,学习利用控制变量法进行科学探究,
2.根据金属和酸反应的剧烈程度判断金属活动性顺序
(三)情感态度与价值观
在实验操作中,获得科学方法的体验,养成实事求是的科学精神和严谨的科学态度,激发学习化学兴趣
二、教学重点
金属和酸的置换反应
三、教学难点
判断金属活动性强弱
四、教学准备
教学设备(投影仪,计算机)、试管、试管架、稀盐酸、稀硫酸、镁片、锌片、铁片、铜片
五、教学过程环节 教师活动 学生活动 设计意图
? ?新课导入2分钟 出示一块金条,你能用简单的方法辨别真假吗? 学生回答用测密度(两者的密度不同)、硬度、测熔点(熔点不同)。等等 ? ? 从生活中的现象入手引入新课,激发学生学习兴趣。
这些方法都是一些物理方法,在现场不容易实现,我们可以用一些化学方法来鉴别黄金的真伪。学完本课,你就会用化学方法鉴别黄金的真伪。 ? ? ?
? ? ? ? ? ? ?新课教学30分钟 用铜与金属反应引导学生描述曾经学过的金属与氧气反应的现象,比较这几种金属的活动性。 ? ? ? ? ? 自学思考:(书上9页) 1、铝在常温下就能与氧气反应,为什么我们日常用的铝锅等铝制品却经久耐用?2、写出铝被氧化的化学方程式。 3、当铝锅等铝制品用久了有污物时,能不能用钢刷去擦除表面的污物? 学生描述铁、镁、铜与氧气反应的现象。铁丝在氧气中燃烧火星四射,放出大量的热,黑色固体 镁在空气中燃烧 ?发出白光,放热,生成白色固体 铜与氧气反应?红色固体变成黑色 3Fe+2O2Fe3O42Mg+O22MgO2Cu+ O2 ==2CuO 并得出镁比铁活泼,铁比铜活泼。 学生回答:1、铝与空气中的氧气反应,表面生成一层致密的氧化铝薄膜,阻止铝进一步氧化。 2、 4Al+3O2= 2 Al2 O3(致密的氧化膜) 3、生回答氧化膜的保护作用,不能被擦去。 通过情景,复习纯金属和合金的物理性质,然后再复习曾经学过的金属的化学性质,达到温故知新的效果。 利用学过的知识,将学过的知识和生活中的现象联系起来,总结规律,知识得到提升。 体会到化学来源于生活,并服务于生活。??
提出问题,所有的金属都可以和氧气发生反应吗?用生活中的例子来说明。 学生回答:黄金饰品不变色,说明金不和氧气反应。(古代用金银做为货币,说明金银一般不和氧气发生反应。)
1、将金条放在酒精灯火焰上加热,观察现象。 ?2、请说说你对“真金不怕火炼”的理解。 ?? 学生回答:即使在很高的温度下,金也不和氧气发生反应。金的化学性质稳定 注重理论与实践相结合,培养学生分析问题的能力。
组织学生讨论金属与氧气反应的规律,得出镁、铁、铜、金的活动性 得出结论:大多数的金属能够和氧气发生反应,但是反应的难易和剧烈程度不同。金在高温下也不和氧气发生反应 ___Mg > Fe___ > _ Cu __ > __Au 培养学生总结归纳能力。
我们学过锌和稀硫酸反应,那么其他的金属可以和稀硫酸反应吗? 师设计实验实验注意事项:1、每两人做一种金属与酸反应的实验。镁与酸反应最后做。(便于比较现象,感受放热)
2、镁、铁、铜、锌各取两片,酸取2至3毫升。
3、金属与酸反应时放在试管架上,8人共同观察。
4、实验现象可以看、摸试管外壁、闻等多角度描述。 思考、讨论能与盐酸,稀硫酸反应的金属是( )不能与盐酸,稀硫酸反应的金属是( )
2、实验室制氢气最好选哪种金属? 3、镁、锌、铁、铜四种金属的活动性是( )> ( )>( ) >( ) .4、从反应物和生成物的物质类别上分析反应的化学方程式有哪些共同点? 引出置换反应定义 你还能列举两个学过且属于置换反应的例子吗?写出它们的化学方程式. 学生猜想并设计实验,探究镁、锌、铁、铜和稀盐酸 、稀硫酸反应,观察现象。 实验结束后,写出反应的化学方程式。 ?Mg+2HCl=MgCl2+H2↑
Mg+H2SO4=MgSO4+H2↑ Zn+2HCl =ZnCl2 +H2↑ Zn +H2SO4 =ZnSO4 +H2↑ Fe +2HCl =FeCl2 + H2↑ Fe +H2SO4 =FeSO4 +H2↑ ? 学生根据现象回答:镁、锌、铁都可以和盐酸、稀硫酸反应,但是反应的剧烈程度不同,铜不和盐酸、稀硫酸反应,所以这四种金属的镁最活泼,其次是锌、铁,铜。根据金属和酸反应的剧烈程度来判断金属的活动性顺序。 Fe +2HC l = FeCl2 + H2↑ Fe +H2SO4 =FeSO4 +H2↑ 单质 化合物 化合物 单质 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应。 C+2CuO高温2Cu+CO2↑ Fe+CuSO4=Cu+FeSO4 培养学生猜想能力、实验操作能力、观察能力书写化学用语的能力。 培养学生分析问题和总结归纳能力。 培养学生利用所学知识解决问题的能力
课堂小结:让学生谈收获。 ? 1.大部分金属可以和氧气反应,金在高温下也不和氧气反应。根据与氧气反应的难易和剧烈程度比较金属的活动性强弱
2.活泼金属可以和盐酸或稀硫酸反应。根据金属能否和酸反应及反应剧烈程度比较金属的活动性强弱。
3、单质与化合物反应生成新单质和化合物属于置换反应。这也是基本反应类型。
随堂练习 1.铝在空气中能够稳定存在的原因是( )。
A.铝的活泼性差
B.铝的还原性差
C.铝与氧气不反应
D.铝表面有氧化膜?
2.下列物质能不能通过酸与金属单质直接反应得到的是( )
A.ZnCl2 B .FeCl3 C.MgCl2 D.AlCl3
3.下列是探究金属化学性质的部分实验,对于操作或实验现象或实验结论的叙述中,不正确的是( )。
A .镁条燃烧前应打磨,以除去表面的保护膜
B .铁在空气中燃烧,火星四射,生成黑色的固体
C. 铜丝在空气中加热,表面由红色变为黑色
D. 实验室采用锌制氢气,一个原因是反应速率适中
4.试判断下列化学反应的基本类型: 化学反应基本类型Zn+H2SO4?=?ZnSO4+H2↑ C+2CuO高温2Cu+CO2↑H2+CuO??加热?????Cu+H2O 3CO+Fe2O3??高温???2?Fe?+?3CO2 5、黄金与黄铜(铜锌合金)的外观很相似,通过这 堂课我们可以用哪些方法鉴别黄金与黄铜? 学生思考并回答:(1)取样品,放在酒精灯火焰上灼烧,变成黑色的是假黄金,不变色的是真金。(2)把样品置于稀盐酸或稀硫酸中,有气泡产生,则该是假黄金,无现象是真金。 利用所学知识解决生活中的问题,提高学生解释一些与日常生活有关的化学问题的能力。?
课后反思 ?
同课章节目录
