人教版初中化学九年级下册第8单元 课題2 金属的化学性质
文档属性
| 名称 | 人教版初中化学九年级下册第8单元 课題2 金属的化学性质 |

|
|
| 格式 | zip | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-04 00:00:00 | ||
图片预览








文档简介
(共24张PPT)
课题2 金属的化学性质
金属与氧气反应
金属与金属化合物溶液反应
金属与酸反应
1.知道铝、铁、铜等常见金属与氧气的反应;
2.认识常见金属与盐酸、硫酸及盐溶液的置换反应,并能解释日常生活中的一些现象;
3.能说出常见金属的活动性顺序,了解金属活动性顺序的意义。
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,放热,生成白色固体。
2Mg + O2 2MgO
化学方程式:
【回顾思考2】铁丝在氧气中燃烧有什么现象?
铁在氧气中剧烈燃烧,火星四射,放热,生成黑色固体。
3Fe + 2O2 Fe3O4
一、金属与氧气的反应
问题1:请写出下列物质与氧气反应的方程式: Mg、Al、Fe、Cu、Au
镁条和铝片在常温下就能和空气中的氧气发生氧化反应。
4Al + 3O2 = 2Al2O3
2Mg + O2 = 2MgO
铁丝和铜片在高温时能与氧气反应
“真金不怕火炼”说明什么?
说明金的化学性质稳定(不能和氧气反应)
讨论1:从以下方程式你能得到哪些信息?
(1)4Al+3O2=2Al2O3
(2)2Mg+O2=2MgO
(3)3Fe+2 O2 Fe3 O4
综合上述信息可知:
1.大多数金属都能与_______反应,反应的难易与剧烈程度 ________(相同,不相同)
2.金属的活动性:说明 _______ 较活泼,________次之, ______很不活泼
Au
氧气
不相同
Al、Mg
Fe、Cu
(4)2Cu+O2 2CuO
(5)Au + O2 →不反应
(1)铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?
铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3; 形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性能。
(2)为何不宜用钢刷、沙等来擦洗铝制制品呢?
若用钢刷等擦洗铝制品,容易破坏铝制品表面致密的氧化铝薄膜,从而起不到保护作用。
思考:
活动与探究(一)探究镁、锌、铁、铜的活动性顺序
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可反映出金属的活泼程度,即金属活动性。
A组:在稀盐酸中分别放入镁、锌、铁、铜。
B组:在稀硫酸中分别放入镁、锌、铁、铜。
二、金属与盐酸、稀硫酸的反应
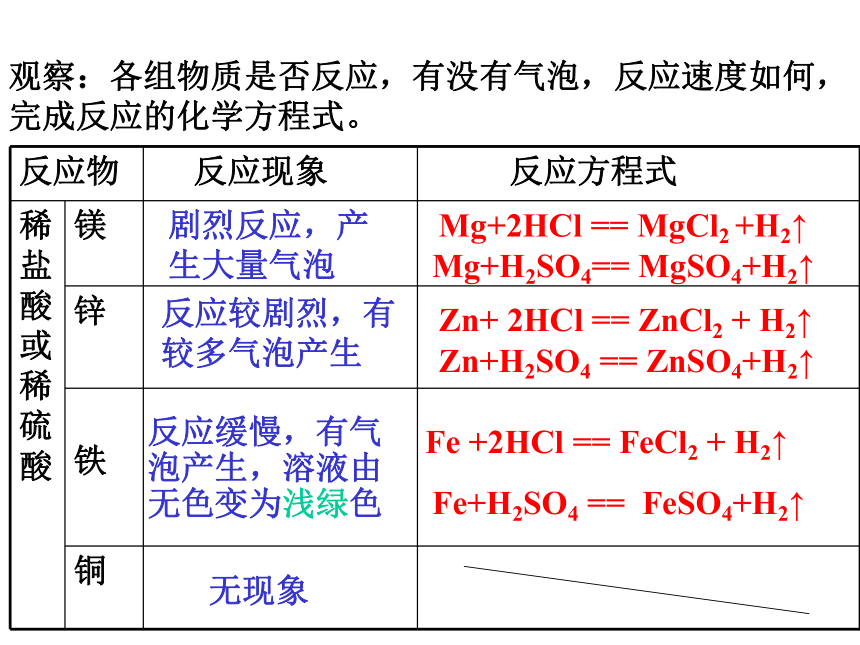
观察:各组物质是否反应,有没有气泡,反应速度如何,完成反应的化学方程式。
Mg+H2SO4== MgSO4+H2↑
Mg+2HCl == MgCl2 +H2↑
Zn+H2SO4 == ZnSO4+H2↑
Zn+ 2HCl == ZnCl2 + H2↑
Fe+H2SO4 == FeSO4+H2↑
Fe +2HCl == FeCl2 + H2↑
剧烈反应,产生大量气泡
反应较剧烈,有较多气泡产生
反应缓慢,有气泡产生,溶液由无色变为浅绿色
无现象
反应物 反应现象 反应方程式
稀盐酸或稀硫酸 镁
锌
铁
铜
盐酸
无所谓,我无所谓…
我得意的笑,又得意的笑…
为什么受伤的总是我!
讨论:(1) 哪些金属能与盐酸、稀硫酸发生反应?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?
铁钉和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜和稀盐酸
镁、锌、铁能反应,反应后生成了氢气,铜不能反应
(2) 反应剧烈程度如何?____最剧烈,其次是 _____,然后是____。
镁
锌
铁
根据反应时是否有氢气产生,将金属分为两类:
分为活泼金属和不活泼金属
判断金属活动性的方法之一:
由此推出 ,金属活动性顺序:______________
Mg ﹥ Zn ﹥ Fe ﹥ Cu
点拨:
可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱;
能与稀盐酸或稀硫酸反应的金属,其金属的活动性强,不反应的其金属活动性弱;反应越剧烈的金属的活动性越强;
回顾: 铁钉与硫酸铜溶液反应
反应现象:
Fe + CuSO4 = FeSO4 + Cu
铁钉表面有一层红色固体物质,
溶液由蓝色变为浅绿色。
化学方程式:
结论:
铁比铜活泼
三、金属与金属化合物溶液的反应
实验:
1、把一根用砂纸打磨过的铝丝浸入硫酸铜溶液
中,过一会儿取出,观察,有什么现象发生?
2、把一根洁净的铜丝浸入硝酸银溶液中,过一
会儿取出,观察,有什么现象发生?
3、把一根洁净的铜丝浸入硫酸铝溶液中,过一
会儿取出,观察,有什么现象发生?
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铝丝表面覆盖一层红色的物质,溶液由蓝色变成无色(变浅)
2Al + 3 CuSO4= Al2( SO4)3+ 3Cu
铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变成蓝色
Cu + 2AgNO3= Cu(NO3)2 +2Ag
无变化
说明___的活动性强于___
说明___的活动性强于___
说明___的活动性弱于___
Al
Cu
Cu
Ag
Al
Cu
金属与金属化合物溶液的反应
结论:金属活动性顺序__________________________
Al>Cu>Ag
实验 现 象 化学方程式 说 明
铝丝在硫酸铜溶液中
铜丝在硝酸银溶液中
铜丝在硫酸铝溶液中
单质
化合物
化合物
单质
由一种_____和一种______反应,生成另一种_____和另一种 _____ 的反应叫做置换反应.
Mg + 2HCl = MgCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + CuSO4 = FeSO4 + Cu
化合物
单质
单质
化合物
1、反应前后均为两种物质
置换反应:
判断方法:
2、反应前后均为一种单质和一种化合物
下列反应属于置换反应吗?
2. C + 2CuO 2Cu + CO2↑
3. H2 + CuO H2O + Cu
1. Zn + 2HCl = ZnCl2 + H2 ↑
金属活动性顺序:
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
试一试:想一想:
1.在金属活动性顺序里:金属的位置越 ______ ,它的活动性就越强。
2. 在金属活动性顺序里:位于 ____ 前面的金属能置换出盐酸、稀硫酸中的_____。
3. 在金属活动性顺序里:位于_____ 的金属能把位于____ 的金属从它们的化合物的 _____里置换出来。
靠前
氢
后面
溶液
氢
前面
(K、Ca、Na除外!)
金属活动性由强逐渐减弱
活泼金属 较活泼金属 不活泼金属
点拨:
1.在金属活动性顺序表中,两金属相隔越远,其置换能力就越强。例如:锌和铜放入硝酸银溶液中,先发生反应的是锌和硝酸银,当锌用完后,才是铜与硝酸银溶液反应;
2、K、Ca、Na不能把它后面的金属从它们的盐溶液中置换出来。因为钾钙钠的活动性太强,能与水发生反应生成碱和氢气。
学完本课题你应该知道
1、金属的化学性质
①大多数金属能与氧气反应(化合反应)
②大多数金属能与盐酸、稀硫酸反应(置换反应)
③部分金属能与金属化合物溶液反应(置换反应)
2、置换反应
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
Fe + 2HCl = FeCl2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
4、判断常见金属活泼性的方法
3、常见金属的活动性顺序如下:
金属活动性顺序可以作为金属能否在溶液中发生置换反应的一种判断依据。
①金属与酸反应的剧烈程度。氢前金属+盐酸(稀硫酸) (金属越活泼,反应越容易,越剧烈)
金属与酸不能反应(排在氢后面)
②金属能否与金属化合物的溶液反应。(位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来)
1、下列物质能否发生反应?写出能反应的化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液
不能反应
不能反应
Zn + CuSO4 = ZnSO4 + Cu
Al + 3AgNO3 = Al(NO3)3 + 3Ag
2、填写下列表格(“混合物”栏中括号内为杂质)。
Fe+2HCl = FeCl2+H2↑
加适量盐酸至无气泡产生,过滤,洗涤,干燥
Fe+CuCl2 = FeCl2+Cu
加适量无锈铁钉或铁粉,过滤
混合物 除去杂质的化学方程式 主要操作步骤
铜粉
(Fe)
FeCl2溶液(CuCl2)
课题2 金属的化学性质
金属与氧气反应
金属与金属化合物溶液反应
金属与酸反应
1.知道铝、铁、铜等常见金属与氧气的反应;
2.认识常见金属与盐酸、硫酸及盐溶液的置换反应,并能解释日常生活中的一些现象;
3.能说出常见金属的活动性顺序,了解金属活动性顺序的意义。
【回顾思考1】镁条在空气中点燃有什么现象?
镁条燃烧,发出耀眼的白光,放热,生成白色固体。
2Mg + O2 2MgO
化学方程式:
【回顾思考2】铁丝在氧气中燃烧有什么现象?
铁在氧气中剧烈燃烧,火星四射,放热,生成黑色固体。
3Fe + 2O2 Fe3O4
一、金属与氧气的反应
问题1:请写出下列物质与氧气反应的方程式: Mg、Al、Fe、Cu、Au
镁条和铝片在常温下就能和空气中的氧气发生氧化反应。
4Al + 3O2 = 2Al2O3
2Mg + O2 = 2MgO
铁丝和铜片在高温时能与氧气反应
“真金不怕火炼”说明什么?
说明金的化学性质稳定(不能和氧气反应)
讨论1:从以下方程式你能得到哪些信息?
(1)4Al+3O2=2Al2O3
(2)2Mg+O2=2MgO
(3)3Fe+2 O2 Fe3 O4
综合上述信息可知:
1.大多数金属都能与_______反应,反应的难易与剧烈程度 ________(相同,不相同)
2.金属的活动性:说明 _______ 较活泼,________次之, ______很不活泼
Au
氧气
不相同
Al、Mg
Fe、Cu
(4)2Cu+O2 2CuO
(5)Au + O2 →不反应
(1)铝的化学性质很活泼,为什么通常铝制品却很耐腐蚀?
铝在常温下发生缓慢氧化:4Al+3O2=2Al2O3; 形成一层致密的氧化物薄膜,从而阻止铝的进一步氧化,因而铝具有较好的抗腐蚀性能。
(2)为何不宜用钢刷、沙等来擦洗铝制制品呢?
若用钢刷等擦洗铝制品,容易破坏铝制品表面致密的氧化铝薄膜,从而起不到保护作用。
思考:
活动与探究(一)探究镁、锌、铁、铜的活动性顺序
很多金属不仅能与氧气反应,而且还能与盐酸或稀硫酸反应。金属与盐酸或稀硫酸能否反应以及反应的剧烈程度,可反映出金属的活泼程度,即金属活动性。
A组:在稀盐酸中分别放入镁、锌、铁、铜。
B组:在稀硫酸中分别放入镁、锌、铁、铜。
二、金属与盐酸、稀硫酸的反应
观察:各组物质是否反应,有没有气泡,反应速度如何,完成反应的化学方程式。
Mg+H2SO4== MgSO4+H2↑
Mg+2HCl == MgCl2 +H2↑
Zn+H2SO4 == ZnSO4+H2↑
Zn+ 2HCl == ZnCl2 + H2↑
Fe+H2SO4 == FeSO4+H2↑
Fe +2HCl == FeCl2 + H2↑
剧烈反应,产生大量气泡
反应较剧烈,有较多气泡产生
反应缓慢,有气泡产生,溶液由无色变为浅绿色
无现象
反应物 反应现象 反应方程式
稀盐酸或稀硫酸 镁
锌
铁
铜
盐酸
无所谓,我无所谓…
我得意的笑,又得意的笑…
为什么受伤的总是我!
讨论:(1) 哪些金属能与盐酸、稀硫酸发生反应?反应后生成了什么气体?哪些金属不能与盐酸、稀硫酸发生反应?
铁钉和稀盐酸
镁和稀盐酸
锌和稀盐酸
铜和稀盐酸
镁、锌、铁能反应,反应后生成了氢气,铜不能反应
(2) 反应剧烈程度如何?____最剧烈,其次是 _____,然后是____。
镁
锌
铁
根据反应时是否有氢气产生,将金属分为两类:
分为活泼金属和不活泼金属
判断金属活动性的方法之一:
由此推出 ,金属活动性顺序:______________
Mg ﹥ Zn ﹥ Fe ﹥ Cu
点拨:
可根据金属是否与稀盐酸或稀硫酸反应或反应的剧烈程度判断金属的活动性强弱;
能与稀盐酸或稀硫酸反应的金属,其金属的活动性强,不反应的其金属活动性弱;反应越剧烈的金属的活动性越强;
回顾: 铁钉与硫酸铜溶液反应
反应现象:
Fe + CuSO4 = FeSO4 + Cu
铁钉表面有一层红色固体物质,
溶液由蓝色变为浅绿色。
化学方程式:
结论:
铁比铜活泼
三、金属与金属化合物溶液的反应
实验:
1、把一根用砂纸打磨过的铝丝浸入硫酸铜溶液
中,过一会儿取出,观察,有什么现象发生?
2、把一根洁净的铜丝浸入硝酸银溶液中,过一
会儿取出,观察,有什么现象发生?
3、把一根洁净的铜丝浸入硫酸铝溶液中,过一
会儿取出,观察,有什么现象发生?
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铝丝表面覆盖一层红色的物质,溶液由蓝色变成无色(变浅)
2Al + 3 CuSO4= Al2( SO4)3+ 3Cu
铜丝表面覆盖一层银白色的物质,溶液由无色逐渐变成蓝色
Cu + 2AgNO3= Cu(NO3)2 +2Ag
无变化
说明___的活动性强于___
说明___的活动性强于___
说明___的活动性弱于___
Al
Cu
Cu
Ag
Al
Cu
金属与金属化合物溶液的反应
结论:金属活动性顺序__________________________
Al>Cu>Ag
实验 现 象 化学方程式 说 明
铝丝在硫酸铜溶液中
铜丝在硝酸银溶液中
铜丝在硫酸铝溶液中
单质
化合物
化合物
单质
由一种_____和一种______反应,生成另一种_____和另一种 _____ 的反应叫做置换反应.
Mg + 2HCl = MgCl2 + H2 ↑
Zn + H2SO4 = ZnSO4 + H2 ↑
Fe + CuSO4 = FeSO4 + Cu
化合物
单质
单质
化合物
1、反应前后均为两种物质
置换反应:
判断方法:
2、反应前后均为一种单质和一种化合物
下列反应属于置换反应吗?
2. C + 2CuO 2Cu + CO2↑
3. H2 + CuO H2O + Cu
1. Zn + 2HCl = ZnCl2 + H2 ↑
金属活动性顺序:
符号:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
名称:
金属活动性由强逐渐减弱
钾 钙 钠 镁 铝 锌 铁 锡 铅(氢)铜 汞 银 铂 金
金属活动性顺序:
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
试一试:想一想:
1.在金属活动性顺序里:金属的位置越 ______ ,它的活动性就越强。
2. 在金属活动性顺序里:位于 ____ 前面的金属能置换出盐酸、稀硫酸中的_____。
3. 在金属活动性顺序里:位于_____ 的金属能把位于____ 的金属从它们的化合物的 _____里置换出来。
靠前
氢
后面
溶液
氢
前面
(K、Ca、Na除外!)
金属活动性由强逐渐减弱
活泼金属 较活泼金属 不活泼金属
点拨:
1.在金属活动性顺序表中,两金属相隔越远,其置换能力就越强。例如:锌和铜放入硝酸银溶液中,先发生反应的是锌和硝酸银,当锌用完后,才是铜与硝酸银溶液反应;
2、K、Ca、Na不能把它后面的金属从它们的盐溶液中置换出来。因为钾钙钠的活动性太强,能与水发生反应生成碱和氢气。
学完本课题你应该知道
1、金属的化学性质
①大多数金属能与氧气反应(化合反应)
②大多数金属能与盐酸、稀硫酸反应(置换反应)
③部分金属能与金属化合物溶液反应(置换反应)
2、置换反应
由一种单质与一种化合物反应,生成另一种单质和另一种化合物的反应。
Fe + 2HCl = FeCl2 + H2↑
Fe + CuSO4 = FeSO4 + Cu
4、判断常见金属活泼性的方法
3、常见金属的活动性顺序如下:
金属活动性顺序可以作为金属能否在溶液中发生置换反应的一种判断依据。
①金属与酸反应的剧烈程度。氢前金属+盐酸(稀硫酸) (金属越活泼,反应越容易,越剧烈)
金属与酸不能反应(排在氢后面)
②金属能否与金属化合物的溶液反应。(位于前面的金属把位于后面的金属从它的化合物的溶液中置换出来)
1、下列物质能否发生反应?写出能反应的化学方程式。
(1)银与稀盐酸 (2)锌与硫酸铜溶液(3)铜与硫酸锌溶液(4)铝与硝酸银溶液
不能反应
不能反应
Zn + CuSO4 = ZnSO4 + Cu
Al + 3AgNO3 = Al(NO3)3 + 3Ag
2、填写下列表格(“混合物”栏中括号内为杂质)。
Fe+2HCl = FeCl2+H2↑
加适量盐酸至无气泡产生,过滤,洗涤,干燥
Fe+CuCl2 = FeCl2+Cu
加适量无锈铁钉或铁粉,过滤
混合物 除去杂质的化学方程式 主要操作步骤
铜粉
(Fe)
FeCl2溶液(CuCl2)
同课章节目录
