2020年山西晋中介休一中酸碱中和滴定 课件 19PPT
文档属性
| 名称 | 2020年山西晋中介休一中酸碱中和滴定 课件 19PPT |

|
|
| 格式 | zip | ||
| 文件大小 | 6.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-06 00:00:00 | ||
图片预览






文档简介
(共19张PPT)
酸碱中和滴定
选修四第二节第三部分
高中化学米鱼
课标要求
1.要懂得酸碱中和滴定的原理
2.掌握测定物质含量的又一种方法
3.提高动手操作能力,对实验现象的
观察能力,对数据的处理能力,误差
分析思维能力
1.酸碱中和滴定:
用已知浓度的酸滴定未知浓度的碱,或用已知浓度的碱滴定未知浓度酸的方法。
2.原理:H+ + OH- = H20
若一元酸与一元碱滴定则:c待测=
c标V标
V待测
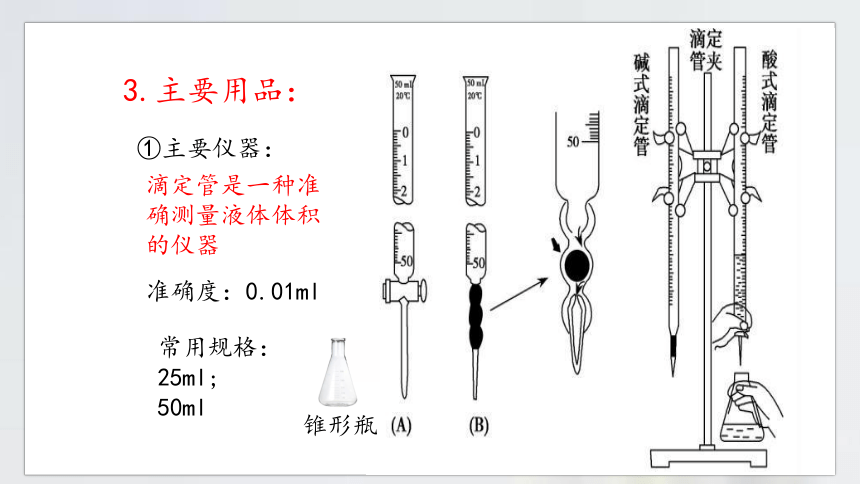
3.主要用品:
①主要仪器:
滴定管是一种准确测量液体体积的仪器
准确度:0.01ml
常用规格:25ml; 50ml
锥形瓶
②试剂:标准液(已知浓度的酸或碱)
待测液(未知浓度的碱或酸)
指示剂
4.指示剂的选择原则:
①变色要灵敏
②变色点靠近中和点
常见指示剂变色范围:
甲基橙:红3.1——4.4黄
橙色
酚酞:无8.1——10.0红
浅红
主要用品
1.以标准NaOH溶液滴定CH3COOH溶液选什么物质作指示剂?
酚酞
2.以标准的盐酸滴定氨水选什么物质作指示剂?
甲基橙
因为恰好中和时溶液显碱性
而酚酞变色点为8.1,彼此靠近
因为恰好中和时溶液显酸性
而甲基橙变色点为4.4,彼此靠近
思考
详写内容……点击输入本栏的具体文字,简明扼要的说明分项内容,此为概念图解,详写内容……
如果以标准的NaOH溶液滴定未知浓度的HCl溶液选什么物质作指示剂?或以标准的HCl溶液滴定未知浓度的NaOH溶液选什么物质作指示剂?
继续思考
甲基橙可以,酚酞也行
为什么?
例:用0.01mol/LNaOH溶液滴定20.00ml,0.01mol/L
的盐酸溶液,求①少加1滴NaOH溶液时溶液的PH
②多加1滴NaOH溶液时溶液的PH
1滴液体的体积约为0.05ml lg2 = 0.3
已知
解:①少加1滴NaOH溶液:(盐酸过量1滴)
c(H+)= =2-3×10-4mol/L
0.05ml×0.01mol/L
40.00ml
PH=-lgc(H+)=lg2-3×10-4mol/L=-(-4-3lg2)=4.9
可见这时的PH靠近甲基橙的变色点4.4
②多加1滴NaOH溶液时溶液时(NaOH溶液过量1滴)
c(OH-)= =2-3×10-4mol/L
0.05ml×0.01mol/L
40.00ml
c(H+) = = =23×10-10mol/L
Kw
c(OH-)
1×10-14
2-3×10-4
PH=-lgc(H+)=lg23×10-10mol/L=-(-10+3lg2)=9.1
可见这时的PH靠近酚酞的变色点8.1
多家1滴或少加1滴标准液对溶液的总体积影响不大,但溶液的PH会发生突跃性变化
领悟
所以强酸与强碱之间的滴定既可以用酚酞也可以用甲基橙
实验过程:
第一阶段:实验准备
①查漏(检查滴定管是否漏液)
②洗涤包括水洗和润洗(用所装溶液润洗)
③装液(将标准液和待测液加入到相应滴定管中,并使液面超过0刻度)
④排气泡,调液面(使液面低于或等于0刻度),记录初读数
⑤取一定体积待测液于锥形瓶中(15:00ml或20.00ml或25.00ml)
⑥加1-2滴指示剂
25%
90%
6%
75%
第二个阶段:滴定
左手控制活塞,
右手轻轻摇动锥形瓶,
眼睛注视溶液颜色变化
滴定终点的判断:
1.若用酚酞做指示剂,则最后一滴标准液滴入,溶液由无色变浅红(或者由浅红变无色),并且半分钟不在恢复原色。
2.若用甲基橙作指示剂,则最后一滴标准液滴入,溶液由橙色变黄色(或者由黄色变橙色),并且半分钟不在恢复原色。
盐酸
点击文本框即可进行编辑输入相关内容点击文本框即可进行编辑输入相关内容
添加标题
点击文本框即可进行编辑输入相关内容点击文本框即可进行编辑输入相关内容
添加标题
例题:用0.103mol/LNaOH溶液滴定未知浓度的盐酸,重复三次的实验数据如下表所示。计算滴定所测盐酸的物质的量浓度。
实验序号 0.103mol/LNaOH溶液
体积ml 待测盐酸的
体积ml
1 27.83 25.00
2 26.32 25.00
3 27.85 25.00
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Lorem ipsum dolor sit amet, Lorem ipsum dolor sit amet, Lorem ipsum dolor sit amet, consectetuer adipiscing elit.
参考文献
解:取两次用去NaOH溶液体积的平均值:
=27.84ml
27.83ml+27.85ml
2
反应方程式:HCl+NaOH=NaCl+H2O
(HCl)= =0.114mol/L
0.103mol/L×0.02784L
0.025L
答:滴定所测HCl溶液的物质的量浓度为0.114mol/L
步骤 操作 V标 c测
洗涤 碱式滴定管未用标准溶液润洗 变大 偏高
酸式滴定管未用待测液润洗 变小 偏低
锥形瓶用待测液润洗 变大 偏高
锥形瓶洗净后还留有蒸馏水 不变 无影响
5.误差分析:依据为c待测=
c标V标
V待测
步骤 操作 V标 c测
取液 量取酸溶液时滴定管中有气泡,放出液体后无气泡 变小 偏低
滴定 碱式滴定管滴定前有气泡,得到结束无气泡 变大 偏高
摇动锥形瓶时,部分液体外溅 变小 偏低
碱式滴定管中部分液体滴到外面 变大 偏高
读数 滴定前读数正确,滴定完后仰视读数(或前俯后仰) 变大 偏高
滴定前读数正确,滴定完后俯视读数(或前仰后俯) 变小 偏低
续表
5.误差分析:依据为c待测=
c标V标
V待测
谢谢聆听
酸碱中和滴定
选修四第二节第三部分
高中化学米鱼
课标要求
1.要懂得酸碱中和滴定的原理
2.掌握测定物质含量的又一种方法
3.提高动手操作能力,对实验现象的
观察能力,对数据的处理能力,误差
分析思维能力
1.酸碱中和滴定:
用已知浓度的酸滴定未知浓度的碱,或用已知浓度的碱滴定未知浓度酸的方法。
2.原理:H+ + OH- = H20
若一元酸与一元碱滴定则:c待测=
c标V标
V待测
3.主要用品:
①主要仪器:
滴定管是一种准确测量液体体积的仪器
准确度:0.01ml
常用规格:25ml; 50ml
锥形瓶
②试剂:标准液(已知浓度的酸或碱)
待测液(未知浓度的碱或酸)
指示剂
4.指示剂的选择原则:
①变色要灵敏
②变色点靠近中和点
常见指示剂变色范围:
甲基橙:红3.1——4.4黄
橙色
酚酞:无8.1——10.0红
浅红
主要用品
1.以标准NaOH溶液滴定CH3COOH溶液选什么物质作指示剂?
酚酞
2.以标准的盐酸滴定氨水选什么物质作指示剂?
甲基橙
因为恰好中和时溶液显碱性
而酚酞变色点为8.1,彼此靠近
因为恰好中和时溶液显酸性
而甲基橙变色点为4.4,彼此靠近
思考
详写内容……点击输入本栏的具体文字,简明扼要的说明分项内容,此为概念图解,详写内容……
如果以标准的NaOH溶液滴定未知浓度的HCl溶液选什么物质作指示剂?或以标准的HCl溶液滴定未知浓度的NaOH溶液选什么物质作指示剂?
继续思考
甲基橙可以,酚酞也行
为什么?
例:用0.01mol/LNaOH溶液滴定20.00ml,0.01mol/L
的盐酸溶液,求①少加1滴NaOH溶液时溶液的PH
②多加1滴NaOH溶液时溶液的PH
1滴液体的体积约为0.05ml lg2 = 0.3
已知
解:①少加1滴NaOH溶液:(盐酸过量1滴)
c(H+)= =2-3×10-4mol/L
0.05ml×0.01mol/L
40.00ml
PH=-lgc(H+)=lg2-3×10-4mol/L=-(-4-3lg2)=4.9
可见这时的PH靠近甲基橙的变色点4.4
②多加1滴NaOH溶液时溶液时(NaOH溶液过量1滴)
c(OH-)= =2-3×10-4mol/L
0.05ml×0.01mol/L
40.00ml
c(H+) = = =23×10-10mol/L
Kw
c(OH-)
1×10-14
2-3×10-4
PH=-lgc(H+)=lg23×10-10mol/L=-(-10+3lg2)=9.1
可见这时的PH靠近酚酞的变色点8.1
多家1滴或少加1滴标准液对溶液的总体积影响不大,但溶液的PH会发生突跃性变化
领悟
所以强酸与强碱之间的滴定既可以用酚酞也可以用甲基橙
实验过程:
第一阶段:实验准备
①查漏(检查滴定管是否漏液)
②洗涤包括水洗和润洗(用所装溶液润洗)
③装液(将标准液和待测液加入到相应滴定管中,并使液面超过0刻度)
④排气泡,调液面(使液面低于或等于0刻度),记录初读数
⑤取一定体积待测液于锥形瓶中(15:00ml或20.00ml或25.00ml)
⑥加1-2滴指示剂
25%
90%
6%
75%
第二个阶段:滴定
左手控制活塞,
右手轻轻摇动锥形瓶,
眼睛注视溶液颜色变化
滴定终点的判断:
1.若用酚酞做指示剂,则最后一滴标准液滴入,溶液由无色变浅红(或者由浅红变无色),并且半分钟不在恢复原色。
2.若用甲基橙作指示剂,则最后一滴标准液滴入,溶液由橙色变黄色(或者由黄色变橙色),并且半分钟不在恢复原色。
盐酸
点击文本框即可进行编辑输入相关内容点击文本框即可进行编辑输入相关内容
添加标题
点击文本框即可进行编辑输入相关内容点击文本框即可进行编辑输入相关内容
添加标题
例题:用0.103mol/LNaOH溶液滴定未知浓度的盐酸,重复三次的实验数据如下表所示。计算滴定所测盐酸的物质的量浓度。
实验序号 0.103mol/LNaOH溶液
体积ml 待测盐酸的
体积ml
1 27.83 25.00
2 26.32 25.00
3 27.85 25.00
Lorem ipsum dolor sit amet, consectetuer adipiscing elit. Aenean commodo ligula eget dolor. Lorem ipsum dolor sit amet, Lorem ipsum dolor sit amet, Lorem ipsum dolor sit amet, consectetuer adipiscing elit.
参考文献
解:取两次用去NaOH溶液体积的平均值:
=27.84ml
27.83ml+27.85ml
2
反应方程式:HCl+NaOH=NaCl+H2O
(HCl)= =0.114mol/L
0.103mol/L×0.02784L
0.025L
答:滴定所测HCl溶液的物质的量浓度为0.114mol/L
步骤 操作 V标 c测
洗涤 碱式滴定管未用标准溶液润洗 变大 偏高
酸式滴定管未用待测液润洗 变小 偏低
锥形瓶用待测液润洗 变大 偏高
锥形瓶洗净后还留有蒸馏水 不变 无影响
5.误差分析:依据为c待测=
c标V标
V待测
步骤 操作 V标 c测
取液 量取酸溶液时滴定管中有气泡,放出液体后无气泡 变小 偏低
滴定 碱式滴定管滴定前有气泡,得到结束无气泡 变大 偏高
摇动锥形瓶时,部分液体外溅 变小 偏低
碱式滴定管中部分液体滴到外面 变大 偏高
读数 滴定前读数正确,滴定完后仰视读数(或前俯后仰) 变大 偏高
滴定前读数正确,滴定完后俯视读数(或前仰后俯) 变小 偏低
续表
5.误差分析:依据为c待测=
c标V标
V待测
谢谢聆听
