人教版九年级下册8.3 金属资源的利用和保护 (共35张PPT)
文档属性
| 名称 | 人教版九年级下册8.3 金属资源的利用和保护 (共35张PPT) |

|
|
| 格式 | ppt | ||
| 文件大小 | 15.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-06 00:00:00 | ||
图片预览










文档简介
(共35张PPT)
世界跨径最大的斜拉桥———苏通大桥
苏通大桥总长8206米,斜拉桥主孔跨度1088米,列世界第一;主塔高度306米,列世界第一;斜拉索的长度580米,列世界第一。
人类生活离不开金属
金属有广泛的用途,对于人类社会起着不可替代的作用!
军事与科技也需要大量的金属
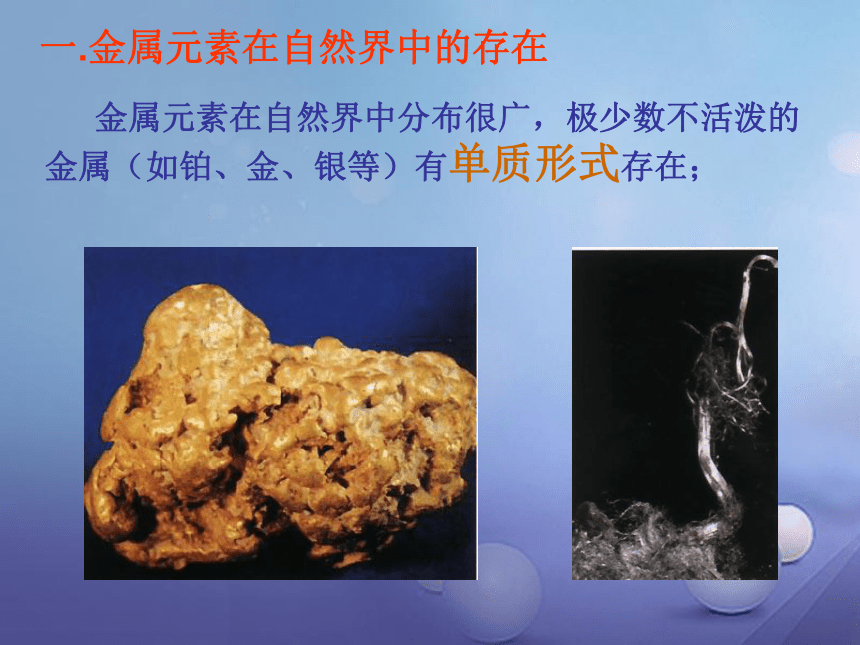
一.金属元素在自然界中的存在
金属元素在自然界中分布很广,极少数不活泼的金属(如铂、金、银等)有单质形式存在;
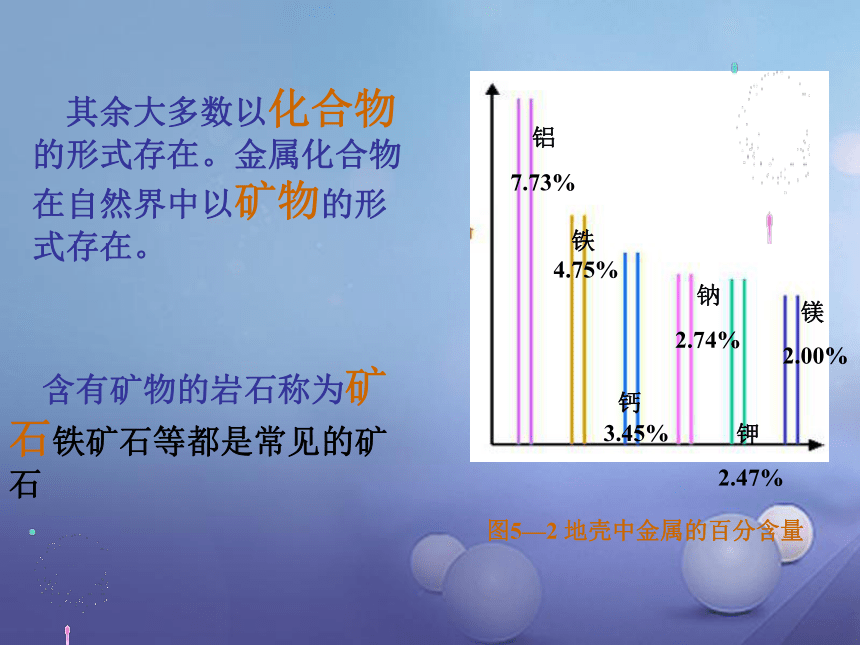
图5—2 地壳中金属的百分含量
铝
7.73%
铁 4.75%
钙 3.45%
钠
2.74%
钾
2.47%
镁
2.00%
含有矿物的岩石称为矿石铁矿石等都是常见的矿石
其余大多数以化合物的形式存在。金属化合物在自然界中以矿物的形式存在。
常见几种金属矿物的成分
磁铁矿
褐铁矿
赤铁矿
Fe3O4
Fe2O3·XH2O
Fe2O3
孔雀石
Cu2(OH)2CO3
赤铜矿
Cu2O
赤铁矿
黄铁矿
菱铁矿
铝士矿
黄铜矿
辉铜矿
我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要志地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提炼数以亿吨计的金属用于工农业生产和其它领域。其中,提取量最大的是铁。
二.铁的冶炼
现象:红色粉末变成黑色,产生气体使澄清的石灰水变浑浊。
一氧化碳还原氧化铁
高炉是个竖直的圆筒形炉子,炉壳用钢板制成,内部用耐火砖作衬里。炼铁的主要原料是铁矿石、焦炭、石灰石和空气。
高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来
补充:炼钢
视频:工业上生铁炼钢
据有关资料报导,现在全世界每年被腐蚀而报废的金属设备和材料相当于年产量的20%——40%
钢铁的最大的弱点就是容易生绣
三.金属资源保护
1.金属的腐蚀和防护
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用
金属锈蚀给人类带来了巨大的损失。
取3枚洁净无锈的铁钉,分别放入3支试管中进行下面的实验
步骤一、在试管1中加入少量的蒸馏水,使铁钉的一半浸没在水中
步骤二、在试管2中注满迅速冷却的沸水塞紧橡皮塞
步骤三、在试管3中加入少量干燥剂(生石灰或无水氯化钙)
再放一团干棉球,把铁钉放在干棉球上,塞紧橡皮塞
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程
铁锈成分复杂,主要是Fe2O3·XH2O它是一种疏松多孔的物质
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
在切过咸菜的铁质菜刀同一面上选相近的三处进行下列实验
一处:用湿棉球湿润;
一处:用干布檫干
一处:用干布檫干后,涂上一层食油;
放置一昼夜,观察菜刀三处表面发生的变化
与空气(氧气)接触
与水接触
怎么防止钢铁生锈呢?
在车船的表面喷油漆
在机械表面涂防锈油
在面盆、杯子、等表面烧涂搪瓷
此外,还可以在钢铁表面镀上一层能起保护作用的其他金属。(为什么?)
如:在钢铁表面镀锡、镀锌、和镀铬
镀铜?
总结:防止钢铁制品生锈的方法:
铝比铁更容易跟氧气和其他物质发生化学反应。铝在空气中与氧气反应,生成的氧化铝形成一层致密而结实的膜覆盖在铝的表面,防止铝继续与氧气反应,从而起来“自我保护”的作用
(1)隔绝空气或氧气 (2)隔绝水
具体方法:
1.“穿外衣”——加一层保护膜(如:刷油漆、涂油、电镀、致密的氧化膜)
2.“打强心针”——在铁中加入其它金属改变其内部结构,(如:制成不锈钢)
①保持钢铁表面的清洁干燥。
②镀金属保护层:如镀锡、镀锌、镀铬等;白铁皮镀锌,马口铁镀锡,
钢圈镀铬、镍。
③涂非金属保护层:如喷涂油漆、涂防锈油、在脸盆、杯子表面烧
涂搪瓷、用橡胶或塑料包在钢铁表面。
④形成氧化膜保护层:枪套上形成四氧化三铁、 锯条上的烤蓝。
⑤在钢铁里加入金属或非金属形成耐腐蚀合金:如不锈钢(加Cr、Ni)
防止铁锈蚀的主要措施:
一.防止金属的腐蚀
二.回收利用废旧金属
三.合理有效开采矿物
四.寻找金属的代用品
(1)汞与稀盐酸 (2)铝与硫酸铜溶液
(3)银与硫酸锌溶液 (4)锌与硝酸银溶液
(5)钠与稀硫酸
1、下列物质能否发生反应?写出能发生反应的化学方程式。
2、回答下列问题:
(1)为什么沙漠地区的铁制品锈蚀较慢?
(2)切过咸鱼的刀不经洗净抹干,为什么很快就生锈?
(3)被雨水淋湿的自行车,为什么须先用干布擦净后才
能用带有油的布擦?
例:某赤铁矿含Fe2O3 80%,用3000 t这种矿石,可炼出含杂质4%的生铁多少吨?
分析:计算时应注意把反应物和生成物都换算成纯物质的量,再代入化学方程式计算.
解:设3000 t这种矿石,可炼出生铁质量为x,
根据题设:纯Fe2O3质量=3000 t×80%=2400 t
纯Fe质量=x·(1-4%)=x·96%
代入化学方程式中:
Fe2O3+3CO=2Fe+3CO2
160 112
2400 t x·96%
x==1750 t
答:可炼出含杂质4%的生铁1750 t.
若赤铁矿石中Fe2O3的质量分数为80%,600 t 这样的赤铁矿可炼出含碳等其他杂质质量分数为7%的生铁多少吨?
解:设可炼出含杂质质量分数为7%的生铁的质量为x
Fe2O3+3CO= 2Fe +3CO2
160 112
600 t×80% x·(1-7%)
x==365 t
答案:可炼出含碳等杂质质量为7%的生铁365 t.
点拨:这类题很容易出错,错误原因主要在于没有理解哪些是不纯物的质量,哪些是纯净物的质量.赤铁矿和生铁都是混合物,而在化学方程式的计算中,所涉及到的都是纯净物的质量,只要牢牢把握住这一点,所有含杂质的计算都可迎刃而解.
练习:
1、某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,
该厂理论上可以日产Fe98%的生铁多少t
2、冶炼2000t含杂质3%的生铁,需要含90%Fe2O3的赤铁矿
石多少t
4.某钢铁厂每天需消耗5000 t含Fe2O3 76%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁多少吨?
指导建议:首先将不纯物的量转化成纯物质量
Fe2O3质量=5000 t×76%=3800 t
设生铁质量为x,则纯铁质量=98%·x
然后再根据方程式进行计算.
Fe2O3+3CO2Fe+3CO2
160 112
3800 t 98%·x
160∶3800 t=112∶98%·x x=≈2714.3 t
冶炼2000 t含杂质3%的生铁,需要含Fe3O4 90%的磁铁矿石多少吨?
指导建议:纯铁质量=2000 t×(1-3%)=1940 t
设磁铁矿石质量为x,则Fe3O4质量为90%·x
反应原理: Fe3O4+4CO3Fe+4CO2
232 168
90%·x 1940 t
232∶90%·x=168∶1940 t
x==2976.7 t
所以磁铁矿质量为2976.7 t.
1、245gKClO3完全分解能制得多少O2?若用电解水的方式制等量的O2,则需水几克?
2. 某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产Fe98%的生铁多少t 若用含90%Fe3O4的磁铁矿
石来代替,则需含90%Fe3O4的磁铁矿 石多少t
例题:用1000 t含氧化铁80%的赤铁矿石,理论上可以
炼出含铁96%的生铁多少 t
解:设理论上可以炼出含铁96的生铁的质量为x
Fe2O3 ------------------2 Fe
160 2×56
1000t×80% x·96%
∵ 160 2×56
1000t×80% x·96%
∴ x=
2×56× 1000t×80%
160×96%
= 583 t
答:略。
世界跨径最大的斜拉桥———苏通大桥
苏通大桥总长8206米,斜拉桥主孔跨度1088米,列世界第一;主塔高度306米,列世界第一;斜拉索的长度580米,列世界第一。
人类生活离不开金属
金属有广泛的用途,对于人类社会起着不可替代的作用!
军事与科技也需要大量的金属
一.金属元素在自然界中的存在
金属元素在自然界中分布很广,极少数不活泼的金属(如铂、金、银等)有单质形式存在;
图5—2 地壳中金属的百分含量
铝
7.73%
铁 4.75%
钙 3.45%
钠
2.74%
钾
2.47%
镁
2.00%
含有矿物的岩石称为矿石铁矿石等都是常见的矿石
其余大多数以化合物的形式存在。金属化合物在自然界中以矿物的形式存在。
常见几种金属矿物的成分
磁铁矿
褐铁矿
赤铁矿
Fe3O4
Fe2O3·XH2O
Fe2O3
孔雀石
Cu2(OH)2CO3
赤铜矿
Cu2O
赤铁矿
黄铁矿
菱铁矿
铝士矿
黄铜矿
辉铜矿
我国是世界上已知矿物种类比较齐全的少数国家这一,矿物储量也很丰富,其中钨、钼、钛、锡、锑等储量居世界前列,铜、铝、锰等储量在世界观上也占有重要志地位。
大自然向人类提供了丰富的金属矿物资源,人类每年要提炼数以亿吨计的金属用于工农业生产和其它领域。其中,提取量最大的是铁。
二.铁的冶炼
现象:红色粉末变成黑色,产生气体使澄清的石灰水变浑浊。
一氧化碳还原氧化铁
高炉是个竖直的圆筒形炉子,炉壳用钢板制成,内部用耐火砖作衬里。炼铁的主要原料是铁矿石、焦炭、石灰石和空气。
高温下,用还原剂(主要是一氧化碳)从铁矿石里把铁还原出来
补充:炼钢
视频:工业上生铁炼钢
据有关资料报导,现在全世界每年被腐蚀而报废的金属设备和材料相当于年产量的20%——40%
钢铁的最大的弱点就是容易生绣
三.金属资源保护
1.金属的腐蚀和防护
铁轨的锈蚀
铁钉的生锈
各种铁制品的锈蚀
为了减少损失,需要探究金属锈蚀的原因、防护的方法和废金属的回收利用
金属锈蚀给人类带来了巨大的损失。
取3枚洁净无锈的铁钉,分别放入3支试管中进行下面的实验
步骤一、在试管1中加入少量的蒸馏水,使铁钉的一半浸没在水中
步骤二、在试管2中注满迅速冷却的沸水塞紧橡皮塞
步骤三、在试管3中加入少量干燥剂(生石灰或无水氯化钙)
再放一团干棉球,把铁钉放在干棉球上,塞紧橡皮塞
在空气中锈蚀,实际上是铁跟氧气、水等物质相互作用,发生一系列复杂的化学变化,使铁转化为铁的化合物的过程
铁锈成分复杂,主要是Fe2O3·XH2O它是一种疏松多孔的物质
铁锈这种多孔性的物质,能让水分和空气穿过它的空隙,不断向里层渗透,继续跟铁反应,直至铁被完全锈蚀。
在切过咸菜的铁质菜刀同一面上选相近的三处进行下列实验
一处:用湿棉球湿润;
一处:用干布檫干
一处:用干布檫干后,涂上一层食油;
放置一昼夜,观察菜刀三处表面发生的变化
与空气(氧气)接触
与水接触
怎么防止钢铁生锈呢?
在车船的表面喷油漆
在机械表面涂防锈油
在面盆、杯子、等表面烧涂搪瓷
此外,还可以在钢铁表面镀上一层能起保护作用的其他金属。(为什么?)
如:在钢铁表面镀锡、镀锌、和镀铬
镀铜?
总结:防止钢铁制品生锈的方法:
铝比铁更容易跟氧气和其他物质发生化学反应。铝在空气中与氧气反应,生成的氧化铝形成一层致密而结实的膜覆盖在铝的表面,防止铝继续与氧气反应,从而起来“自我保护”的作用
(1)隔绝空气或氧气 (2)隔绝水
具体方法:
1.“穿外衣”——加一层保护膜(如:刷油漆、涂油、电镀、致密的氧化膜)
2.“打强心针”——在铁中加入其它金属改变其内部结构,(如:制成不锈钢)
①保持钢铁表面的清洁干燥。
②镀金属保护层:如镀锡、镀锌、镀铬等;白铁皮镀锌,马口铁镀锡,
钢圈镀铬、镍。
③涂非金属保护层:如喷涂油漆、涂防锈油、在脸盆、杯子表面烧
涂搪瓷、用橡胶或塑料包在钢铁表面。
④形成氧化膜保护层:枪套上形成四氧化三铁、 锯条上的烤蓝。
⑤在钢铁里加入金属或非金属形成耐腐蚀合金:如不锈钢(加Cr、Ni)
防止铁锈蚀的主要措施:
一.防止金属的腐蚀
二.回收利用废旧金属
三.合理有效开采矿物
四.寻找金属的代用品
(1)汞与稀盐酸 (2)铝与硫酸铜溶液
(3)银与硫酸锌溶液 (4)锌与硝酸银溶液
(5)钠与稀硫酸
1、下列物质能否发生反应?写出能发生反应的化学方程式。
2、回答下列问题:
(1)为什么沙漠地区的铁制品锈蚀较慢?
(2)切过咸鱼的刀不经洗净抹干,为什么很快就生锈?
(3)被雨水淋湿的自行车,为什么须先用干布擦净后才
能用带有油的布擦?
例:某赤铁矿含Fe2O3 80%,用3000 t这种矿石,可炼出含杂质4%的生铁多少吨?
分析:计算时应注意把反应物和生成物都换算成纯物质的量,再代入化学方程式计算.
解:设3000 t这种矿石,可炼出生铁质量为x,
根据题设:纯Fe2O3质量=3000 t×80%=2400 t
纯Fe质量=x·(1-4%)=x·96%
代入化学方程式中:
Fe2O3+3CO=2Fe+3CO2
160 112
2400 t x·96%
x==1750 t
答:可炼出含杂质4%的生铁1750 t.
若赤铁矿石中Fe2O3的质量分数为80%,600 t 这样的赤铁矿可炼出含碳等其他杂质质量分数为7%的生铁多少吨?
解:设可炼出含杂质质量分数为7%的生铁的质量为x
Fe2O3+3CO= 2Fe +3CO2
160 112
600 t×80% x·(1-7%)
x==365 t
答案:可炼出含碳等杂质质量为7%的生铁365 t.
点拨:这类题很容易出错,错误原因主要在于没有理解哪些是不纯物的质量,哪些是纯净物的质量.赤铁矿和生铁都是混合物,而在化学方程式的计算中,所涉及到的都是纯净物的质量,只要牢牢把握住这一点,所有含杂质的计算都可迎刃而解.
练习:
1、某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,
该厂理论上可以日产Fe98%的生铁多少t
2、冶炼2000t含杂质3%的生铁,需要含90%Fe2O3的赤铁矿
石多少t
4.某钢铁厂每天需消耗5000 t含Fe2O3 76%的赤铁矿石,该厂理论上可日产含Fe 98%的生铁多少吨?
指导建议:首先将不纯物的量转化成纯物质量
Fe2O3质量=5000 t×76%=3800 t
设生铁质量为x,则纯铁质量=98%·x
然后再根据方程式进行计算.
Fe2O3+3CO2Fe+3CO2
160 112
3800 t 98%·x
160∶3800 t=112∶98%·x x=≈2714.3 t
冶炼2000 t含杂质3%的生铁,需要含Fe3O4 90%的磁铁矿石多少吨?
指导建议:纯铁质量=2000 t×(1-3%)=1940 t
设磁铁矿石质量为x,则Fe3O4质量为90%·x
反应原理: Fe3O4+4CO3Fe+4CO2
232 168
90%·x 1940 t
232∶90%·x=168∶1940 t
x==2976.7 t
所以磁铁矿质量为2976.7 t.
1、245gKClO3完全分解能制得多少O2?若用电解水的方式制等量的O2,则需水几克?
2. 某钢铁厂每天需消耗5000t含氧化铁76%的赤铁矿石,该厂理论上可以日产Fe98%的生铁多少t 若用含90%Fe3O4的磁铁矿
石来代替,则需含90%Fe3O4的磁铁矿 石多少t
例题:用1000 t含氧化铁80%的赤铁矿石,理论上可以
炼出含铁96%的生铁多少 t
解:设理论上可以炼出含铁96的生铁的质量为x
Fe2O3 ------------------2 Fe
160 2×56
1000t×80% x·96%
∵ 160 2×56
1000t×80% x·96%
∴ x=
2×56× 1000t×80%
160×96%
= 583 t
答:略。
同课章节目录
