人教版高一 化学 必修二 第二章第一节 化学能与热能 (共26张PPT)
文档属性
| 名称 | 人教版高一 化学 必修二 第二章第一节 化学能与热能 (共26张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览








文档简介
(共30张PPT)
新课标人教版化学必修Ⅱ
第二章 第一节 化学能与热能
(第1课时)
一飞冲天:火箭发射
生活中哪些事实说明了在化学反应中伴随着能量的变化?
【思考与交流】
燃烧----“贮存”在物质内部的能量转化为热能等而被释放出来
光合作用----光能转化为物质内部的能量而被“贮存”起来
物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
第一节 化学能与热能
一、化学键与化学反应中能量变化的关系
1、化学反应的本质是?
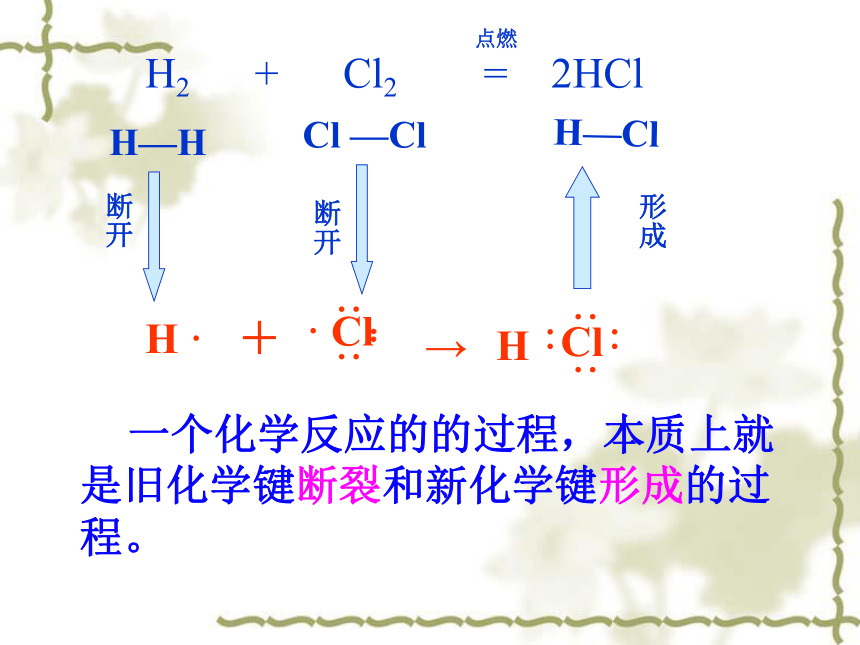
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
2摩H2和1摩O2生成2摩H2O的能量变化
举例:
拆开1摩H2所需能量是436KJ,
拆开1摩O2需要能量是496KJ,
形成1摩H-O键要放出463KJ的能量。
算一算:
放出484KJ的能量
键能:拆开气态物质中1mol某种共价键需要吸收的能量或合成气态物质中1mol某种共价键放出的能量,就是该共价键的键能。
原子形成分子的过程中要 能量,反之要使气态分子中彼此结合的原子分开,使原子之间的共价键断裂,则要 能量。形成共价化合物的原子半径越 ,其共价键越 ,键能越 ,该共价键越牢固,分子越稳定。
放出
吸收
小
强
大
从物质总能量的角度分析
分析化学反应
放出能量
看图讨论
分析化学反应
吸收能量
从物质总能量的角度分析
一个化学反应是放热反应还是吸热反应
取决于反应物的总能量
与生成物的总能量的相对大小
规律
反应物的能量之和
E反
生成物的能量之和
E生
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
知识小结
从化学键
的角度 从物质总
能量角度
放热反应 断键吸收的总能量小于形成新键放出的总能量 反应物的总能量大于生成物的总能量
吸热反应 断键吸收的总能量大于形成新键放出的总能量 反应物的总能 量小于生成物的总能量
1.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定
能发生
C
课堂练习:
2.在反应H2 + Cl2 =2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量
BD
3.下列关于能量转换的认识中不正确的
是( )
A. 电解水生成氢气和氧气时,电能转
化为化学能
B. 绿色植物进行光合作用时,太阳能
转化为热能
C. 煤燃烧时,化学能主要转化为热能
D. 白炽灯工作时,电能全部转化为光能
BD
4.下列说法中正确的是( )
A. 物质发生化学反应都伴随着能量变化
B. 所有物质的内部都“储存”有能量,而
且这些能量都是相等的
C. 在一个确定的化学反应关系中,反应
物的总能量总是高于生成物的总能量
D. 化学反应的过程实质是断开旧化学键
形成新化学键的过程
AD
9、在相同条件下,下列物质分别与H2
反应,当消耗等物质的量的H2时,放出
热量最多的是( )
A. Cl2 B. Br2
C. I2 D. S
A
新课标人教版化学必修Ⅱ
第二章 第一节 化学能与热能
(第1课时)
一飞冲天:火箭发射
生活中哪些事实说明了在化学反应中伴随着能量的变化?
【思考与交流】
燃烧----“贮存”在物质内部的能量转化为热能等而被释放出来
光合作用----光能转化为物质内部的能量而被“贮存”起来
物质发生化学反应的同时还伴随着能量的变化,而这种能量变化又通常表现为热能变化。
第一节 化学能与热能
一、化学键与化学反应中能量变化的关系
1、化学反应的本质是?
以氢气在氯气中燃烧为例,用化学键的观点分析反应的本质过程。
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
断开
断开
点燃
一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。
形成
H2 + Cl2 = 2HCl
H—H
Cl —Cl
H—Cl
吸收能量
断开
断开
吸收能量
形成
放出能量
点燃
化学键的断裂和形成是化学反应中能量变化的主要原因。
从化学键的角度分析
一个化学反应的过程,本质上就是
旧化学键断裂和新化学键形成的过程。
吸收能量
放出能量
所以:一个化学反应是放热反应还是吸热反应
取决于所有断键吸收的总能量与所有
形成新键放出的总能量的相对大小
2摩H2和1摩O2生成2摩H2O的能量变化
举例:
拆开1摩H2所需能量是436KJ,
拆开1摩O2需要能量是496KJ,
形成1摩H-O键要放出463KJ的能量。
算一算:
放出484KJ的能量
键能:拆开气态物质中1mol某种共价键需要吸收的能量或合成气态物质中1mol某种共价键放出的能量,就是该共价键的键能。
原子形成分子的过程中要 能量,反之要使气态分子中彼此结合的原子分开,使原子之间的共价键断裂,则要 能量。形成共价化合物的原子半径越 ,其共价键越 ,键能越 ,该共价键越牢固,分子越稳定。
放出
吸收
小
强
大
从物质总能量的角度分析
分析化学反应
放出能量
看图讨论
分析化学反应
吸收能量
从物质总能量的角度分析
一个化学反应是放热反应还是吸热反应
取决于反应物的总能量
与生成物的总能量的相对大小
规律
反应物的能量之和
E反
生成物的能量之和
E生
(1)若E反> E生,
(2)若E反< E生,
放出能量
吸收能量
放热反应
吸热反应
知识小结
从化学键
的角度 从物质总
能量角度
放热反应 断键吸收的总能量小于形成新键放出的总能量 反应物的总能量大于生成物的总能量
吸热反应 断键吸收的总能量大于形成新键放出的总能量 反应物的总能 量小于生成物的总能量
1.已知反应A+B=C+D为放热反应,对该反应
的下列说法中正确的是( )
A. A的能量一定高于C
B. B的能量一定高于D
C. A和B的总能量一定高于C和D的总能量
D. 该反应为放热反应,故不必加热就一定
能发生
C
课堂练习:
2.在反应H2 + Cl2 =2HCl中,已知H-H键能为436kJ,Cl-Cl键能为247kJ,H-Cl键能为431kJ,判断该反应是( )
A. 吸热反应 B. 放热反应
C. 吸收179kJ热量 D.放出179kJ热量
BD
3.下列关于能量转换的认识中不正确的
是( )
A. 电解水生成氢气和氧气时,电能转
化为化学能
B. 绿色植物进行光合作用时,太阳能
转化为热能
C. 煤燃烧时,化学能主要转化为热能
D. 白炽灯工作时,电能全部转化为光能
BD
4.下列说法中正确的是( )
A. 物质发生化学反应都伴随着能量变化
B. 所有物质的内部都“储存”有能量,而
且这些能量都是相等的
C. 在一个确定的化学反应关系中,反应
物的总能量总是高于生成物的总能量
D. 化学反应的过程实质是断开旧化学键
形成新化学键的过程
AD
9、在相同条件下,下列物质分别与H2
反应,当消耗等物质的量的H2时,放出
热量最多的是( )
A. Cl2 B. Br2
C. I2 D. S
A
