人教版 高中化学 必修2 第2章 《化学反应与能量》 复习 (共23张PPT)
文档属性
| 名称 | 人教版 高中化学 必修2 第2章 《化学反应与能量》 复习 (共23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 783.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 18:49:53 | ||
图片预览








文档简介
(共23张PPT)
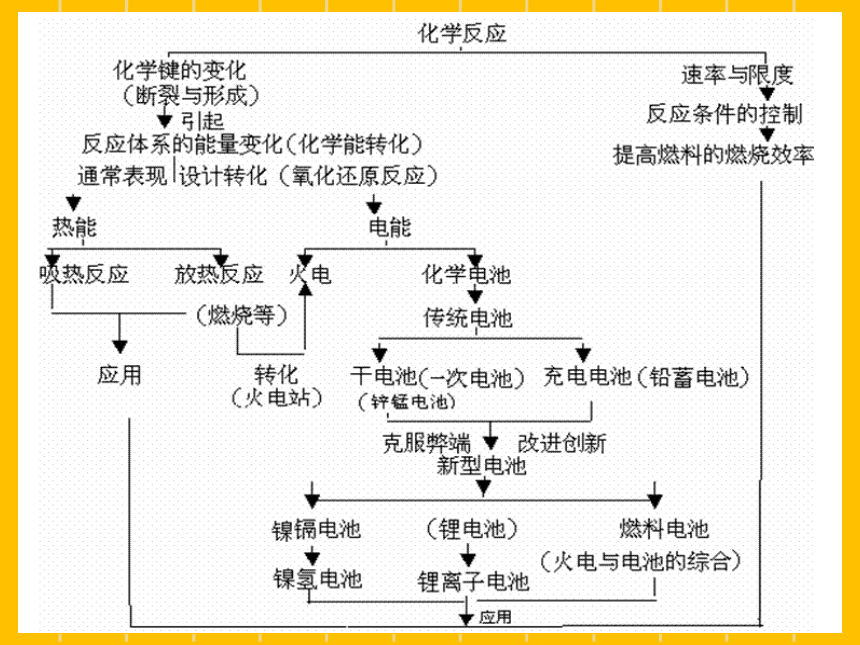
第二章 化学反应与能量
一、化学能与热能
1、化学反应的实质:
旧化学键断裂,新化学键形成的过程。
2、任何化学反应都伴随着能量的变化!
引起化学反应中的能量变化:
(1)微观:化学键的断裂和形成是化学反应中能量变化的主要原因;
化学键的断裂——吸收能量;
化学键的形成——放出能量。
反应物 生成物
化学反应=旧化学键断裂+新化学键形成
(吸收总能量E1)(放出总能量E2)
①当E1 > E2 , 反应吸收能量
②当E1 < E2 , 反应放出能量
(2)宏观:在化学反应中,反应物的总能量与生成物的总能量间的能量差。
EA EB
①反应物总能量>生成物总能量 反应放出能量
②反应物总能量<生成物总能量 反应吸收能量
4、化学反应中的能量变化主要表现为热量的变化——吸热或放热。
3、一种能量可以转化为另一种能量,能量是守恒的,这就是能量守恒定律。
现象
结论
溶液温度升高
2Al+6HCl=2AlCl3+3H2↑
放出热量
实验2-1
现象
结论
1、手摸杯底有冷的感觉
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
吸热
实验2-2
2、烧杯与玻璃片黏结在一起
盐酸温度℃
NaOH溶液温度℃
中和反应后温度℃
26
26
39
实验2-3
中和热:酸与碱发生中和反应生成1mol水所释放的热量称为中和热。
5、常见的放热反应:
(化学上把放出热量的化学反应叫放热反应)
(1)所有的燃烧反应
(2)酸碱中和反应
(3)大多数的化合反应
(4)金属与酸的反应
(5)缓慢氧化反应
6、常见的吸热反应:
(化学上把吸收热量的化学反应叫吸热反应)
⑴C+CO2=2CO
⑵H2+CuO=H2O+Cu
⑶C+H2O=CO+H2
⑷Ba(OH)2.8H2O+NH4Cl
⑸CaCO3高温分解
⑹大部分分解反应
火力发电中能量是如何转化的呢?
二、化学能与电能
(原)电池
定义:将化学能转变成电能的装置叫做原电池。
失
得
Zn-2e-= Zn2+
2H+ + 2e-=H2↑
负极
正极
Zn+2H+=Zn2++H2↑
有气体产生
Zn片溶解
锌铜原电池原理
负极出电子,电子回正极
电极材料 现象 电子得失 电极反应 原电池的电极
Zn片
Cu片
总的离子反应方程式
原电池反应的本质是: 氧化还原反应。
较活泼金属
较不活泼金属
负 极
正 极
发生氧化反应
发生还原反应
e-
I
电子流出,电流流入
电子流入,电流流出
原电池的电极:
原电池形成条件:
① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极。
其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用)。
② 电解质溶液
③ 形成闭合电路
④ 能自发地发生氧化还原反应
两极一液一连线
原电池原理的应用:
①制作化学电源:各种电池
②加快反应速率:
例如:实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
因为钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀。
判断原电池正、负极的方法
*由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
*根据电流方向或电子流动方向判断:
电流是由正极流向负极
电子流动方向是由负极流向正极
*根据原电池两极发生的变化来判断:
失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极
1、概念:
浓度常用mol.L-1,时间常用s,min。
3 、单位:
2、数学表达式为:
三、化学反应速率
用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示
mol/(L·min)或mol/(L·s)
4 、ひ是平均速率,不是瞬时速率。
5 、对某一反应而言:
ひ(A)∶ひ(B)∶ひ(C)∶ひ(D) =
m∶n∶p∶q
练习
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
解:ひ= (1.0-0.2)mol/L ÷20s = 0.04mol/(L·s)
A. 0.04 B. 0.04mol/(L·s) C. 0.8mol/(L·s) D. 0.04mol/L
B
2.反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)ひ(A)=0.3mol/L·s (2)ひ(B)=0.6mol/L·s (3)ひ(C)=0.4mol/L·s (4)ひ(D)=0.45mol/L·s
则该反应速率的快慢顺序为—————————。
(1)>(4)>(2)=(3)
比较反应的快慢,应取同一参照物
6. 化学反应速率的影响因素:
内因(决定作用):反应物本身的性质
外因(外界条件):浓度、温度、压强、催化剂、固体的表面积、反应物的状态等
①温度:温度升高,化学反应速率加快。
②催化剂:催化剂能改变化学反应速率。
③浓度:在其它条件不变时,增大反应物的浓度,可以增大反应速率。
④压强: 对于有气体参加的化学反应, 增大压强,可以增大反应速率。
⑤固体的表面积:增大固体的接触面积,能增大反应速率。
⑥反应物的状态:液态或气态比固态反应速率快。
1 、可逆反应
正向反应:反应物→生成物
是指在同一条件,正向反应和逆向反应同时进行的反应。
逆向反应:生成物→反应物
四、化学反应的限度—— 化学平衡状态
2、概念:当一个可逆反应进行到正反应速率与逆反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。
化学平衡的标志:
ひ正=ひ逆
反应混合物中各组分的浓度保持不变
3、化学平衡状态的特征:
逆、等、动、定、变。
逆:化学平衡研究的对象是可逆反应。
等:ひ(正)=ひ(逆) (是化学平衡状态的本质)。
动:动态平衡,正、逆反应还在不断进 行,正、逆反应速率相等但不等于零。
定:平衡时,各组分的浓度保持一定 (是化学平衡状态的外观特征)。
变:当影响化学平衡的外界条件改变,平衡会发生移动。
4、任何化学反应的进程都有一定的限度 ,只是不同反应的限度不同。
5、有些反应的可逆性很小,如Ag++Cl- = AgCl ↓,一般可视为不可逆反应。
6、化学反应的限度可以通过改变条件而改变。(化学平衡的移动)
第二章 化学反应与能量
一、化学能与热能
1、化学反应的实质:
旧化学键断裂,新化学键形成的过程。
2、任何化学反应都伴随着能量的变化!
引起化学反应中的能量变化:
(1)微观:化学键的断裂和形成是化学反应中能量变化的主要原因;
化学键的断裂——吸收能量;
化学键的形成——放出能量。
反应物 生成物
化学反应=旧化学键断裂+新化学键形成
(吸收总能量E1)(放出总能量E2)
①当E1 > E2 , 反应吸收能量
②当E1 < E2 , 反应放出能量
(2)宏观:在化学反应中,反应物的总能量与生成物的总能量间的能量差。
EA EB
①反应物总能量>生成物总能量 反应放出能量
②反应物总能量<生成物总能量 反应吸收能量
4、化学反应中的能量变化主要表现为热量的变化——吸热或放热。
3、一种能量可以转化为另一种能量,能量是守恒的,这就是能量守恒定律。
现象
结论
溶液温度升高
2Al+6HCl=2AlCl3+3H2↑
放出热量
实验2-1
现象
结论
1、手摸杯底有冷的感觉
Ba(OH)2·8H2O+2NH4Cl=BaCl2+2NH3↑+10H2O
吸热
实验2-2
2、烧杯与玻璃片黏结在一起
盐酸温度℃
NaOH溶液温度℃
中和反应后温度℃
26
26
39
实验2-3
中和热:酸与碱发生中和反应生成1mol水所释放的热量称为中和热。
5、常见的放热反应:
(化学上把放出热量的化学反应叫放热反应)
(1)所有的燃烧反应
(2)酸碱中和反应
(3)大多数的化合反应
(4)金属与酸的反应
(5)缓慢氧化反应
6、常见的吸热反应:
(化学上把吸收热量的化学反应叫吸热反应)
⑴C+CO2=2CO
⑵H2+CuO=H2O+Cu
⑶C+H2O=CO+H2
⑷Ba(OH)2.8H2O+NH4Cl
⑸CaCO3高温分解
⑹大部分分解反应
火力发电中能量是如何转化的呢?
二、化学能与电能
(原)电池
定义:将化学能转变成电能的装置叫做原电池。
失
得
Zn-2e-= Zn2+
2H+ + 2e-=H2↑
负极
正极
Zn+2H+=Zn2++H2↑
有气体产生
Zn片溶解
锌铜原电池原理
负极出电子,电子回正极
电极材料 现象 电子得失 电极反应 原电池的电极
Zn片
Cu片
总的离子反应方程式
原电池反应的本质是: 氧化还原反应。
较活泼金属
较不活泼金属
负 极
正 极
发生氧化反应
发生还原反应
e-
I
电子流出,电流流入
电子流入,电流流出
原电池的电极:
原电池形成条件:
① 两种活泼性不同的金属(或其中一种为能导电的非金属,如“碳棒”)作电极。
其中较活泼金属为负极。较不活泼金属(或非金属)为正极(正极一般不参与电极反应,只起导电作用)。
② 电解质溶液
③ 形成闭合电路
④ 能自发地发生氧化还原反应
两极一液一连线
原电池原理的应用:
①制作化学电源:各种电池
②加快反应速率:
例如:实验室制H2时,由于锌太纯,反应一般较慢,可加入少量CuSO4以加快反应速率。
③判断金属活动性的强弱
④揭示钢铁腐蚀的原因及防止钢铁的腐蚀。
因为钢铁中含有碳,可与Fe组成原电池,发生原电池反应而使钢铁遭到腐蚀。
判断原电池正、负极的方法
*由组成原电池的两极材料判断:
一般是活泼的金属为负极
活泼性较弱的金属或能导电的非金属为正极
*根据电流方向或电子流动方向判断:
电流是由正极流向负极
电子流动方向是由负极流向正极
*根据原电池两极发生的变化来判断:
失电子的反应→氧化反应→负极
得电子的反应→还原反应→正极
1、概念:
浓度常用mol.L-1,时间常用s,min。
3 、单位:
2、数学表达式为:
三、化学反应速率
用单位时间内反应物浓度的减少量或生成物浓度的增加量(均取正值)来表示
mol/(L·min)或mol/(L·s)
4 、ひ是平均速率,不是瞬时速率。
5 、对某一反应而言:
ひ(A)∶ひ(B)∶ひ(C)∶ひ(D) =
m∶n∶p∶q
练习
某一反应物的浓度是1.0mol/L,经过20s后,它的浓度变成了0.2mol/L,在这20s内它的反应速率为( )
解:ひ= (1.0-0.2)mol/L ÷20s = 0.04mol/(L·s)
A. 0.04 B. 0.04mol/(L·s) C. 0.8mol/(L·s) D. 0.04mol/L
B
2.反应 A + 3B = 2C + 2D 在四种不同条件下的反应速率为:
(1)ひ(A)=0.3mol/L·s (2)ひ(B)=0.6mol/L·s (3)ひ(C)=0.4mol/L·s (4)ひ(D)=0.45mol/L·s
则该反应速率的快慢顺序为—————————。
(1)>(4)>(2)=(3)
比较反应的快慢,应取同一参照物
6. 化学反应速率的影响因素:
内因(决定作用):反应物本身的性质
外因(外界条件):浓度、温度、压强、催化剂、固体的表面积、反应物的状态等
①温度:温度升高,化学反应速率加快。
②催化剂:催化剂能改变化学反应速率。
③浓度:在其它条件不变时,增大反应物的浓度,可以增大反应速率。
④压强: 对于有气体参加的化学反应, 增大压强,可以增大反应速率。
⑤固体的表面积:增大固体的接触面积,能增大反应速率。
⑥反应物的状态:液态或气态比固态反应速率快。
1 、可逆反应
正向反应:反应物→生成物
是指在同一条件,正向反应和逆向反应同时进行的反应。
逆向反应:生成物→反应物
四、化学反应的限度—— 化学平衡状态
2、概念:当一个可逆反应进行到正反应速率与逆反应速率相等时,反应物和生成物的浓度不再改变,达到表面上静止的一种“平衡状态”,这就是这个反应所能达到的限度。
化学平衡的标志:
ひ正=ひ逆
反应混合物中各组分的浓度保持不变
3、化学平衡状态的特征:
逆、等、动、定、变。
逆:化学平衡研究的对象是可逆反应。
等:ひ(正)=ひ(逆) (是化学平衡状态的本质)。
动:动态平衡,正、逆反应还在不断进 行,正、逆反应速率相等但不等于零。
定:平衡时,各组分的浓度保持一定 (是化学平衡状态的外观特征)。
变:当影响化学平衡的外界条件改变,平衡会发生移动。
4、任何化学反应的进程都有一定的限度 ,只是不同反应的限度不同。
5、有些反应的可逆性很小,如Ag++Cl- = AgCl ↓,一般可视为不可逆反应。
6、化学反应的限度可以通过改变条件而改变。(化学平衡的移动)
