人教版 选修4 高二化学 3.2水的电离和溶液的酸碱性 上课课件
文档属性
| 名称 | 人教版 选修4 高二化学 3.2水的电离和溶液的酸碱性 上课课件 |

|
|
| 格式 | zip | ||
| 文件大小 | 3.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览










文档简介
(共42张PPT)
水——生命之源
新课导入
水是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。
水分子彼此间的作用是否可能导致水分子也发生电离呢?
第2节 水的电离和溶液的酸碱性
一、水的电离
三、pH的应用
二、溶液的酸碱性和pH
知识目标
教学目标
能力目标
理解影响溶液酸碱性本质因素。
通过分析“精确的导电性实验”的结果这种方式,来说明水的微弱电离,证明水是一种极弱的电解质,并能以此作为后面讨论问题的实验依据。
情感态度与价值观
认识到水不仅是促使酸、碱、盐等电解质发生电离的环境因素,它自身也是一种弱电解质,尽管水的离子积非常微小,但恰恰是它对溶液酸碱性变化起着重要的杠杆作用。
重点
教学重难点
难点
水的离子积,c(H+)、pH与溶液酸碱性的关系。
水的离子积,有关溶液pH的简单计算。
一、水的电离
水的分子结构示意图
在酸(或碱)是水溶液中,除了溶质酸(或碱)外,还有溶剂水。
水是全部以分子形式存在,还是也部分电离成为H+ 和OH- ?
1.1溶剂水
想一想
1.2精确的导电性实验表明:
①水分子能够发生电离;
②水分子发生电离后产生的离子分别是H3O+和OH-;
③发生电离的水分子所占比例很小。
最终的结论:水是一种极弱的电解质,能发生微弱的电离。
水分子电离过程示意图
+
+
-
+
可简写为:
纯水的组成微粒有哪些?
KW = c(H+) . c(OH-) =10-14
c(H+) . c(OH-) = KW × c(H2O)
电离平衡常数:K 电离=
c(H+) ×c(OH-)
c(H2O)
当达到电离平衡时,电离产物H+和OH-浓度之积与未电离的H2O的浓度之比也是一个常数:
因为水的电离极其微弱,因此 c(H2O)可以视为常数,这样上式可以表示为:
常温下,水的离子积常数:
二、溶液的酸碱性和pH
2.1比较下列情况下, c(H+) 和c(OH-) 的值或变化趋势(增加或减少):
纯水 加少量HCl 加少量
Na(OH)
c(H+)
c(OH-)
c(H+) 和c(OH-)
大小比较 c(H+) =c(OH-)
1×10-7
1×10-7
增加
减少
c(H+) >c(OH-)
减少
增加
c(H+) <c(OH-)
2.2酸性溶液中是否OH-存在?碱性溶液中是否有H+存在?是解释原因。
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性溶液
c(H+) = 1×10-7mol/L
c(OH-) = 1×10-7mol/L
碱性溶液
c(H+) <1×10-7mol/L
c(OH-) > 1×10-7mol/L
酸性溶液
c(H+) >1×10-7mol/L
c(OH-) <1×10-7mol/L
2.3 pH
pH是c(H+) 的负对数,即:pH=
c(H+) =1.0×10-7mol/L的中性溶液,
pH=-lg10-7=7.0
例如:
c(H+) =1.0×10-5mol/L的酸性性溶液,
pH=-lg10-5=5.0
c(H+) =1.0×10-9mol/L的碱性性溶液,
pH=-lg10-9=9.0
pH计是一种常用的仪器设备,主要用来精密测量液体介质的酸碱度值,配上相应的离子选择电极也可以测量离子电极电位MV值,广泛应用于工业、农业、科研、环保等领域。
pH计
读一读
取1mL pH=3的H2SO4溶液加水稀释到100mL后,溶液的pH是多少?
答:稀释后溶液的pH为5。
【解】稀释后溶液中
c(H+)=
n(H+)
V[ H2SO4(aq)]
=
10-3mol/×10-3
10-1L
=10-5mol/L
pH=
= -lg10-5=5
练一练
三、pH的应用
应用 1
利用药物调控pH是辅助治疗的重要手段。
人体各种体液都有一定的pH,以保证正常的生理活动。当体内的酸碱平衡失调时,血液的pH是诊断疾病的一个重要参数。
3.1
应用 2
生活中,人们洗发时使用的护发素,主要功能也是调节头发的pH使之达到适宜的酸碱度。
应用 3
在环保领域,酸性或碱性废水的处理常常利用中和反应。
例如:酸性废水可通过投加碱性废渣或通过碱性滤料层过滤使之中和;碱性废水可通过投加酸性废水或利用烟道气中和。
应用 4
在农业生产中,因土壤的pH影响植物对不同形态养分的吸收及养分的有效性,各种作物生长都对土壤的pH范围有一定要求。
应用 5
在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。
3.2 pH值测定方法
酸碱中和滴定
利用中和反应,用已知浓度的算(或碱)来测定未知浓度的碱(或酸)的实验方法。
滴定中的常用仪器
酸碱指示剂一般是有机弱酸或有机弱碱。它们的变色原理是由于其分子和电离出来的离子的结构不同,因此分子和离子的颜色也不同。在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。
指示剂的颜色变化都是在一定的pH范围内发生的,我们把指示剂发生颜色变化的pH范围叫做指示剂的变色范围。各种指示剂的变色范围是由实验测得的。
酸碱指示剂
读一读
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
3.1—4.4
5.0—8.0
8.0—10.0
指示剂的变色范围
变色范围:
甲基橙
石蕊
酚酞
用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下表所示。计算滴定所测NaOH溶液的物质的量浓度。
例 题
实验序号 HCl体积/mL 待测NaOH体积/mL
1 27.84 25.00
2 27.83 25.00
3 27.85 25.00
三次滴定用去HCl溶液体积的平均值为:
27.84mL+27.83mL+27.85mL
3
=27.84mL
反应完全时,参加反应的酸、碱的物质的量有如下比例关系:
HCl + NaOH = NaCl + H2O
1mol
1mol
0.1032mol/L×0.02784L
c(NaOH) ×0.02500L
【解】
c(NaOH) =
c(HCl) ×V(HCl) ×n(NaOH)
V (NaOH) × n(HCl)
=
0.1032mol·L-1 ×0.02784L ×1mol
0.02500L ×1mol
= 0.1149mol/L
答:滴定所测NaOH溶液的物质的量浓度是0.1149mol/L。
实践活动
实验测定酸碱滴定曲线
(1)本实验量取和计量反应过程中酸、碱溶液用量所使用的滴定管,能否用量筒代替?说明为什么。用滴定管有什么优点?
关于“实验预习”中的几个思考题:
不能用量筒代替滴定管,因为计量的精确度不同。在量取液体的体积时,量筒只能读至0.1 mL,而滴定管可读至0.01 mL。用滴定管的优点有:测定值的精确度较高,读数方便,操作简单。
(2)酸式滴定管为什么不能盛装碱性溶液?
在加入反应液时如果不用所要盛装的反应液润洗,就会由于管内壁附着的蒸馏水使反应液稀释,使溶液浓度降低,影响测定结果。
由于碱性溶液会腐蚀玻璃,尤其是容易使酸式滴定管上的玻璃活塞因腐蚀导致无法使用。所以酸式滴定管不能盛装碱性溶液。
(3)滴定管在加入反应液之前为什么要用所要盛装的反应液润洗?
(4)如果滴定管下端尖嘴中气泡存在,对实验结果可能有什么影响?
读取滴定管内液面所在体积数时,应使滴定管与水平的实验台面保持垂直,并使视线与滴定管内液体的凹面最低处相切。
滴定管下端的气泡有可能在滴定过程中被排出,导致该反应液的用量读数值偏高,使实验结果误差偏大。
(5)读取滴定管读数时应注意的问题?
课堂小结
1.水是一种极弱的电解质,能发生微弱的电离。
KW = c(H+) . c(OH-) =10-14
2.常温下,水的离子积常数:
3.pH是c(H+) 的负对数,即:pH=
4.影响KW的因素
KW只与温度有关(与浓度无关):温度升高, KW值增大。
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性溶液
c(H+) = 1×10-7mol/L
c(OH-) = 1×10-7mol/L
碱性溶液
c(H+) <1×10-7mol/L
c(OH-) > 1×10-7mol/L
酸性溶液
c(H+) >1×10-7mol/L
c(OH-) <1×10-7mol/L
课堂练习
1.常温下,10-4mol/L 的盐酸溶液。
溶液中, c(OH-) =________mol/L。
将上述盐酸稀释 10倍,
溶液中 c(H+) =_______ mol/L 、
c(OH-) =_____ mol/L 。
将上述溶液稀释10000倍,
溶液中c(H+) =_________ mol/L 、
c(OH-) =__________ mol/L 。
10-10
10-5
10-9
接近10-7
接近10-7
2.常温下,某溶液中由水电离出的H+和OH-浓度的乘积为1×10-24mol/L,该溶液的[H+] 可能为
______________________ 。
10-12 mol/L 或10-2 mol/L
3.pH相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确是的 ( )
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥
C.②③⑤ D.②③⑤⑥
A
4.某溶液取少量滴在pH试纸上,半分钟后,试纸呈深蓝色,此溶液中不可能大量共存的离子是( )
A. PO43- B. HCO3-
C. Al3+ D. K+
B C
5. 在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸溶液1000L混合,混合后溶液的pH值等于多少?
pH=-lgc(H+)
=-lg[(1×10-1+1000×10-4)/(1+1000)]
=-lg[2×10-4 ]
=4-lg2
=3.7
解:
6.若用0.20mol·L-1的标准盐酸滴定以氢氧化钠溶液,再用此氢氧化钠溶液滴定未知浓度的盐酸,滴定时纪录了以下2组数据:
滴定次数 待测碱(酸)
溶液体积V/mL 标准酸(碱)溶液
滴定前刻度 滴定后刻度 体积/mL
第一次 10.00NaOH 0 10.40
第二次 10.00NaOH 12.20 22.80
第三次 10.00 HCl 0 11.10
第四次 10.00 HCl 11.30 22.20
0.231
0.21
由以上数据算出碱浓度为 mol·L-1,酸溶液浓度为 mol·L-1。
7.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液(酚酞作指示剂)。下列情况会使测定结果偏高的是
①酸式滴定管用水洗后便装盐酸进行滴定;
②碱式滴定管用水洗后便用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流,将碱液溅到锥形瓶壁而又未
摇匀洗下;
⑤盐酸在的滴定时溅出锥形瓶外;
⑥滴加盐酸,颜色不足半分钟即变色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧纪录起始体积时,仰视读数,终点时俯视读数
①③⑤⑦
习题答案
1. ③④①②;②①④③。
2. NH+4,OH-,NH3·H2O,H+。
3. C;
4. A;
5. D;
6. D;
7. A;
8. A、D。
9. 注:不同品牌的同类物品,其相应的pH可能不尽相同。
物品 醋 酱油 酒 洗涤灵 84消毒液 洗发液 洁厕剂 洗衣液 柔软剂
pH 5 6 7 8 12 6 1 8 6
c(H+)/mol·L- 10-5 10-6 10-7 10-8 10-12 10-6 10-1 10-8 10-6
11. 图略。(1) 酸性 (2) 10, 1×10-4 ??(3) 9 mL
10.?
样品号 A B C D E
样品c(H+)
mol/L 6.3×10-5 7.2×10-6 8.5×10-7 5.6×10-8 2.1×10-8
样品PH 4.2 5.1 6.1 7.3 7.7
试种作物 马铃薯、苹果、草莓、烟草 水稻、玉米、大豆、油菜、棉花、洋葱、 小麦、薄荷、草莓 薄荷
改良建议 加适量熟石灰使近中性
水——生命之源
新课导入
水是一种最普通而又具有许多特性的物质,也是应用最广泛的溶剂。
水分子彼此间的作用是否可能导致水分子也发生电离呢?
第2节 水的电离和溶液的酸碱性
一、水的电离
三、pH的应用
二、溶液的酸碱性和pH
知识目标
教学目标
能力目标
理解影响溶液酸碱性本质因素。
通过分析“精确的导电性实验”的结果这种方式,来说明水的微弱电离,证明水是一种极弱的电解质,并能以此作为后面讨论问题的实验依据。
情感态度与价值观
认识到水不仅是促使酸、碱、盐等电解质发生电离的环境因素,它自身也是一种弱电解质,尽管水的离子积非常微小,但恰恰是它对溶液酸碱性变化起着重要的杠杆作用。
重点
教学重难点
难点
水的离子积,c(H+)、pH与溶液酸碱性的关系。
水的离子积,有关溶液pH的简单计算。
一、水的电离
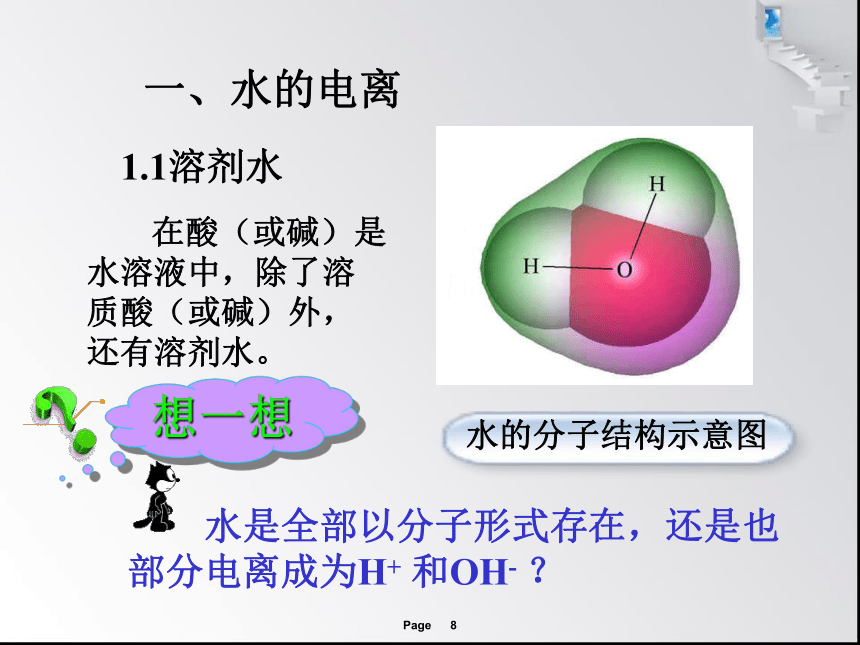
水的分子结构示意图
在酸(或碱)是水溶液中,除了溶质酸(或碱)外,还有溶剂水。
水是全部以分子形式存在,还是也部分电离成为H+ 和OH- ?
1.1溶剂水
想一想
1.2精确的导电性实验表明:
①水分子能够发生电离;
②水分子发生电离后产生的离子分别是H3O+和OH-;
③发生电离的水分子所占比例很小。
最终的结论:水是一种极弱的电解质,能发生微弱的电离。
水分子电离过程示意图
+
+
-
+
可简写为:
纯水的组成微粒有哪些?
KW = c(H+) . c(OH-) =10-14
c(H+) . c(OH-) = KW × c(H2O)
电离平衡常数:K 电离=
c(H+) ×c(OH-)
c(H2O)
当达到电离平衡时,电离产物H+和OH-浓度之积与未电离的H2O的浓度之比也是一个常数:
因为水的电离极其微弱,因此 c(H2O)可以视为常数,这样上式可以表示为:
常温下,水的离子积常数:
二、溶液的酸碱性和pH
2.1比较下列情况下, c(H+) 和c(OH-) 的值或变化趋势(增加或减少):
纯水 加少量HCl 加少量
Na(OH)
c(H+)
c(OH-)
c(H+) 和c(OH-)
大小比较 c(H+) =c(OH-)
1×10-7
1×10-7
增加
减少
c(H+) >c(OH-)
减少
增加
c(H+) <c(OH-)
2.2酸性溶液中是否OH-存在?碱性溶液中是否有H+存在?是解释原因。
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性溶液
c(H+) = 1×10-7mol/L
c(OH-) = 1×10-7mol/L
碱性溶液
c(H+) <1×10-7mol/L
c(OH-) > 1×10-7mol/L
酸性溶液
c(H+) >1×10-7mol/L
c(OH-) <1×10-7mol/L
2.3 pH
pH是c(H+) 的负对数,即:pH=
c(H+) =1.0×10-7mol/L的中性溶液,
pH=-lg10-7=7.0
例如:
c(H+) =1.0×10-5mol/L的酸性性溶液,
pH=-lg10-5=5.0
c(H+) =1.0×10-9mol/L的碱性性溶液,
pH=-lg10-9=9.0
pH计是一种常用的仪器设备,主要用来精密测量液体介质的酸碱度值,配上相应的离子选择电极也可以测量离子电极电位MV值,广泛应用于工业、农业、科研、环保等领域。
pH计
读一读
取1mL pH=3的H2SO4溶液加水稀释到100mL后,溶液的pH是多少?
答:稀释后溶液的pH为5。
【解】稀释后溶液中
c(H+)=
n(H+)
V[ H2SO4(aq)]
=
10-3mol/×10-3
10-1L
=10-5mol/L
pH=
= -lg10-5=5
练一练
三、pH的应用
应用 1
利用药物调控pH是辅助治疗的重要手段。
人体各种体液都有一定的pH,以保证正常的生理活动。当体内的酸碱平衡失调时,血液的pH是诊断疾病的一个重要参数。
3.1
应用 2
生活中,人们洗发时使用的护发素,主要功能也是调节头发的pH使之达到适宜的酸碱度。
应用 3
在环保领域,酸性或碱性废水的处理常常利用中和反应。
例如:酸性废水可通过投加碱性废渣或通过碱性滤料层过滤使之中和;碱性废水可通过投加酸性废水或利用烟道气中和。
应用 4
在农业生产中,因土壤的pH影响植物对不同形态养分的吸收及养分的有效性,各种作物生长都对土壤的pH范围有一定要求。
应用 5
在科学实验和工业生产中,溶液pH的控制常常是影响实验结果或产品质量、产量的一个关键因素。
3.2 pH值测定方法
酸碱中和滴定
利用中和反应,用已知浓度的算(或碱)来测定未知浓度的碱(或酸)的实验方法。
滴定中的常用仪器
酸碱指示剂一般是有机弱酸或有机弱碱。它们的变色原理是由于其分子和电离出来的离子的结构不同,因此分子和离子的颜色也不同。在不同pH的溶液里,由于其分子浓度和离子浓度的比值不同,因此显示出来的颜色也不同。
指示剂的颜色变化都是在一定的pH范围内发生的,我们把指示剂发生颜色变化的pH范围叫做指示剂的变色范围。各种指示剂的变色范围是由实验测得的。
酸碱指示剂
读一读
pH 1 2 3 4 5 6 7 8 9 10 11 12 13 14
甲基橙 红色 橙色 黄色
石蕊 红色 紫色 蓝色
酚酞 无色 浅红色 红色
3.1—4.4
5.0—8.0
8.0—10.0
指示剂的变色范围
变色范围:
甲基橙
石蕊
酚酞
用0.1032mol/LHCl溶液滴定未知浓度的NaOH溶液,重复三次的实验数据如下表所示。计算滴定所测NaOH溶液的物质的量浓度。
例 题
实验序号 HCl体积/mL 待测NaOH体积/mL
1 27.84 25.00
2 27.83 25.00
3 27.85 25.00
三次滴定用去HCl溶液体积的平均值为:
27.84mL+27.83mL+27.85mL
3
=27.84mL
反应完全时,参加反应的酸、碱的物质的量有如下比例关系:
HCl + NaOH = NaCl + H2O
1mol
1mol
0.1032mol/L×0.02784L
c(NaOH) ×0.02500L
【解】
c(NaOH) =
c(HCl) ×V(HCl) ×n(NaOH)
V (NaOH) × n(HCl)
=
0.1032mol·L-1 ×0.02784L ×1mol
0.02500L ×1mol
= 0.1149mol/L
答:滴定所测NaOH溶液的物质的量浓度是0.1149mol/L。
实践活动
实验测定酸碱滴定曲线
(1)本实验量取和计量反应过程中酸、碱溶液用量所使用的滴定管,能否用量筒代替?说明为什么。用滴定管有什么优点?
关于“实验预习”中的几个思考题:
不能用量筒代替滴定管,因为计量的精确度不同。在量取液体的体积时,量筒只能读至0.1 mL,而滴定管可读至0.01 mL。用滴定管的优点有:测定值的精确度较高,读数方便,操作简单。
(2)酸式滴定管为什么不能盛装碱性溶液?
在加入反应液时如果不用所要盛装的反应液润洗,就会由于管内壁附着的蒸馏水使反应液稀释,使溶液浓度降低,影响测定结果。
由于碱性溶液会腐蚀玻璃,尤其是容易使酸式滴定管上的玻璃活塞因腐蚀导致无法使用。所以酸式滴定管不能盛装碱性溶液。
(3)滴定管在加入反应液之前为什么要用所要盛装的反应液润洗?
(4)如果滴定管下端尖嘴中气泡存在,对实验结果可能有什么影响?
读取滴定管内液面所在体积数时,应使滴定管与水平的实验台面保持垂直,并使视线与滴定管内液体的凹面最低处相切。
滴定管下端的气泡有可能在滴定过程中被排出,导致该反应液的用量读数值偏高,使实验结果误差偏大。
(5)读取滴定管读数时应注意的问题?
课堂小结
1.水是一种极弱的电解质,能发生微弱的电离。
KW = c(H+) . c(OH-) =10-14
2.常温下,水的离子积常数:
3.pH是c(H+) 的负对数,即:pH=
4.影响KW的因素
KW只与温度有关(与浓度无关):温度升高, KW值增大。
c(H+) = c(OH-)
c(H+) > c(OH-)
c(H+) < c(OH-)
中性溶液
c(H+) = 1×10-7mol/L
c(OH-) = 1×10-7mol/L
碱性溶液
c(H+) <1×10-7mol/L
c(OH-) > 1×10-7mol/L
酸性溶液
c(H+) >1×10-7mol/L
c(OH-) <1×10-7mol/L
课堂练习
1.常温下,10-4mol/L 的盐酸溶液。
溶液中, c(OH-) =________mol/L。
将上述盐酸稀释 10倍,
溶液中 c(H+) =_______ mol/L 、
c(OH-) =_____ mol/L 。
将上述溶液稀释10000倍,
溶液中c(H+) =_________ mol/L 、
c(OH-) =__________ mol/L 。
10-10
10-5
10-9
接近10-7
接近10-7
2.常温下,某溶液中由水电离出的H+和OH-浓度的乘积为1×10-24mol/L,该溶液的[H+] 可能为
______________________ 。
10-12 mol/L 或10-2 mol/L
3.pH相同的等体积的两份溶液A和B;A为盐酸,B为醋酸,分别和锌反应,若最后仅有一份溶液中存在锌,且放出氢气的质量相同,则下列说法正确是的 ( )
①反应所需要的时间B>A
②开始反应时的速率A>B
③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A
⑤盐酸里有锌剩余
⑥醋酸里有锌剩余
A.③④⑤ B.③④⑥
C.②③⑤ D.②③⑤⑥
A
4.某溶液取少量滴在pH试纸上,半分钟后,试纸呈深蓝色,此溶液中不可能大量共存的离子是( )
A. PO43- B. HCO3-
C. Al3+ D. K+
B C
5. 在25℃时,pH=1的盐酸溶液1L与pH=4的盐酸溶液1000L混合,混合后溶液的pH值等于多少?
pH=-lgc(H+)
=-lg[(1×10-1+1000×10-4)/(1+1000)]
=-lg[2×10-4 ]
=4-lg2
=3.7
解:
6.若用0.20mol·L-1的标准盐酸滴定以氢氧化钠溶液,再用此氢氧化钠溶液滴定未知浓度的盐酸,滴定时纪录了以下2组数据:
滴定次数 待测碱(酸)
溶液体积V/mL 标准酸(碱)溶液
滴定前刻度 滴定后刻度 体积/mL
第一次 10.00NaOH 0 10.40
第二次 10.00NaOH 12.20 22.80
第三次 10.00 HCl 0 11.10
第四次 10.00 HCl 11.30 22.20
0.231
0.21
由以上数据算出碱浓度为 mol·L-1,酸溶液浓度为 mol·L-1。
7.用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液(酚酞作指示剂)。下列情况会使测定结果偏高的是
①酸式滴定管用水洗后便装盐酸进行滴定;
②碱式滴定管用水洗后便用来量取待测液;
③锥形瓶用蒸馏水洗涤后,又用待测液润洗;
④滴定过快成细流,将碱液溅到锥形瓶壁而又未
摇匀洗下;
⑤盐酸在的滴定时溅出锥形瓶外;
⑥滴加盐酸,颜色不足半分钟即变色;
⑦滴定前,酸式滴定管有气泡,滴定后消失;
⑧纪录起始体积时,仰视读数,终点时俯视读数
①③⑤⑦
习题答案
1. ③④①②;②①④③。
2. NH+4,OH-,NH3·H2O,H+。
3. C;
4. A;
5. D;
6. D;
7. A;
8. A、D。
9. 注:不同品牌的同类物品,其相应的pH可能不尽相同。
物品 醋 酱油 酒 洗涤灵 84消毒液 洗发液 洁厕剂 洗衣液 柔软剂
pH 5 6 7 8 12 6 1 8 6
c(H+)/mol·L- 10-5 10-6 10-7 10-8 10-12 10-6 10-1 10-8 10-6
11. 图略。(1) 酸性 (2) 10, 1×10-4 ??(3) 9 mL
10.?
样品号 A B C D E
样品c(H+)
mol/L 6.3×10-5 7.2×10-6 8.5×10-7 5.6×10-8 2.1×10-8
样品PH 4.2 5.1 6.1 7.3 7.7
试种作物 马铃薯、苹果、草莓、烟草 水稻、玉米、大豆、油菜、棉花、洋葱、 小麦、薄荷、草莓 薄荷
改良建议 加适量熟石灰使近中性
