人教版 选修4 高二化学 3.3盐类的水解 上课课件(共44张ppt)
文档属性
| 名称 | 人教版 选修4 高二化学 3.3盐类的水解 上课课件(共44张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览









文档简介
(共44张PPT)
NaCl:在食品工业和渔业用于盐腌,还可用作调味料的原料和精制食盐。
新课导入
C5H8O4NNa:味精是调味料的一种,主要成分为谷氨酸钠。
Na2CO3:块碱、纯碱、苏打(Soda) 、口碱(历史上,一般经张家口和古北口转运全国,因此又有“口碱”之说。)、碱面(食用碱)。
NaHCO3:碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。常利用此特性作为食品制作过程中的膨松剂。
NaCl和C5H8O4NNa主要用于食品调味,而Na2CO3和NaHCO3被视作“碱”用于油污清洗和面食制作。
明明是盐为什么叫“碱”呢?
第3节 盐类的水解
一、探究盐溶液的酸碱性
三、影响盐类水解的主要因素和盐类水解反应的利用
二、盐溶液呈现不同酸碱性的原因
知识目标
教学目标
能力目标
1.理解水解平衡的概念。
2.通过实验并运用归纳法分析盐类的组成与盐溶液酸碱性的对应关系。
分析盐类电离出的阴、阳离子与水电离出的H+和OH-结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因,同时深化对过去所学“离子反应发生的条件”的认识。
情感态度与价值观
1.通过讨论说明影响盐类水解的主要因素,同时了解盐类水解反应的利用。
2.用盐类的水解及水解平衡移动的知识解释如灭火器原理、肥料施用、溶液配制、明矾净水等问题和现象。
重点
教学重难点
难点
盐类水解的本质。
影响水解平衡的因素及水解反应方程式的书写。
一、探究盐溶液的酸碱性
1.选择合适的方法测试下表所列盐溶液(可酌情替换、增加)的酸碱性。
可用什么测试方法?
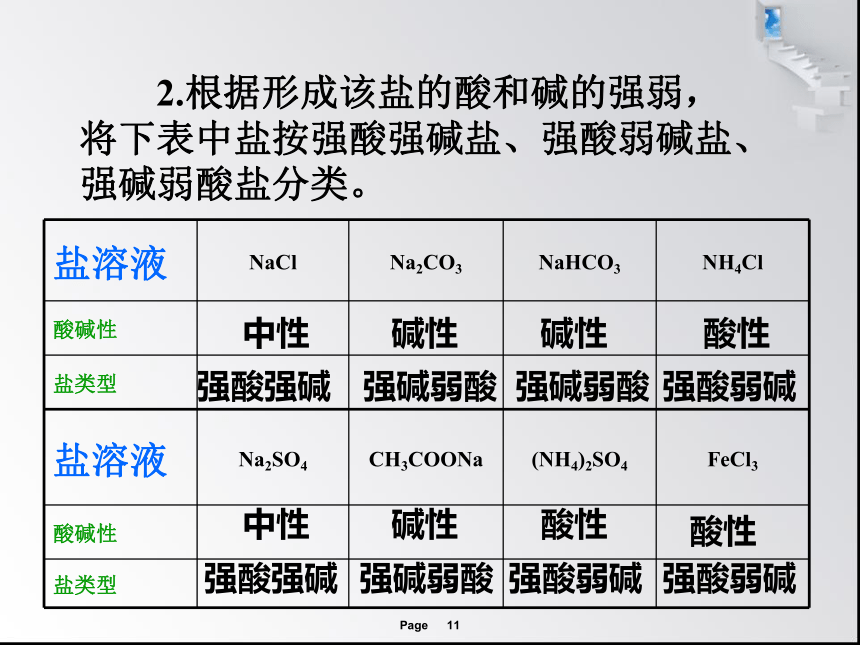
2.根据形成该盐的酸和碱的强弱,将下表中盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类。
盐溶液 NaCl Na2CO3 NaHCO3 NH4Cl
酸碱性
盐类型
盐溶液 Na2SO4 CH3COONa (NH4)2SO4 FeCl3
酸碱性
盐类型
中性
碱性
碱性
酸性
中性
碱性
酸性
酸性
强酸强碱
强碱弱酸
强碱弱酸
强酸弱碱
强酸强碱
强碱弱酸
强酸弱碱
强酸弱碱
3.分析上述实验结果,归纳其与盐的类型间的关系,并从电离平衡的角度寻找原因。
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液的酸碱性
中 性
酸 性
碱 性
①.盐溶液并不都显中性,有的显酸性,有的显碱性。
②.盐溶液的酸碱性与盐的类型有关:“谁强显谁性”,“两强显中性”。
③.酸和碱的相对强度相差越大,则对所形成的盐溶液的酸碱性影响程度越大。
二、盐溶液呈现不同酸碱性的原因
我们知道溶液呈酸、碱性取决于溶液中c(H+) 和c(OH-) 的相对大小,那么是什么原因造成不同类型的盐溶液中c(H+) 或c(OH-)的差异呢?
①盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
②纯水会微弱电离产生H+ 和OH-,但c(H+) =c(OH-) ,显中性;
③盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-)。
是什么原因使得溶液中c(H+) ≠c(OH-)?
盐溶于水并电离都是在水分子的作用下发生的,由此可见,在溶液中的各种离子并非孤立存在,它们在运动过程中相互作用。
1.NaCl溶液
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
c(H+) =c(OH-)
Na+ 、Cl- 、H+ 、OH- 、H2O
无
有关方程式:
2.NH4Cl溶液
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
c(H+) >c(OH-)
NH4+ 、Cl- 、 H+ 、 OH- 、 H2O 、 NH3·H2O
NH3·H2O
有关方程式:
NH4+
+
NH3·H2O
NH4+与OH-结合生成弱电解质NH3·H2O,使H2O的电离平衡向电离的方向移动,溶液中的c(H+) 随之增大,当达到新的平衡时,c(H+) >c(OH-),溶液呈酸性。
总反应:
3.CH3COONa溶液
c(H+)Na+ 、 CH3COO- 、 OH - 、 H+ 、 H2O 、CH3COOH
CH3COOH
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
有关方程式:
总反应:
溶液中c(OH- ) >c(H+) ,溶液呈碱性
4.盐电离产生的离子与水电离产生的H+或OH-生成弱电解质— 弱碱或弱酸的反应叫做盐类的水解。
强酸强碱盐电离出的阴、阳离子都不能与水电离出的H+ 或 OH-生成弱电解质,也就是说强酸强碱盐不跟水反应(即不水解),溶液中c(H+)=c(OH-),显中性。
三、影响盐类水解的主要因素和盐类水解反应的利用
3.1影响盐类水解的主要因素
3.1.1本身性质
盐类水解的实质是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大, 溶液中c(H+)和c(OH-)的差别就越大,即水解程度越大。
A-
+
NA(弱酸)
以生成弱酸为例:
3.1.2反应条件
盐的浓度:
①增大盐的浓度可使平衡向水解方向移动,溶液的酸性(或碱性)增大,盐的水解程度减小;
②盐溶液中加水稀释,也可使平衡向水解方向移动,但溶液酸性(或碱性)减小,盐的水解程度增大。
例:
碳酸钠溶液
加水稀释
水解程度增大
溶液的碱性减小(pH变小)
溶液的酸碱性:
②加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。
例:
溶液的酸碱性可以抑制或促进盐的水解。
①加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
②升温,水解平衡向 反应方向移动。
①盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
吸
正
温度:
②离子反应效应:若向弱电解质溶液中加入能与弱电解质的离子结合的离子,则弱电解质的电离程度将变大。如醋酸溶液中加入氢氧化钠,平衡右移,电离程度增大 。
①同离子效应:弱电解质加到水中,若水中有与弱电解质相同的离子,则弱电解质的电离程度减小,如醋酸溶液中加入醋酸钠晶体,平衡左移,电离程度减小,加入盐酸亦然。
同离子效应和离子反应效应:
3.1盐类水解反应的利用
水解反应的逆反应是中和反应,中和反应是放热反应,因而水解反应是吸热反应。
水解反应
中和反应
吸热
放热
应用 1
用纯碱溶液清洗油污,加热可以增强其去污力。原因在于升温可以促进碳酸钠水解,使溶液中c(OH-)增大。
应用 2
在配制易水解的盐溶液时,如FeCl3水溶液,为了抑制水解可加入少量的盐酸,以防止溶液浑浊。
FeCl3
应用 4
有些盐(碱金属与部分碱土金属除外)在水解时,可生成难溶于水的氢氧化物,当生成的氢氧化物呈胶体状态且无毒时,可用作净水剂,例如铝盐、铁盐。
应用 5
如果溶液溶度较低,可以利用水解反应来获得纳米材料(氢氧化物可变为氧化物)。
纳米材料
如果水解程度很大,还可以用于无机化合物的制备,如用TiCl4制备TiO2的反应可表示如下:
过量
制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2·xH2O经焙烧得TiO2。类似的方法也可用来制备SnO、SnO2、Sn2O3等。
应用 6
课堂小结
1.盐类水解的实质:是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大, 溶液中c(H+)和c(OH-)的差别就越大,即水解程度越大。
2.影响盐类水解的主要因素
本身性质
反应条件
盐的浓度
溶液的酸碱性
温度
3.盐类水解反应的利用
盐类水解也就是酸碱中和反应的逆过程。中和反应是放热反应,因此水解反应是吸热反应。
课堂练习
1.某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(H+) = 2×10-7 mol/L,则此时溶液中的C( OH-) = 。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 。
2×10-7 mol/L
8×10-9mol/L
2.盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
3.下列过程或现象与盐类水解无关的是 ( )
A. 纯碱溶液去油污
B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深
D. 浓硫化钠溶液有臭味
B
吸
4.用0.01mol·L-1H2SO4滴定 0.01mol·L-1NaOH溶液,中和后加水至100mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设1滴为0.05mL)。则①和②c(H+)之比的值为 ( )
A.10 B.50 C.5×103 D.104
D
5.现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+,Ag+,Ca2+,Ba2+,Fe2+,Al3+,阴离子有Cl-,OH-,CH3COO-,NO3-,SO42-,CO32- ,现将它们分别配成的溶液,进行如下实验:
测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加B(NO3)2 溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
(2)E溶液是 ;
(3)写出下列四种化合物的化学式:A 、C 、D 、F 。
碳酸钾
6.回答下列有关问题
(1)醋酸铵水解的离子方程式为:
CH3COO-+NH4++H2O CH3COOH+NH3·H2O
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: 。
Ksp(HgS)7.常温下,某水溶液M中存在的离子有:Na+、A一、H+、OH一。根据题意回答下列问题:
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”)。
小于
>
习题答案
1. D;?2. B;3. C;?4. D。
5. 乙,如果是弱酸,所生成的盐电离出的A-会部分地与水电离出的H+结合成HA,则c(A-)≠c(M+)。
6. >,
Al3++2SO42-+2Ba2++4OH- = 2BaSO4↓+AlO2-+2H2O; 2Al3++3SO42-+3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
7. CO32-+H2O=HCO3-+OH-, Ca2++CO32-=CaCO3↓
(2) AlCl3溶液易发生水解,AlCl3·6 H2O与SOCl2混合加热,SOCl2与AlCl3·6 H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体。
9. (1) SOCl2 +H2O ?SO2↑+ 2HCl↑
8. Na2CO3溶液的pH>NaHCO3溶液的pH,因为由HCO3-电离成CO32-比由H2CO3电离成HCO3-更难,即Na2CO3与NaHCO3是更弱的弱酸盐,所以水解程度会大一些。
10. 加水的效果是增加水解反应的反应物c(SbCl3),加氨水可中和水解反应生成的HCl,以减少生成物c(H+),两项操作的作用都是使化学平衡向水解反应的方向移动。
11. 受热时,MgCl2·6H2O水解反应的生成物HCl逸出反应体系,相当于不断减少可逆反应的生成物,从而可使平衡不断向水解反应方向移动;MgSO4·7H2O没有类似可促进水解反应进行的情况。
NaCl:在食品工业和渔业用于盐腌,还可用作调味料的原料和精制食盐。
新课导入
C5H8O4NNa:味精是调味料的一种,主要成分为谷氨酸钠。
Na2CO3:块碱、纯碱、苏打(Soda) 、口碱(历史上,一般经张家口和古北口转运全国,因此又有“口碱”之说。)、碱面(食用碱)。
NaHCO3:碳酸氢钠是强碱与弱酸中和后生成的酸式盐,溶于水时呈现弱碱性。常利用此特性作为食品制作过程中的膨松剂。
NaCl和C5H8O4NNa主要用于食品调味,而Na2CO3和NaHCO3被视作“碱”用于油污清洗和面食制作。
明明是盐为什么叫“碱”呢?
第3节 盐类的水解
一、探究盐溶液的酸碱性
三、影响盐类水解的主要因素和盐类水解反应的利用
二、盐溶液呈现不同酸碱性的原因
知识目标
教学目标
能力目标
1.理解水解平衡的概念。
2.通过实验并运用归纳法分析盐类的组成与盐溶液酸碱性的对应关系。
分析盐类电离出的阴、阳离子与水电离出的H+和OH-结合成弱酸或弱碱的趋势,明确不同盐溶液呈现不同酸碱性的本质原因,同时深化对过去所学“离子反应发生的条件”的认识。
情感态度与价值观
1.通过讨论说明影响盐类水解的主要因素,同时了解盐类水解反应的利用。
2.用盐类的水解及水解平衡移动的知识解释如灭火器原理、肥料施用、溶液配制、明矾净水等问题和现象。
重点
教学重难点
难点
盐类水解的本质。
影响水解平衡的因素及水解反应方程式的书写。
一、探究盐溶液的酸碱性
1.选择合适的方法测试下表所列盐溶液(可酌情替换、增加)的酸碱性。
可用什么测试方法?
2.根据形成该盐的酸和碱的强弱,将下表中盐按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类。
盐溶液 NaCl Na2CO3 NaHCO3 NH4Cl
酸碱性
盐类型
盐溶液 Na2SO4 CH3COONa (NH4)2SO4 FeCl3
酸碱性
盐类型
中性
碱性
碱性
酸性
中性
碱性
酸性
酸性
强酸强碱
强碱弱酸
强碱弱酸
强酸弱碱
强酸强碱
强碱弱酸
强酸弱碱
强酸弱碱
3.分析上述实验结果,归纳其与盐的类型间的关系,并从电离平衡的角度寻找原因。
盐的类型 强酸强碱盐 强酸弱碱盐 强碱弱酸盐
溶液的酸碱性
中 性
酸 性
碱 性
①.盐溶液并不都显中性,有的显酸性,有的显碱性。
②.盐溶液的酸碱性与盐的类型有关:“谁强显谁性”,“两强显中性”。
③.酸和碱的相对强度相差越大,则对所形成的盐溶液的酸碱性影响程度越大。
二、盐溶液呈现不同酸碱性的原因
我们知道溶液呈酸、碱性取决于溶液中c(H+) 和c(OH-) 的相对大小,那么是什么原因造成不同类型的盐溶液中c(H+) 或c(OH-)的差异呢?
①盐在水中完全电离为离子,但不产生H+和OH-,不能使溶液显酸碱性;
②纯水会微弱电离产生H+ 和OH-,但c(H+) =c(OH-) ,显中性;
③盐溶液显酸(碱)性,说明溶液中c(H+) ≠c(OH-)。
是什么原因使得溶液中c(H+) ≠c(OH-)?
盐溶于水并电离都是在水分子的作用下发生的,由此可见,在溶液中的各种离子并非孤立存在,它们在运动过程中相互作用。
1.NaCl溶液
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
c(H+) =c(OH-)
Na+ 、Cl- 、H+ 、OH- 、H2O
无
有关方程式:
2.NH4Cl溶液
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
c(H+) >c(OH-)
NH4+ 、Cl- 、 H+ 、 OH- 、 H2O 、 NH3·H2O
NH3·H2O
有关方程式:
NH4+
+
NH3·H2O
NH4+与OH-结合生成弱电解质NH3·H2O,使H2O的电离平衡向电离的方向移动,溶液中的c(H+) 随之增大,当达到新的平衡时,c(H+) >c(OH-),溶液呈酸性。
总反应:
3.CH3COONa溶液
c(H+)
CH3COOH
c(H+) 和c(OH-)相对大小:
溶液中的粒子:
有无弱电解质生成:
有关方程式:
总反应:
溶液中c(OH- ) >c(H+) ,溶液呈碱性
4.盐电离产生的离子与水电离产生的H+或OH-生成弱电解质— 弱碱或弱酸的反应叫做盐类的水解。
强酸强碱盐电离出的阴、阳离子都不能与水电离出的H+ 或 OH-生成弱电解质,也就是说强酸强碱盐不跟水反应(即不水解),溶液中c(H+)=c(OH-),显中性。
三、影响盐类水解的主要因素和盐类水解反应的利用
3.1影响盐类水解的主要因素
3.1.1本身性质
盐类水解的实质是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大, 溶液中c(H+)和c(OH-)的差别就越大,即水解程度越大。
A-
+
NA(弱酸)
以生成弱酸为例:
3.1.2反应条件
盐的浓度:
①增大盐的浓度可使平衡向水解方向移动,溶液的酸性(或碱性)增大,盐的水解程度减小;
②盐溶液中加水稀释,也可使平衡向水解方向移动,但溶液酸性(或碱性)减小,盐的水解程度增大。
例:
碳酸钠溶液
加水稀释
水解程度增大
溶液的碱性减小(pH变小)
溶液的酸碱性:
②加碱:增加了OH-浓度,使平衡向逆反应方向移动,即抑制了CH3COONa的水解。
例:
溶液的酸碱性可以抑制或促进盐的水解。
①加酸:H+与OH-反应生成水,降低了生成物浓度,平衡向水解方向移动。即促进了CH3COONa的水解。
②升温,水解平衡向 反应方向移动。
①盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
吸
正
温度:
②离子反应效应:若向弱电解质溶液中加入能与弱电解质的离子结合的离子,则弱电解质的电离程度将变大。如醋酸溶液中加入氢氧化钠,平衡右移,电离程度增大 。
①同离子效应:弱电解质加到水中,若水中有与弱电解质相同的离子,则弱电解质的电离程度减小,如醋酸溶液中加入醋酸钠晶体,平衡左移,电离程度减小,加入盐酸亦然。
同离子效应和离子反应效应:
3.1盐类水解反应的利用
水解反应的逆反应是中和反应,中和反应是放热反应,因而水解反应是吸热反应。
水解反应
中和反应
吸热
放热
应用 1
用纯碱溶液清洗油污,加热可以增强其去污力。原因在于升温可以促进碳酸钠水解,使溶液中c(OH-)增大。
应用 2
在配制易水解的盐溶液时,如FeCl3水溶液,为了抑制水解可加入少量的盐酸,以防止溶液浑浊。
FeCl3
应用 4
有些盐(碱金属与部分碱土金属除外)在水解时,可生成难溶于水的氢氧化物,当生成的氢氧化物呈胶体状态且无毒时,可用作净水剂,例如铝盐、铁盐。
应用 5
如果溶液溶度较低,可以利用水解反应来获得纳米材料(氢氧化物可变为氧化物)。
纳米材料
如果水解程度很大,还可以用于无机化合物的制备,如用TiCl4制备TiO2的反应可表示如下:
过量
制备时加入大量的水,同时加热,促进水解趋于完全,所得TiO2·xH2O经焙烧得TiO2。类似的方法也可用来制备SnO、SnO2、Sn2O3等。
应用 6
课堂小结
1.盐类水解的实质:是盐与水作用生成弱电解质(弱酸或弱碱),生成弱电解质的倾向越大(生成的弱电解质越难电离),对水电离平衡的影响越大, 溶液中c(H+)和c(OH-)的差别就越大,即水解程度越大。
2.影响盐类水解的主要因素
本身性质
反应条件
盐的浓度
溶液的酸碱性
温度
3.盐类水解反应的利用
盐类水解也就是酸碱中和反应的逆过程。中和反应是放热反应,因此水解反应是吸热反应。
课堂练习
1.某温度下纯水中C(H+) = 2×10-7 mol/L,则此时溶液中的C(H+) = 2×10-7 mol/L,则此时溶液中的C( OH-) = 。
若温度不变,滴入稀盐酸使C(H+) = 5×10-6 mol/L,则此时溶液中的C(OH-) = 。
2×10-7 mol/L
8×10-9mol/L
2.盐类水解的逆反应是中和反应,则盐类的水解反应是 热反应。
3.下列过程或现象与盐类水解无关的是 ( )
A. 纯碱溶液去油污
B. 铁在潮湿的环境下生锈
C. 加热氯化铁溶液颜色变深
D. 浓硫化钠溶液有臭味
B
吸
4.用0.01mol·L-1H2SO4滴定 0.01mol·L-1NaOH溶液,中和后加水至100mL。若滴定时终点判断有误差:①多加了一滴H2SO4;②少加了一滴H2SO4(设1滴为0.05mL)。则①和②c(H+)之比的值为 ( )
A.10 B.50 C.5×103 D.104
D
5.现有A、B、C、D、E、F六种化合物,已知它们的阳离子有K+,Ag+,Ca2+,Ba2+,Fe2+,Al3+,阴离子有Cl-,OH-,CH3COO-,NO3-,SO42-,CO32- ,现将它们分别配成的溶液,进行如下实验:
测得溶液A、C、E呈碱性,且碱性为A>E>C;
向B溶液中滴加稀氨水,先出现沉淀,继续滴加氨水,沉淀消失;
向D溶液中滴加B(NO3)2 溶液,无明显现象;
④向F溶液中滴加氨水,生成白色絮状沉淀,沉淀迅速变成灰绿色,最后变成红褐色。
根据上述实验现象,回答下列问题:
(1)实验②中反应的化学方程式是
(2)E溶液是 ;
(3)写出下列四种化合物的化学式:A 、C 、D 、F 。
碳酸钾
6.回答下列有关问题
(1)醋酸铵水解的离子方程式为:
CH3COO-+NH4++H2O CH3COOH+NH3·H2O
(2)污水中含有Hg2+,用难溶的FeS作为沉淀剂可使Hg2+转化为HgS而除去,该反应能进行的依据是: 。
Ksp(HgS)
(1)若溶液M由0.1mo1/L的HA溶液与0.1mol/L的NaOH溶液等体积混合而得,则溶液M的pH不可能 7(填“大于”、“小于”或“等于”)。
(2)若溶液M的pH>7,则c(Na+) c(A一)(填“>”、“<”或“=”)。
小于
>
习题答案
1. D;?2. B;3. C;?4. D。
5. 乙,如果是弱酸,所生成的盐电离出的A-会部分地与水电离出的H+结合成HA,则c(A-)≠c(M+)。
6. >,
Al3++2SO42-+2Ba2++4OH- = 2BaSO4↓+AlO2-+2H2O; 2Al3++3SO42-+3Ba2++6OH- = 3BaSO4↓+2Al(OH)3↓
7. CO32-+H2O=HCO3-+OH-, Ca2++CO32-=CaCO3↓
(2) AlCl3溶液易发生水解,AlCl3·6 H2O与SOCl2混合加热,SOCl2与AlCl3·6 H2O中的结晶水作用,生成无水AlCl3及SO2和HCl气体。
9. (1) SOCl2 +H2O ?SO2↑+ 2HCl↑
8. Na2CO3溶液的pH>NaHCO3溶液的pH,因为由HCO3-电离成CO32-比由H2CO3电离成HCO3-更难,即Na2CO3与NaHCO3是更弱的弱酸盐,所以水解程度会大一些。
10. 加水的效果是增加水解反应的反应物c(SbCl3),加氨水可中和水解反应生成的HCl,以减少生成物c(H+),两项操作的作用都是使化学平衡向水解反应的方向移动。
11. 受热时,MgCl2·6H2O水解反应的生成物HCl逸出反应体系,相当于不断减少可逆反应的生成物,从而可使平衡不断向水解反应方向移动;MgSO4·7H2O没有类似可促进水解反应进行的情况。
