人教版 选修4 高二化学 4.1原电池 上课课件(共43张ppt)
文档属性
| 名称 | 人教版 选修4 高二化学 4.1原电池 上课课件(共43张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览









文档简介
(共43张PPT)
新课导入
“神六”用太阳能电池
化学能转化为电能
第1节 原电池
一、原电池工作原理
三、原电池的重要应用
二、原电池形成的条件
知识目标
教学目标
能力目标
根据氧化还原反应能设计出简单的原电池。
1.能叙述原电池工作原理。
2.正确判断原电池的正负极写出电极反应式。
3.能简述构成原电池的条件。
情感态度与价值观
1.培养实事求是、勇于创新的科学精神。
2.体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感。
重点
教学重难点
难点
进一步了解原电池的工作原理,能够写出电极反应式和电池反应方程式。
原电池的工作原理。
原电池:我们将能把化学能转化为电能的装置叫做原电池。
一、原电池工作原理
探究
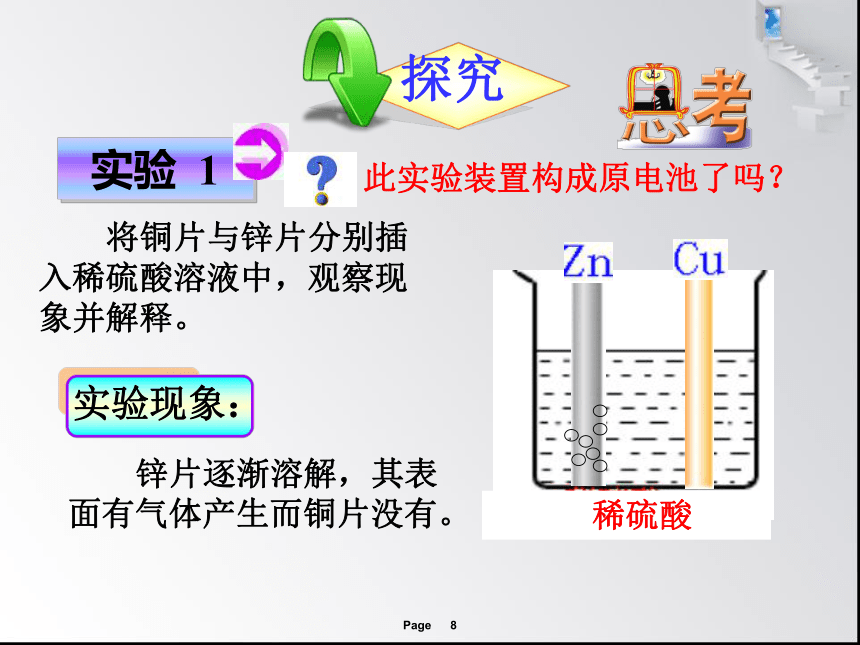
将铜片与锌片分别插入稀硫酸溶液中,观察现象并解释。
锌片逐渐溶解,其表面有气体产生而铜片没有。
稀硫酸
此实验装置构成原电池了吗?
实验 1
实验现象:
将铜片与锌片用导线相连,中间串联一个电流计,观察并解释现象。
实验 2
电流计指针发生偏转,Cu片上有气泡产生,随着时间的延续,指针偏转角度减小,最终无电流通过,同时锌片表面被铜全部覆盖。
发生了原电池反应
实验现象:
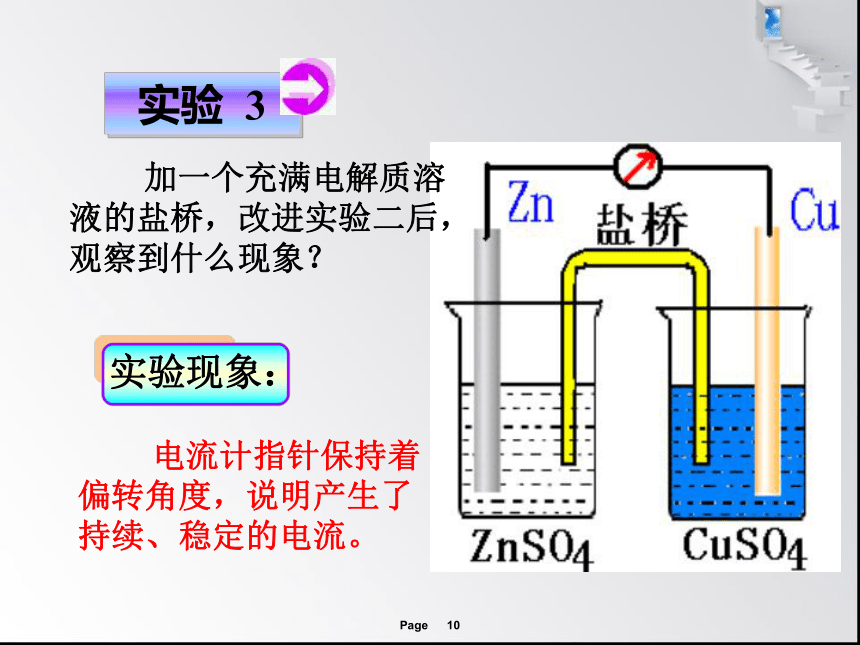
加一个充满电解质溶液的盐桥,改进实验二后,观察到什么现象?
电流计指针保持着偏转角度,说明产生了持续、稳定的电流。
实验 3
实验现象:
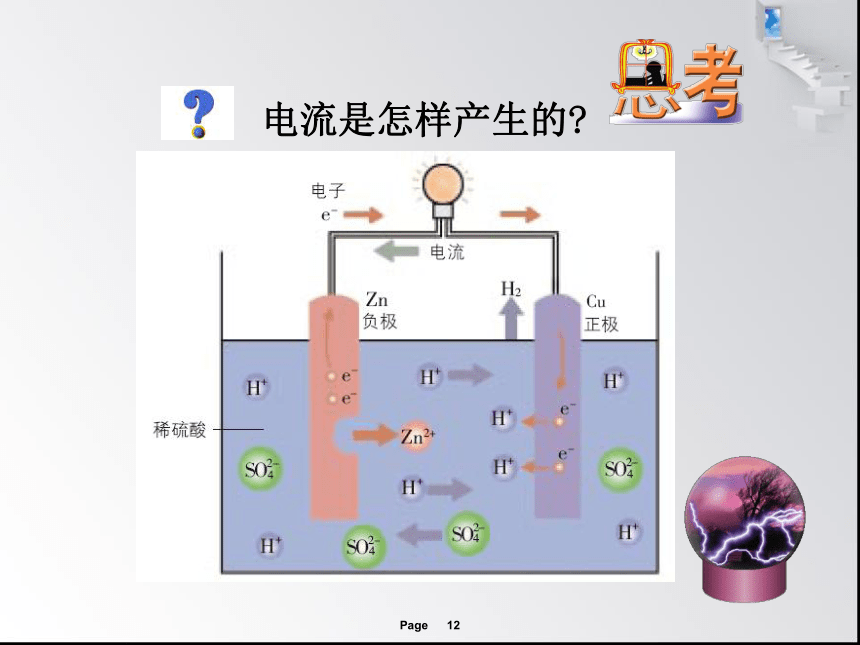
1.电子流动的方向如何?电流流动方向如何?
2.溶液内部阴阳离子如何运动?
电子从金属性较活泼的锌片(负极)流向金属性较不活泼的铜片(正极)。
SO42-往负极运动与Zn2+结合 , H+往正极运动得电子形成H2。
想一想
电流是怎样产生的?
电池两极物质的活性(得失电子能力)不同
两级形成电势差
电子定向移动
发生氧化还原反应
保持电势差
1.电流的形成
2.原电池的工作原理
较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极)。???
电子电流方向:
负极 - 正极 +
电子
电流
氧化反应
还原反应
2.1原电池是由两个半电池组成的;半电池中的反应就是半反应,即电极反应,所以半电池又叫电极(不是电极导体)。
2.2原电池两极的化学反应即半反应,又叫电极反应。
失去电子的一极叫负极,
用 - 表示,发生氧化反应。
锌半电池反应:
总反应式
得到电子的一极叫正极,用+表示,发生还原反应。
铜半电池反应:
综合正极和负极电极反应式而得:
1.请你根据化学反应:
判断右边原电池的正、负极,并写出电极反应式。
A
Cu
C
FeCl3溶液
练一练
负极:
正极:
2.请判断下边原电池的正、负极; 并写出电极反应式。
A
Al
稀硫酸溶液
Mg
-
+
3.关于原电池的电极反应
正极反应:得到电子 (还原反应)
负极反应:失去电子 (氧化反应)
总反应:正极反应+负极反应
如何书写复杂反应的电极反应式?
较繁电极反应式=总反应式-简单电极反应式
原电池中的几个判断
正极负极的判断
正极:活泼的一极 负极:不活泼的一极
(这方法一定正确吗?)
电流方向与电子流向的判断
电流方向:正→负 电子流向:负→正
电解质溶液中离子运动方向的判断
阳离子:向正极区移动 阴离子:向负极区移动
注意
若将此装置中的锌电极换成铁电极,则电流表的指针偏转幅度有何变化?
首先取决于组成原电池的反应物的氧化还原能力;
其次装置设计的合理性以及影响电极反应的条件也是重要因素。
原电池输出电能的能力:
盐桥: 盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液的流出。
锌
铜
硫酸锌溶液
硫酸铜溶液
盐桥
比较盐桥和导线的作用?
导线的作用是:传递电子,沟通外电路。
盐桥的作用是:沟通内电路。可以使由它连接的两溶液保持电中性,盐桥保证了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。
二、原电池形成的条件
①电极材料是两种活动性不同的金属 (或一种是非金属)导体。
②电极材料均插入电解质溶液中。
④能自发的发生氧化还原反应(前提条件)。
①电极材料是两种活动性不同的金属 (或一种是非金属)导体。
②电极材料均插入电解质溶液中。
③电解质溶液中两相连电极形成闭合电路。
A
Zn
Zn
硫酸铜溶液
以下装置不是原电池的请说明原因,是原电池的请写出电极反应。
A
稀硫酸
Zn
C
两极活泼性相同,尽管发生氧化还原反应,但不产生电流。
负极:
正极:
三、原电池的重要应用
1.制作电池 制干电池、蓄电池、高能电池
2.提高化学反应速率 用粗锌代替锌制氢气
3.防止金属被腐蚀 锌铁相连处于电解质中铁受保护
锌锰纽扣电池
“神六”用太阳能电池
原电池的设计
注意
设计中需要关注的问题:
1.氧化还原反应原理
2.电极材料
3.电解质溶液
Zn
比Zn活泼的金属或石墨
CuSO4 、CuCl2等
设计成一个原电池
请将氧化还原反应
负极:
正极:
电解质溶液:
Zn
Cu
硫酸铜溶液
原电池设计结果
1.原电池的工作原理:
2.原电池的几个判断:
3.原电池的构成条件:
4.原电池的设计:
正极、负极、总反应方程式。
正负极;电子、电流、阴阳离子流向。
① ② ③ ④
原理、电极、电解质溶液。
课堂小结
课堂练习
1.某原电池的总反应离子方程式为:
不能实现该反应的原电池组成是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
C D
2.下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 原电池中电子流出的一极是负极,该极被还原
D. 原电池放电时,电流的方向是从负极到正极
B
3.宇宙飞船上使用的氢氧燃料电池,其电池反应为2H2+O2=2H2O,电解质溶液为KOH,反应保持在高温下,使H2O蒸发,正确叙述正确的是:( )
A.H2为正极,O2为负极
B.电极反应(正极):O2+2H2O+4e-=4OH-
C.电极反应(负极):2H2+4OH-=4H2O-4e-
D.负极发生氧化反应,正极发生还原反应
BD
4.熔融盐燃料电池具有高的放电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,已制得在6500C下工作的燃料电池,试完成有关的电极反应式:
负极反应式为:2CO+2CO32--4e-=4CO2
正极反应式为:___________________________
电池总反应式:___________________________
5.请你分析,电池中负极反应、正极反应各有什么特点。
Cu
Fe
H2SO4
Cu
Zn
CuSO4
(-) Fe – 2e- = Fe2+ (+) 2H+ + 2e- = H2↑
(-) Zn – 2e- = Zn2+ (+) Cu2+ + 2e- = Cu
C
Fe
H2SO4
C
Fe
NaCl
(-) Fe – 2e- = Fe2+
(+) 2H+ + 2e- = H2↑
分析: ⑴在Fe-NaCl-C电池中,Fe在负极失去电子。
⑵溶液中有哪些微粒?谁可能在正极得到电子?
生成什么?
6.宇宙飞船上的氢氧燃料电池其电池反应为2H2+O2=2H2O试写出电解质溶液为HCl和KOH的电极反应:
HCl
负极 :
正极:
KOH
负极:
正极:
7.已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:
(1).两次操作过程中指针为什么会发生偏转?
答:_____________________________________________。
这是原电池,指针偏转是由于电子流过电流表
;
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:____________________________________________________________________________________________________________________________。
(B)中加盐酸,AsO43—发生得电子反应,为正极;而当加入NaOH后,AsO33—发生失电子反应,为负极;电流方向相反。
习题答案
1.由化能转化为电能的装置。氧化反应,负;还原反应,正
2.铜, ;银,
3.a、c、d、b
4.B; 5.B、D
6.装置下图所示。
负极:
正极:
Zn
Cu
硫酸锌 硫酸铁
锌铁原电池装置
新课导入
“神六”用太阳能电池
化学能转化为电能
第1节 原电池
一、原电池工作原理
三、原电池的重要应用
二、原电池形成的条件
知识目标
教学目标
能力目标
根据氧化还原反应能设计出简单的原电池。
1.能叙述原电池工作原理。
2.正确判断原电池的正负极写出电极反应式。
3.能简述构成原电池的条件。
情感态度与价值观
1.培养实事求是、勇于创新的科学精神。
2.体验科学探究的艰辛与愉悦,增强为人类的文明进步学习化学的责任感和使命感。
重点
教学重难点
难点
进一步了解原电池的工作原理,能够写出电极反应式和电池反应方程式。
原电池的工作原理。
原电池:我们将能把化学能转化为电能的装置叫做原电池。
一、原电池工作原理
探究
将铜片与锌片分别插入稀硫酸溶液中,观察现象并解释。
锌片逐渐溶解,其表面有气体产生而铜片没有。
稀硫酸
此实验装置构成原电池了吗?
实验 1
实验现象:
将铜片与锌片用导线相连,中间串联一个电流计,观察并解释现象。
实验 2
电流计指针发生偏转,Cu片上有气泡产生,随着时间的延续,指针偏转角度减小,最终无电流通过,同时锌片表面被铜全部覆盖。
发生了原电池反应
实验现象:
加一个充满电解质溶液的盐桥,改进实验二后,观察到什么现象?
电流计指针保持着偏转角度,说明产生了持续、稳定的电流。
实验 3
实验现象:
1.电子流动的方向如何?电流流动方向如何?
2.溶液内部阴阳离子如何运动?
电子从金属性较活泼的锌片(负极)流向金属性较不活泼的铜片(正极)。
SO42-往负极运动与Zn2+结合 , H+往正极运动得电子形成H2。
想一想
电流是怎样产生的?
电池两极物质的活性(得失电子能力)不同
两级形成电势差
电子定向移动
发生氧化还原反应
保持电势差
1.电流的形成
2.原电池的工作原理
较活泼的金属失去电子发生氧化反应,电子从较活泼金属(负极)通过外电路流向较不活泼的金属(正极)。???
电子电流方向:
负极 - 正极 +
电子
电流
氧化反应
还原反应
2.1原电池是由两个半电池组成的;半电池中的反应就是半反应,即电极反应,所以半电池又叫电极(不是电极导体)。
2.2原电池两极的化学反应即半反应,又叫电极反应。
失去电子的一极叫负极,
用 - 表示,发生氧化反应。
锌半电池反应:
总反应式
得到电子的一极叫正极,用+表示,发生还原反应。
铜半电池反应:
综合正极和负极电极反应式而得:
1.请你根据化学反应:
判断右边原电池的正、负极,并写出电极反应式。
A
Cu
C
FeCl3溶液
练一练
负极:
正极:
2.请判断下边原电池的正、负极; 并写出电极反应式。
A
Al
稀硫酸溶液
Mg
-
+
3.关于原电池的电极反应
正极反应:得到电子 (还原反应)
负极反应:失去电子 (氧化反应)
总反应:正极反应+负极反应
如何书写复杂反应的电极反应式?
较繁电极反应式=总反应式-简单电极反应式
原电池中的几个判断
正极负极的判断
正极:活泼的一极 负极:不活泼的一极
(这方法一定正确吗?)
电流方向与电子流向的判断
电流方向:正→负 电子流向:负→正
电解质溶液中离子运动方向的判断
阳离子:向正极区移动 阴离子:向负极区移动
注意
若将此装置中的锌电极换成铁电极,则电流表的指针偏转幅度有何变化?
首先取决于组成原电池的反应物的氧化还原能力;
其次装置设计的合理性以及影响电极反应的条件也是重要因素。
原电池输出电能的能力:
盐桥: 盐桥中装有饱和的KCl溶液和琼脂制成的胶冻,胶冻的作用是防止管中溶液的流出。
锌
铜
硫酸锌溶液
硫酸铜溶液
盐桥
比较盐桥和导线的作用?
导线的作用是:传递电子,沟通外电路。
盐桥的作用是:沟通内电路。可以使由它连接的两溶液保持电中性,盐桥保证了电子通过外电路从锌到铜的不断转移,使锌的溶解和铜的析出过程得以继续进行。
二、原电池形成的条件
①电极材料是两种活动性不同的金属 (或一种是非金属)导体。
②电极材料均插入电解质溶液中。
④能自发的发生氧化还原反应(前提条件)。
①电极材料是两种活动性不同的金属 (或一种是非金属)导体。
②电极材料均插入电解质溶液中。
③电解质溶液中两相连电极形成闭合电路。
A
Zn
Zn
硫酸铜溶液
以下装置不是原电池的请说明原因,是原电池的请写出电极反应。
A
稀硫酸
Zn
C
两极活泼性相同,尽管发生氧化还原反应,但不产生电流。
负极:
正极:
三、原电池的重要应用
1.制作电池 制干电池、蓄电池、高能电池
2.提高化学反应速率 用粗锌代替锌制氢气
3.防止金属被腐蚀 锌铁相连处于电解质中铁受保护
锌锰纽扣电池
“神六”用太阳能电池
原电池的设计
注意
设计中需要关注的问题:
1.氧化还原反应原理
2.电极材料
3.电解质溶液
Zn
比Zn活泼的金属或石墨
CuSO4 、CuCl2等
设计成一个原电池
请将氧化还原反应
负极:
正极:
电解质溶液:
Zn
Cu
硫酸铜溶液
原电池设计结果
1.原电池的工作原理:
2.原电池的几个判断:
3.原电池的构成条件:
4.原电池的设计:
正极、负极、总反应方程式。
正负极;电子、电流、阴阳离子流向。
① ② ③ ④
原理、电极、电解质溶液。
课堂小结
课堂练习
1.某原电池的总反应离子方程式为:
不能实现该反应的原电池组成是( )
A.正极为铜,负极为铁,电解质溶液为FeCl3溶液
B.正极为碳,负极为铁,电解质溶液为Fe(NO3)3溶液
C.正极为铁,负极为锌,电解质溶液为Fe2(SO4)3溶液
D.正极为银,负极为铁,电解质溶液为CuSO4溶液
C D
2.下列关于原电池的叙述正确的是( )
A. 构成原电池的正极和负极必须是两种不同的金属
B. 原电池是将化学能转变为电能的装置
C. 原电池中电子流出的一极是负极,该极被还原
D. 原电池放电时,电流的方向是从负极到正极
B
3.宇宙飞船上使用的氢氧燃料电池,其电池反应为2H2+O2=2H2O,电解质溶液为KOH,反应保持在高温下,使H2O蒸发,正确叙述正确的是:( )
A.H2为正极,O2为负极
B.电极反应(正极):O2+2H2O+4e-=4OH-
C.电极反应(负极):2H2+4OH-=4H2O-4e-
D.负极发生氧化反应,正极发生还原反应
BD
4.熔融盐燃料电池具有高的放电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,已制得在6500C下工作的燃料电池,试完成有关的电极反应式:
负极反应式为:2CO+2CO32--4e-=4CO2
正极反应式为:___________________________
电池总反应式:___________________________
5.请你分析,电池中负极反应、正极反应各有什么特点。
Cu
Fe
H2SO4
Cu
Zn
CuSO4
(-) Fe – 2e- = Fe2+ (+) 2H+ + 2e- = H2↑
(-) Zn – 2e- = Zn2+ (+) Cu2+ + 2e- = Cu
C
Fe
H2SO4
C
Fe
NaCl
(-) Fe – 2e- = Fe2+
(+) 2H+ + 2e- = H2↑
分析: ⑴在Fe-NaCl-C电池中,Fe在负极失去电子。
⑵溶液中有哪些微粒?谁可能在正极得到电子?
生成什么?
6.宇宙飞船上的氢氧燃料电池其电池反应为2H2+O2=2H2O试写出电解质溶液为HCl和KOH的电极反应:
HCl
负极 :
正极:
KOH
负极:
正极:
7.已知反应AsO43-+2I-+2H+ AsO33-+I2+H2O是可逆反应.设计如图装置,进行下述操作:
(Ⅰ)向(B)烧杯中逐滴加入浓盐酸,发现微安培表指针偏转;
(Ⅱ)若改往(B)烧杯中滴加40%NaOH溶液,发现微安培表指针向前述相反方向偏转.试回答:
(1).两次操作过程中指针为什么会发生偏转?
答:_____________________________________________。
这是原电池,指针偏转是由于电子流过电流表
;
(2)两次操作过程中指针偏转方向为什么会相反?试用平衡移动原理解释此现象.
答:____________________________________________________________________________________________________________________________。
(B)中加盐酸,AsO43—发生得电子反应,为正极;而当加入NaOH后,AsO33—发生失电子反应,为负极;电流方向相反。
习题答案
1.由化能转化为电能的装置。氧化反应,负;还原反应,正
2.铜, ;银,
3.a、c、d、b
4.B; 5.B、D
6.装置下图所示。
负极:
正极:
Zn
Cu
硫酸锌 硫酸铁
锌铁原电池装置
