人教版 选修4 高二化学 4.3电解池 上课课件(共42张ppt)
文档属性
| 名称 | 人教版 选修4 高二化学 4.3电解池 上课课件(共42张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览







文档简介
(共42张PPT)
新课导入
电解池和石英管相关产品图
高纯氮气发生器AYN-300型
微机硫氮分析仪
第3节 电解池
一、电解原理
二、电解原理的应用
1.解释电解的原理,并能准确判断电解池阴、阳极。
2.正确判断两极发生的是氧化反应,还是还原反应,并能正确书写两极所发生的反应及电解的总化学方程式。
3.能说出惰性材料做电极时,离子的放电顺序。
知识目标
教学目标
1.树立理论联系实际的学风。
可以自行设计简单的电解池反应实验。
2.培养求实的精神及团结合作精神。
情感态度与价值观
能力目标
电解原理及其应用。
电解原理。
重点
教学重难点
难点
一、电解原理
探究
材料及器材:CuCl2溶液 (稀溶液)、 U形管、直流电源、电流表、湿润的碘化钾淀粉试纸、两根碳棒、导线若干。
实验 1
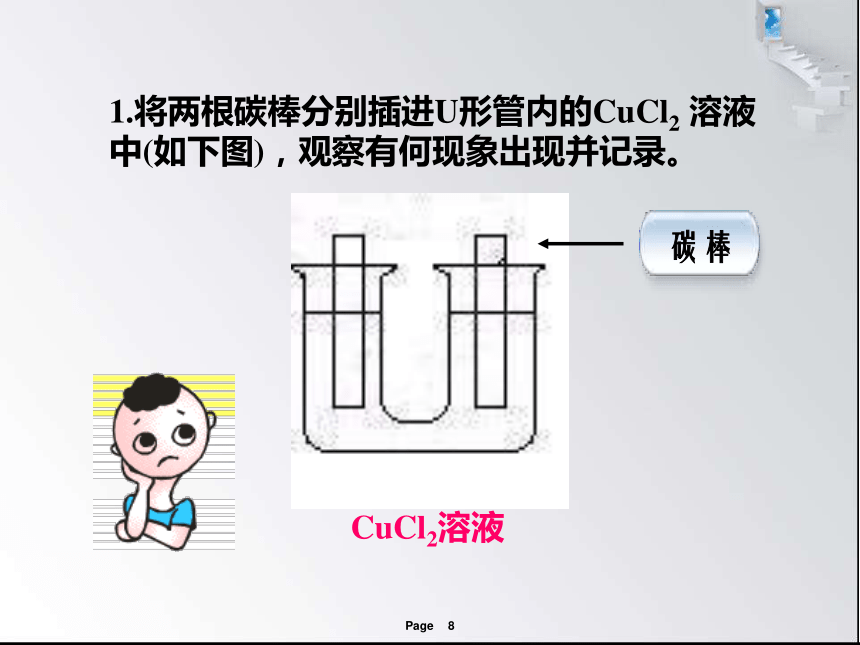
1.将两根碳棒分别插进U形管内的CuCl2 溶液中(如下图),观察有何现象出现并记录。
CuCl2溶液
碳棒
2.将两根碳棒用导线连接后,进入U形管人的CuCl2溶液中(如下图),观察现象并记录。
CuCl2溶液
碳棒用导线连接
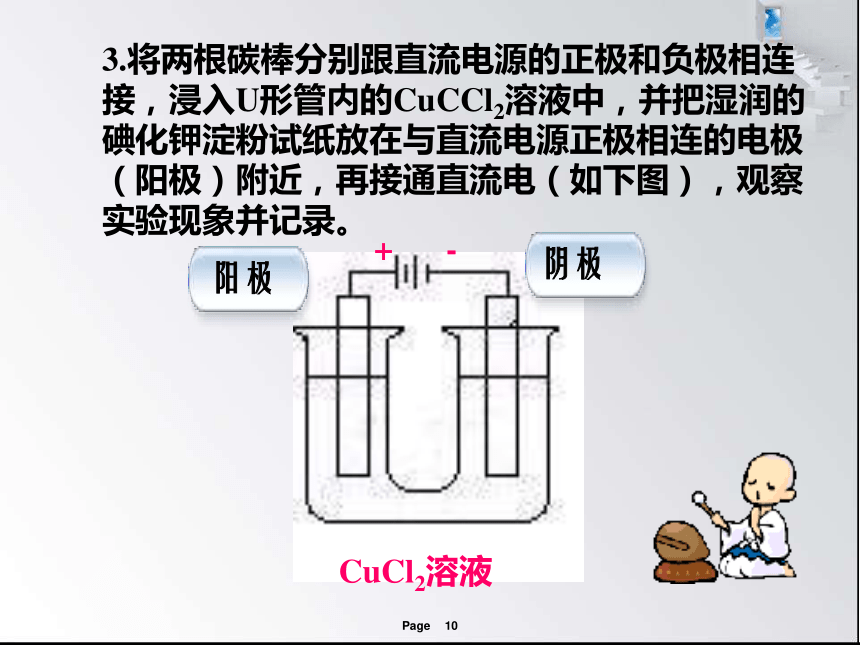
3.将两根碳棒分别跟直流电源的正极和负极相连接,浸入U形管内的CuCCl2溶液中,并把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近,再接通直流电(如下图),观察实验现象并记录。
CuCl2溶液
阳极
阴极
+
-
实验现象:
前两个实验碳棒上没有明显变化,第三个实验通电一会儿发现,与电源负极相连的一端的碳棒上有红色固体物质析出,与电源正极相连的一端碳棒上有使湿润的碘化钾淀粉试纸变蓝的气体生成。
实验结论:
阴极产物——Cu
阳极产物——Cl2
红色物质为 Cu,是湿润的碘化钾淀粉试纸变蓝的气体是Cl2。
为什么会有这样的结果?
通电前,CuCl2电离 ,
在溶液中自由运动(如图四)。通电时,在电极的作用下,这些自由运动得离子由做自由运动变为做定向运动(如图五),即阴离子趋向阳极运动,阳离子趋向阴极运动。
阳极:
阴离子失电子,发生氧化反应。
阴极:
阳离子得电子,发生换元反应。
电解:这种使电流通过电解质溶液而在阴、阳两极发生氧化还原反应的过程叫做电解。
Cu2+
Cl-
Cl-
Cl-
Cu2+
电解池或电解槽:上述借助于电流引起氧化还原反应的装置,即把电能转换为化学能的装置,叫做电解池或电解槽。
Cu2+
Cu2+
Cu2+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
在电解池中与直流电源负极相连的是阴极,与正极相连的是阳极。电子的方向与电流的方向相反,通电时,电子从直流电源的负极流向电解池得阴极,经过阴、阳离子的定向运动形成的内电路,再从电解池得阳极流向直流电源的正极。由此可间,电解质溶液的导电过程就是电解质溶液的电解过称。
电解CuCl2溶液得总化学反应方程式:
电解
在 CuCl2溶液中有四种离子:Cu2+、Cl-、H+、OH-,为什么只有Cu2+、Cl-在阴、阳两极上得失电子,而H+、OH-却不能在阴、阳两极上得失电子呢?
电解质溶液中各离子得失电子是有一定顺序的,我们称之为放电顺序。
阳离子放电顺序:按金属活性顺序越不活泼的金属,越容易获得电子。
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子,若金属单质做阳极,则金属单质(除Pt、Av、Ti)将优先于阴离子在阳极放电。
因此,在本实验中Cu2+、Cl-能得失电子,而H+、OH-不能得失电子。
即,Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+ 。
实例 原电池 电解池
原理
形成条件
注意
原电池和电解池的比较
锌铜原电池
电解氯化铜
发生氧化还原反应,形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
装置 原电池 电解池
电极名称
电子流向
由电极本身决定
正极:流入电子
负极:流出电
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源正极→阳极→阴极→电源负极
装置 原电池 电解池
电流方向
电极反应
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn-2e-=Zn2+(氧化反应)
正极:2H+ +2e- =H2↑(还原原应)
阳极:2 CI--2e- = CI2↑(氧化反应)
阴极: Cu2+ +2e- = Cu (还原反应)
装置 原电池 电解池
能连转换
应用
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
二、电解原理的应用
1.电极饱和食盐水制烧碱、氯气和氢气
习惯上我们把电解饱和食盐水的工业生产叫做氯碱工业。烧碱、氯气是重要的化工原料。
电解饱和食盐水的原理和电解CuCl2溶液相同。在饱和食盐水中存在四种离子,即Na+、Cl-、H+、OH-,因为有阴、阳离子放电顺序可知Cl-比OH-容易失电子,H+比Na+容易的电子,所以通电时:
阳极:2Cl-2e-=Cl2 氧化反应
阴极:2H++2e-=H2 还原反应
电解饱和食盐水的总反应为:
工业生产时,这个反应在电解槽中进行。
电解
2.电镀
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。其主要目的是使金属增强抗腐蚀能力,增加美观和表面硬度。镀层金属一般是一些在空气或溶液里不易其变化的金属(如镍、银)和合金(如黄铜)。
电镀时,通常把待镀金属作为阴极,把镀层金属作为阳极,用含有镀层金属离子的溶液做电镀。在直流电的作用下,待镀金属表面就覆盖上一层致密而均匀得镀层。
电镀方法也可以应用在铜的精炼上。
电镀制品
3.电冶金
Mn++ne-=M
电解是最强有力的氧化还原手段,因此电解法是冶炼金属的一种重要的方法。且对于冶炼像钠、钙、镁、铝这样的活泼金属,电解法几乎是唯一可行的工业方法。
金属冶炼就是使矿石中得金属离子获得电子,从他们的化合物中还原出来。
阳极:
2Cl - -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) = 2Na + Cl2 ↑
例如,电解熔融氯化钠可以得到钠,NaCl在高温下熔融,并发生电离:
NaCl=Na++Cl-
通直流电后:
通电
电解熔融氯化钠制钠
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1.电源、电极、电极反应关系
课堂小结
2.电解原理的应用:氯碱工业、电镀、电冶金。
3.比较原电池和电解池的不同和相同点。
1.使 通过 而在阴、阳两极发 的过程叫做电解。
电流
电解质溶液
2.在电解池中,阳极离子 ,发生 反应;阴极离子 ,发 反应。
失电子
氧化
得电子
还原
氧化还原反应
课堂练习
3. 下列描述中,不符合生产实际的是 ( )
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
A
4. 右图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关的判断正确的是( )
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
C
5. 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是 。
(2)甲装置中电解反应的总化学方程式是 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该
是 (填“铜”或“银”),电镀液的主要成分 是 (填化学式)。
(5)装置丁中的现象是 。
正极
2CuSO4+2H2O=2Cu+O2↑+2H2SO4
1:1
银
AgNO3
Y极附近红褐色变深
电解
6. 从H+、Na+、Cu2+、Cl-、SO42-五种离子中组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则可采用的电解质是______________;
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则可采用的电解质是 ____________________________ ;
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量都减少,进行电解,则可采用的电解质是___________________。
HCl 、CuCl2
H2SO4 、NaHSO4、 Na2SO4
NaCl 、 CuSO4
7.用石墨做电极,电解下列溶液,写出电解反应的化学方程式,并分析反应现象。
(1)AgNO3溶液 (2)NaOH溶液
(1)4AgNO3+2H2O = 4Ag+O2 +4HNO3
(2)2H2O = 2H2 +O2
电解
电解
1.A;2.D
3.原电池是把化学能转变为电能的装置,电解池是把电能转变为化学能的装置。例如锌铜原电池,在锌电极上发生氧化反应,称为负极,在铜电极上发生还原反应,称为正极。
负极:Zn-2e-=Zn2+ (氧化反应)
正极:Cu2++2e-=Cu (还原反应)
习题答案
电解池:以氯化铜溶液的电解装置为例。与电源正极相连的是阳极,与电源负极相连的是阴极。
阳极:2Cl--2e-=Cl2 (氧化反应)
阴极:Cu2++2e-=Cu (还原反应)
电子通过外电路由阳极流向阴极。
4.电镀待镀金属作阴极,镀层金属作阳极,电解精炼铜是把纯铜板作阴极,粗铜板作阳极,通过类似电镀的方法把铜电镀到纯铜板上去,而粗铜中的杂质留在阳极泥或电解液中,从而达到精炼铜的目的。其电极主要反应如下:
阳极(粗铜): 2Cl--2e-=Cl2 (氧化反应)
阴极(纯铜): Cu2++2e-=Cu (氧化反应)
5. 电解饱和食盐水的电极反应式为:
阳极:2Cl--2e- =Cl2↑(氧化反应)
阴极:2H++2e- =H2↑(还原反应)
或阴极:2H2O+2e- =H2↑+2OH-(还原反应)
总反应:2NaCl+2H2O =2NaOH+H2↑+Cl2↑
在阴极析出1. 42 L H2,同时在阳极也析出1.42 L Cl2。
6. 依题意,电解XCl2溶液时发生了如下变化:
? ????????????????????????????????????????????????????????
??????????????
M(X)=3.2 g×22.4 L/(1 mol×1.12 L)=64 g/mol
即X的相对原子质量为64。
又因为2Cl- - 2e- = Cl2↑
??????????????2 mol????? 22.4L
????????????? n(e-)????? 1.12L
n(e-)=2 mol×1.12 L/22.4 L=0.1 mol
即电路中通过的电子有0.1 mol。
XCl2 = X + Cl2 ↑
M(X)·1mol
3.2g
22.4L
1.12L
通电
新课导入
电解池和石英管相关产品图
高纯氮气发生器AYN-300型
微机硫氮分析仪
第3节 电解池
一、电解原理
二、电解原理的应用
1.解释电解的原理,并能准确判断电解池阴、阳极。
2.正确判断两极发生的是氧化反应,还是还原反应,并能正确书写两极所发生的反应及电解的总化学方程式。
3.能说出惰性材料做电极时,离子的放电顺序。
知识目标
教学目标
1.树立理论联系实际的学风。
可以自行设计简单的电解池反应实验。
2.培养求实的精神及团结合作精神。
情感态度与价值观
能力目标
电解原理及其应用。
电解原理。
重点
教学重难点
难点
一、电解原理
探究
材料及器材:CuCl2溶液 (稀溶液)、 U形管、直流电源、电流表、湿润的碘化钾淀粉试纸、两根碳棒、导线若干。
实验 1
1.将两根碳棒分别插进U形管内的CuCl2 溶液中(如下图),观察有何现象出现并记录。
CuCl2溶液
碳棒
2.将两根碳棒用导线连接后,进入U形管人的CuCl2溶液中(如下图),观察现象并记录。
CuCl2溶液
碳棒用导线连接
3.将两根碳棒分别跟直流电源的正极和负极相连接,浸入U形管内的CuCCl2溶液中,并把湿润的碘化钾淀粉试纸放在与直流电源正极相连的电极(阳极)附近,再接通直流电(如下图),观察实验现象并记录。
CuCl2溶液
阳极
阴极
+
-
实验现象:
前两个实验碳棒上没有明显变化,第三个实验通电一会儿发现,与电源负极相连的一端的碳棒上有红色固体物质析出,与电源正极相连的一端碳棒上有使湿润的碘化钾淀粉试纸变蓝的气体生成。
实验结论:
阴极产物——Cu
阳极产物——Cl2
红色物质为 Cu,是湿润的碘化钾淀粉试纸变蓝的气体是Cl2。
为什么会有这样的结果?
通电前,CuCl2电离 ,
在溶液中自由运动(如图四)。通电时,在电极的作用下,这些自由运动得离子由做自由运动变为做定向运动(如图五),即阴离子趋向阳极运动,阳离子趋向阴极运动。
阳极:
阴离子失电子,发生氧化反应。
阴极:
阳离子得电子,发生换元反应。
电解:这种使电流通过电解质溶液而在阴、阳两极发生氧化还原反应的过程叫做电解。
Cu2+
Cl-
Cl-
Cl-
Cu2+
电解池或电解槽:上述借助于电流引起氧化还原反应的装置,即把电能转换为化学能的装置,叫做电解池或电解槽。
Cu2+
Cu2+
Cu2+
Cl-
Cl-
Cl-
Cl-
Cl-
Cl-
在电解池中与直流电源负极相连的是阴极,与正极相连的是阳极。电子的方向与电流的方向相反,通电时,电子从直流电源的负极流向电解池得阴极,经过阴、阳离子的定向运动形成的内电路,再从电解池得阳极流向直流电源的正极。由此可间,电解质溶液的导电过程就是电解质溶液的电解过称。
电解CuCl2溶液得总化学反应方程式:
电解
在 CuCl2溶液中有四种离子:Cu2+、Cl-、H+、OH-,为什么只有Cu2+、Cl-在阴、阳两极上得失电子,而H+、OH-却不能在阴、阳两极上得失电子呢?
电解质溶液中各离子得失电子是有一定顺序的,我们称之为放电顺序。
阳离子放电顺序:按金属活性顺序越不活泼的金属,越容易获得电子。
阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根离子,若金属单质做阳极,则金属单质(除Pt、Av、Ti)将优先于阴离子在阳极放电。
因此,在本实验中Cu2+、Cl-能得失电子,而H+、OH-不能得失电子。
即,Ag+>Hg2+>Cu2+>Fe2+>Zn2+>H+>Al3+>Na+>K+ 。
实例 原电池 电解池
原理
形成条件
注意
原电池和电解池的比较
锌铜原电池
电解氯化铜
发生氧化还原反应,形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
装置 原电池 电解池
电极名称
电子流向
由电极本身决定
正极:流入电子
负极:流出电
由外电源决定
阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源正极→阳极→阴极→电源负极
装置 原电池 电解池
电流方向
电极反应
(外电路)正极→负极
电源正极→阳极→阴极→电源负极
负极:Zn-2e-=Zn2+(氧化反应)
正极:2H+ +2e- =H2↑(还原原应)
阳极:2 CI--2e- = CI2↑(氧化反应)
阴极: Cu2+ +2e- = Cu (还原反应)
装置 原电池 电解池
能连转换
应用
化学能→ 电能
电能→化学能
设计电池、金属防腐
氯碱工业、电镀、电冶、金属精炼
二、电解原理的应用
1.电极饱和食盐水制烧碱、氯气和氢气
习惯上我们把电解饱和食盐水的工业生产叫做氯碱工业。烧碱、氯气是重要的化工原料。
电解饱和食盐水的原理和电解CuCl2溶液相同。在饱和食盐水中存在四种离子,即Na+、Cl-、H+、OH-,因为有阴、阳离子放电顺序可知Cl-比OH-容易失电子,H+比Na+容易的电子,所以通电时:
阳极:2Cl-2e-=Cl2 氧化反应
阴极:2H++2e-=H2 还原反应
电解饱和食盐水的总反应为:
工业生产时,这个反应在电解槽中进行。
电解
2.电镀
电镀是应用电解原理在某些金属表面镀上一薄层其他金属或合金的方法。其主要目的是使金属增强抗腐蚀能力,增加美观和表面硬度。镀层金属一般是一些在空气或溶液里不易其变化的金属(如镍、银)和合金(如黄铜)。
电镀时,通常把待镀金属作为阴极,把镀层金属作为阳极,用含有镀层金属离子的溶液做电镀。在直流电的作用下,待镀金属表面就覆盖上一层致密而均匀得镀层。
电镀方法也可以应用在铜的精炼上。
电镀制品
3.电冶金
Mn++ne-=M
电解是最强有力的氧化还原手段,因此电解法是冶炼金属的一种重要的方法。且对于冶炼像钠、钙、镁、铝这样的活泼金属,电解法几乎是唯一可行的工业方法。
金属冶炼就是使矿石中得金属离子获得电子,从他们的化合物中还原出来。
阳极:
2Cl - -2e- = Cl2↑
阴极:
2Na+ + 2e- = 2Na
总反应:
2NaCl(熔融) = 2Na + Cl2 ↑
例如,电解熔融氯化钠可以得到钠,NaCl在高温下熔融,并发生电离:
NaCl=Na++Cl-
通直流电后:
通电
电解熔融氯化钠制钠
与电源正极相连
阳极
阴极
与电源负极相连
发生氧化反应
阳离子移向
阴离子移向
发生还原反应
1.电源、电极、电极反应关系
课堂小结
2.电解原理的应用:氯碱工业、电镀、电冶金。
3.比较原电池和电解池的不同和相同点。
1.使 通过 而在阴、阳两极发 的过程叫做电解。
电流
电解质溶液
2.在电解池中,阳极离子 ,发生 反应;阴极离子 ,发 反应。
失电子
氧化
得电子
还原
氧化还原反应
课堂练习
3. 下列描述中,不符合生产实际的是 ( )
A. 电解熔融的氧化铝制取金属铝,用铁作阳极
B. 电解法精炼粗铜,用纯铜作阴极
C. 电解饱和食盐水制烧碱,用涂镍碳钢网作阴极
D. 在镀件上电镀锌,用锌作阳极
A
4. 右图是电解CuCl2溶液的装置,其中c、d为石墨电极,则下列有关的判断正确的是( )
A. a为负极,b为正极
B. a为阳极,b为阴极
C. 电解过程中,d电极质量增加
D. 电解过程中,氯离子浓度不变
C
5. 课题式研究性学习是培养学生创造思维的良好方法,某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y 都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:
(1)电源A 极的名称是 。
(2)甲装置中电解反应的总化学方程式是 。
(3)如果收集乙装置中产生的气体,两种气体的体积比是 。
(4)欲用丙装置给铜镀银,G应该
是 (填“铜”或“银”),电镀液的主要成分 是 (填化学式)。
(5)装置丁中的现象是 。
正极
2CuSO4+2H2O=2Cu+O2↑+2H2SO4
1:1
银
AgNO3
Y极附近红褐色变深
电解
6. 从H+、Na+、Cu2+、Cl-、SO42-五种离子中组成电解质,按下列要求进行电解:
(1)以碳棒为电极,使电解质质量减少,水量不变进行电解,则可采用的电解质是______________;
(2)以铂片为电极,使电解质质量不变,水量减少进行电解,则可采用的电解质是 ____________________________ ;
(3)以碳棒为阳极,铁棒为阴极,使电解质和水量都减少,进行电解,则可采用的电解质是___________________。
HCl 、CuCl2
H2SO4 、NaHSO4、 Na2SO4
NaCl 、 CuSO4
7.用石墨做电极,电解下列溶液,写出电解反应的化学方程式,并分析反应现象。
(1)AgNO3溶液 (2)NaOH溶液
(1)4AgNO3+2H2O = 4Ag+O2 +4HNO3
(2)2H2O = 2H2 +O2
电解
电解
1.A;2.D
3.原电池是把化学能转变为电能的装置,电解池是把电能转变为化学能的装置。例如锌铜原电池,在锌电极上发生氧化反应,称为负极,在铜电极上发生还原反应,称为正极。
负极:Zn-2e-=Zn2+ (氧化反应)
正极:Cu2++2e-=Cu (还原反应)
习题答案
电解池:以氯化铜溶液的电解装置为例。与电源正极相连的是阳极,与电源负极相连的是阴极。
阳极:2Cl--2e-=Cl2 (氧化反应)
阴极:Cu2++2e-=Cu (还原反应)
电子通过外电路由阳极流向阴极。
4.电镀待镀金属作阴极,镀层金属作阳极,电解精炼铜是把纯铜板作阴极,粗铜板作阳极,通过类似电镀的方法把铜电镀到纯铜板上去,而粗铜中的杂质留在阳极泥或电解液中,从而达到精炼铜的目的。其电极主要反应如下:
阳极(粗铜): 2Cl--2e-=Cl2 (氧化反应)
阴极(纯铜): Cu2++2e-=Cu (氧化反应)
5. 电解饱和食盐水的电极反应式为:
阳极:2Cl--2e- =Cl2↑(氧化反应)
阴极:2H++2e- =H2↑(还原反应)
或阴极:2H2O+2e- =H2↑+2OH-(还原反应)
总反应:2NaCl+2H2O =2NaOH+H2↑+Cl2↑
在阴极析出1. 42 L H2,同时在阳极也析出1.42 L Cl2。
6. 依题意,电解XCl2溶液时发生了如下变化:
? ????????????????????????????????????????????????????????
??????????????
M(X)=3.2 g×22.4 L/(1 mol×1.12 L)=64 g/mol
即X的相对原子质量为64。
又因为2Cl- - 2e- = Cl2↑
??????????????2 mol????? 22.4L
????????????? n(e-)????? 1.12L
n(e-)=2 mol×1.12 L/22.4 L=0.1 mol
即电路中通过的电子有0.1 mol。
XCl2 = X + Cl2 ↑
M(X)·1mol
3.2g
22.4L
1.12L
通电
