人教版 选修4 高二化学 1.1化学反应与能量的变化 上课课件(共43张ppt)
文档属性
| 名称 | 人教版 选修4 高二化学 1.1化学反应与能量的变化 上课课件(共43张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 19:07:13 | ||
图片预览











文档简介
(共43张PPT)
导入新课
蜡烛燃烧
在化学反应过程中能量以热能、电能和光能等形式表现出来,当能量以热的形式表现时,可以把化学反应分为放热反应和吸热反应。
铝箔燃烧产生光能和热能,该反应是放热反应。
铝箔燃烧
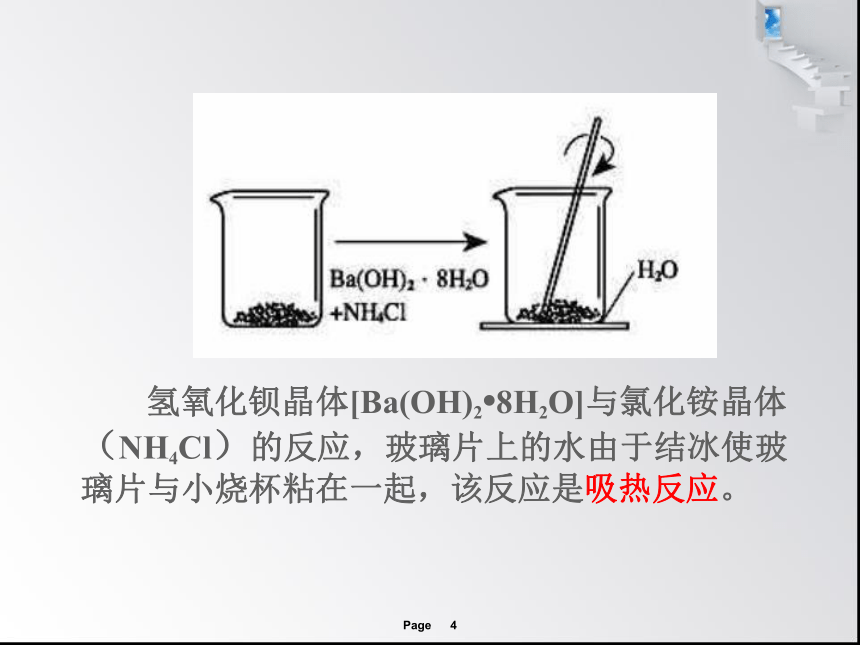
氢氧化钡晶体[Ba(OH)2?8H2O]与氯化铵晶体(NH4Cl)的反应,玻璃片上的水由于结冰使玻璃片与小烧杯粘在一起,该反应是吸热反应。
化学反应过程中同时存在物质和能量的变化,那么他们在化学反应体系及其变化中是如何体现的呢?
第1章 化学反应与能量
第1节 化学反应与能量的变化
◆焓变 反应热
◆热化学方程式
教学目标
一、知识与能力
1. 了解反应热和焓变的含义。
2. 认识热化学方程式的意义并能正确书写热化学方程式。
三、情感态度与价值观
二、过程与方法
培养学生从微观的角度理解化学问题。
通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论的能力以及语言表达能力;通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。
教学重点与难点
一、教学重点
二、教学难点
化学反应中的能量变化,热化学方程式的书写。
焓变、△H的“+”与“-”,热化学方程式的书写。
内容解析
一、焓变 反应热
在我们现实生活当中,有哪些现象伴随着化学反应的能量(热量)变化?
燃烧
金属生锈
化学反应中我们研究的对象是反应物和生成物,我们把它们称为反应体系,而把除它们之外的物质称为环境,我们把反应体系在化学反应过程中所释放或吸收的能量,用热量(或换算成相应的热量)来表述。
1. 在化学反应过程中放出或吸收的热量、通常叫做反应热。又称焓变。
用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
为什么化学反应过程中会有能量的变化?从化学键的角度看化学反应是怎样发生的?与能量有什么关系?反应物和生成物的相对能量的大小与其有何联系?
以氢气和氯气反应的能量变化为例:
H2(g)+Cl2(g)= 2HCl(g)
2. 任何化学反应都有反应热,从化学键的角度看化学反应包含两个过程:旧的化学键断裂和新的化学键形成。反应物中旧化学键断裂时,需要克服原子间的相互作用而吸收能量;当原子重新组成生成物、新化学键形成时,又要释放能量。断开化学键吸收的能量和形成化学键释放的能量通常不相等。新化学键形成时所释放的总能量与反应物中旧化学键断裂时所吸收的总能量的差就是此反应的反应热。
反应物和生成物的总能量通常不相等,当反应物的总能量大于生成物的总能量时,化学能转化为其他形式的能量释放出来,当反应物的总能量小于生成物的总能量时,化学反应将其他形式的能量转化为化学能储存起来,所以化学反应过程中总会伴随着能量的变化。
(1)当生成物释放的总能量大于反应物吸收的总能量时,反应为放热反应,使反应本身能量降低,△H为“一”,所以△H为“一”或△H<0时为放热反应。
视频烟花:放热反应
(2)当生成物释放的总能量小于反应物吸收的总能量时,反应是吸热反应,通过加热、光照等方法吸收能量,使反应本身能量升高,△H为“+”,所以△H为“+”或△H>0时为吸热反应。
氧气的实验室制法:吸热反应
二、热化学方程式
1.表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
H2(g)+I2(g)=2HI(g);△H=-14.9 kJ/mol
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
2.热化学方程式与我们学过的化学方程式有何相同和不同?
相同点:都表达了物质的变化,都遵守质量守恒;
不同点:热化学方程式还注明了各物质的状态、反应的温度和压强以及反应的反应热。
△H=-14.9 kJ/mol
H2(g)+I2(g) 2HI(g)
200℃
101kPa
反应物、生成物的状态不同,反应热也不相同,在完全的相同条件下完全燃烧2 mol氢气是完全燃烧1 mol氢气放出的热量的两倍,在热化学方程式里怎么表达出来呢?
例:在25℃、101kPa时,有两个由H2和O2化合成1molH2O的反应,一个生成气态水,一个生成液态水,其化学方程式克表示为:
H2(g)+ O2(g)=H2O(g) △H=-241.8 kJ/mol
H2(g)+ O2(g)=H2O( l ) △H=-285.8 kJ/mol
H2O(g)=H2O( l ) △H=+44.0 kJ/mol
两个反应的产物都是1molH2O,但释放出来的能量却不同,这是由于液态水蒸发为气态水时需要吸收能量。
3.书写热化学方程式的注意事项
(1)需注明反应的温度和压强。因为反应的温度和压强不同时,其△H不同。 (反应在25℃、101 kPa下进行时,可不注明温度和压强条件。)
(2)要注明反应物和生成物的状态。物质的聚集状态,与它们所具有的能量有关。
(3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。对于相同物质的反应,当化学计量数不同时,其△H也不同,△H的数值与化学计量数成正比,△H的“+”、“-”不能省略。
描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
4.热化学方程式的含义
课堂小结
1.在化学反应过程中放出或吸收的热量、通常叫做反应热。又称焓变。用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
2.表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
3. 反应热表示方法:1)当生成物释放的总能量大于反应物吸收的总能量时,反应为放热反应,△H为“一”或△H<0;2)当生成物释放的总能量小于反应物吸收的总能量时,反应是吸热反应,△H为“十”或△H>0。
4.热化学方程式的含义:描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
5.书写热化学方程式的注意事项:1)需注明反应的温度和压强,因反应的温度和压强不同时,其△H不同(反应在25℃、101 kPa下进行时,可不注明温度和压强条件);2)要注明反应物和生成物的状态,物质的聚集状态,与它们所具有的能量有关; 3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。对于相同物质的反应,当化学计量数不同时,其△H也不同,△H的数值与化学计量数成正比,△H的“+”、“-”不能省略。
课堂练习
一、填空
1. 根据化学反应过程中的热量变化,可以把化学反应分为____反应和____反应。
放热
吸热
2. 1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=____kJ/mol。
+131.5
3. 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为___________________。又已知:;△H=44kJ.则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______kJ。
△H=-2165kJ/mol?
1016.5
二、选择题
1. 下列说法正确的是__
需要加热方能发生的反应一定是吸热反应
B. 放热的反应在常温下一定很易发生
C. 反应是放热的还是吸热的必须看反应物和生 成物所具有的总能量的相对大小
D. 吸热反应在一定的条件下也能发生
CD
2. 已知在25℃,101kPa下,1g (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是__
A. △H=-48.40kJ/mol
B. △H=-5518kJ/mol
C. △H=+5518kJ/mol
D. △H=-11036kJ/mol
BD
教材习题答案
1. 举例说明什么叫反应热,它的符号和单位是什么?
提示:化学反应中所释放或吸收的能量,叫做反应热。符号是△H,单位是kJ/mol。
2. 用物质结构的知识说明为什么有的反应吸热,有的反应放热。
提示:化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成
物的分子。旧键断裂需要吸收能量,新键形成需要吸收能量,新键形成则要放出能量。当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化成生成物,则此反应为放热反应。
3. 依据事实,写出下列反应的化学方程式。
(1)1molN2(g)与适量H2(g)起反应生成NH3 (g),放出92.2kJ热量。
(2)1molN2(g)与适量O2(g)起反应生成NO2 (g),吸收68kJ热量。
(3)1molCu(s)与适量O2(g)起反应生成CuO (s),放出157kJ热量。
(4)1molC(s)与适量H2O(g)起反应生成CO (g)和H2 (g),吸收131.5kJ热量。
(5)卫星发射时可用肼(N2H2)作燃料,1mol N2H2 (l)在O2 (g)中燃烧,生成N2(g)和H2 O(l), 放出622kJ热量。
(6)汽油的重要成分是辛烷(C8H18),1mol C8H18 (l)在O2 (g)中燃烧,生成CO2(g)和H2 O(l), 放出5518kJ热量。
提示:(1)N2 (g) +3 H2 (g)=2NH3 (g) △H=-92.2kJ/mol
(2)N2 (g) + 2O2 (g)=2NO2 (g) △H=+68kJ/mol
(4)C(s) + H2O(g)=CO (g)+H2(g)△H=+131.5kJ/mol
(5)N2H4(l)+ O2 (g)=N2(g)+2H2O (l) △H=-622kJ/mol
(3)Cu(s) + O2 (g)=CuO(s) △H=-157kJ/mol
(6)C8H18(l)+ O2 (g)=8CO2(g)+9H2O (l) △H=-5518kJ/mol
4. 根据下列图式,写出反应的热化学方程式。
(2)CO2(g)+ H2(g)=CO (g)+H2O(g)△H=+41kJ/mol
提示:(1)CO(g) + H2O(g)=CO 2(g)+H2(g) △H=-41kJ/mol
导入新课
蜡烛燃烧
在化学反应过程中能量以热能、电能和光能等形式表现出来,当能量以热的形式表现时,可以把化学反应分为放热反应和吸热反应。
铝箔燃烧产生光能和热能,该反应是放热反应。
铝箔燃烧
氢氧化钡晶体[Ba(OH)2?8H2O]与氯化铵晶体(NH4Cl)的反应,玻璃片上的水由于结冰使玻璃片与小烧杯粘在一起,该反应是吸热反应。
化学反应过程中同时存在物质和能量的变化,那么他们在化学反应体系及其变化中是如何体现的呢?
第1章 化学反应与能量
第1节 化学反应与能量的变化
◆焓变 反应热
◆热化学方程式
教学目标
一、知识与能力
1. 了解反应热和焓变的含义。
2. 认识热化学方程式的意义并能正确书写热化学方程式。
三、情感态度与价值观
二、过程与方法
培养学生从微观的角度理解化学问题。
通过对学习资料的查找与交流,培养学生获取信息、理解信息并得出结论的能力以及语言表达能力;通过从化学键的角度分析化学反应,引导学生分析引起反应热的本质。
教学重点与难点
一、教学重点
二、教学难点
化学反应中的能量变化,热化学方程式的书写。
焓变、△H的“+”与“-”,热化学方程式的书写。
内容解析
一、焓变 反应热
在我们现实生活当中,有哪些现象伴随着化学反应的能量(热量)变化?
燃烧
金属生锈
化学反应中我们研究的对象是反应物和生成物,我们把它们称为反应体系,而把除它们之外的物质称为环境,我们把反应体系在化学反应过程中所释放或吸收的能量,用热量(或换算成相应的热量)来表述。
1. 在化学反应过程中放出或吸收的热量、通常叫做反应热。又称焓变。
用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
为什么化学反应过程中会有能量的变化?从化学键的角度看化学反应是怎样发生的?与能量有什么关系?反应物和生成物的相对能量的大小与其有何联系?
以氢气和氯气反应的能量变化为例:
H2(g)+Cl2(g)= 2HCl(g)
2. 任何化学反应都有反应热,从化学键的角度看化学反应包含两个过程:旧的化学键断裂和新的化学键形成。反应物中旧化学键断裂时,需要克服原子间的相互作用而吸收能量;当原子重新组成生成物、新化学键形成时,又要释放能量。断开化学键吸收的能量和形成化学键释放的能量通常不相等。新化学键形成时所释放的总能量与反应物中旧化学键断裂时所吸收的总能量的差就是此反应的反应热。
反应物和生成物的总能量通常不相等,当反应物的总能量大于生成物的总能量时,化学能转化为其他形式的能量释放出来,当反应物的总能量小于生成物的总能量时,化学反应将其他形式的能量转化为化学能储存起来,所以化学反应过程中总会伴随着能量的变化。
(1)当生成物释放的总能量大于反应物吸收的总能量时,反应为放热反应,使反应本身能量降低,△H为“一”,所以△H为“一”或△H<0时为放热反应。
视频烟花:放热反应
(2)当生成物释放的总能量小于反应物吸收的总能量时,反应是吸热反应,通过加热、光照等方法吸收能量,使反应本身能量升高,△H为“+”,所以△H为“+”或△H>0时为吸热反应。
氧气的实验室制法:吸热反应
二、热化学方程式
1.表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
H2(g)+I2(g)=2HI(g);△H=-14.9 kJ/mol
热化学方程式不仅表明了化学反应中的物质变化,也表明了化学反应中的能量变化。
2.热化学方程式与我们学过的化学方程式有何相同和不同?
相同点:都表达了物质的变化,都遵守质量守恒;
不同点:热化学方程式还注明了各物质的状态、反应的温度和压强以及反应的反应热。
△H=-14.9 kJ/mol
H2(g)+I2(g) 2HI(g)
200℃
101kPa
反应物、生成物的状态不同,反应热也不相同,在完全的相同条件下完全燃烧2 mol氢气是完全燃烧1 mol氢气放出的热量的两倍,在热化学方程式里怎么表达出来呢?
例:在25℃、101kPa时,有两个由H2和O2化合成1molH2O的反应,一个生成气态水,一个生成液态水,其化学方程式克表示为:
H2(g)+ O2(g)=H2O(g) △H=-241.8 kJ/mol
H2(g)+ O2(g)=H2O( l ) △H=-285.8 kJ/mol
H2O(g)=H2O( l ) △H=+44.0 kJ/mol
两个反应的产物都是1molH2O,但释放出来的能量却不同,这是由于液态水蒸发为气态水时需要吸收能量。
3.书写热化学方程式的注意事项
(1)需注明反应的温度和压强。因为反应的温度和压强不同时,其△H不同。 (反应在25℃、101 kPa下进行时,可不注明温度和压强条件。)
(2)要注明反应物和生成物的状态。物质的聚集状态,与它们所具有的能量有关。
(3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。对于相同物质的反应,当化学计量数不同时,其△H也不同,△H的数值与化学计量数成正比,△H的“+”、“-”不能省略。
描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
4.热化学方程式的含义
课堂小结
1.在化学反应过程中放出或吸收的热量、通常叫做反应热。又称焓变。用符号“△H”表示,单位常采用kJ/mol或kJ·mol-1
2.表明反应所放出或吸收的热量的化学方程式,叫做热化学方程式。
3. 反应热表示方法:1)当生成物释放的总能量大于反应物吸收的总能量时,反应为放热反应,△H为“一”或△H<0;2)当生成物释放的总能量小于反应物吸收的总能量时,反应是吸热反应,△H为“十”或△H>0。
4.热化学方程式的含义:描述在一定条件下,一定量某状态下的物质,充分反应后所吸收或放出热量的多少。
5.书写热化学方程式的注意事项:1)需注明反应的温度和压强,因反应的温度和压强不同时,其△H不同(反应在25℃、101 kPa下进行时,可不注明温度和压强条件);2)要注明反应物和生成物的状态,物质的聚集状态,与它们所具有的能量有关; 3)热化学方程式各物质前的化学计量数不表示分子个数,它可以是整数也可以是分数。对于相同物质的反应,当化学计量数不同时,其△H也不同,△H的数值与化学计量数成正比,△H的“+”、“-”不能省略。
课堂练习
一、填空
1. 根据化学反应过程中的热量变化,可以把化学反应分为____反应和____反应。
放热
吸热
2. 1molC与1molH2O(g)反应失成lmol CO(g)和1mol H2(g),需要吸收131.5kJ的热量,该反应的反应热为△H=____kJ/mol。
+131.5
3. 0.3mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5kJ热量,其热化学方程式为___________________。又已知:;△H=44kJ.则11.2L(标准状况)乙硼烷完全燃烧生成气态水时放出的热量是_______kJ。
△H=-2165kJ/mol?
1016.5
二、选择题
1. 下列说法正确的是__
需要加热方能发生的反应一定是吸热反应
B. 放热的反应在常温下一定很易发生
C. 反应是放热的还是吸热的必须看反应物和生 成物所具有的总能量的相对大小
D. 吸热反应在一定的条件下也能发生
CD
2. 已知在25℃,101kPa下,1g (辛烷)燃烧生成二氧化碳和液态水时放出48.40kJ热量。表示上述反应的热化学方程式正确的是__
A. △H=-48.40kJ/mol
B. △H=-5518kJ/mol
C. △H=+5518kJ/mol
D. △H=-11036kJ/mol
BD
教材习题答案
1. 举例说明什么叫反应热,它的符号和单位是什么?
提示:化学反应中所释放或吸收的能量,叫做反应热。符号是△H,单位是kJ/mol。
2. 用物质结构的知识说明为什么有的反应吸热,有的反应放热。
提示:化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成
物的分子。旧键断裂需要吸收能量,新键形成需要吸收能量,新键形成则要放出能量。当反应完成时,若生成物释放的能量比反应物吸收的能量大,则此反应为放热反应;若生成物释放的能量比反应物吸收的能量小,反应物需要吸收能量才能转化成生成物,则此反应为放热反应。
3. 依据事实,写出下列反应的化学方程式。
(1)1molN2(g)与适量H2(g)起反应生成NH3 (g),放出92.2kJ热量。
(2)1molN2(g)与适量O2(g)起反应生成NO2 (g),吸收68kJ热量。
(3)1molCu(s)与适量O2(g)起反应生成CuO (s),放出157kJ热量。
(4)1molC(s)与适量H2O(g)起反应生成CO (g)和H2 (g),吸收131.5kJ热量。
(5)卫星发射时可用肼(N2H2)作燃料,1mol N2H2 (l)在O2 (g)中燃烧,生成N2(g)和H2 O(l), 放出622kJ热量。
(6)汽油的重要成分是辛烷(C8H18),1mol C8H18 (l)在O2 (g)中燃烧,生成CO2(g)和H2 O(l), 放出5518kJ热量。
提示:(1)N2 (g) +3 H2 (g)=2NH3 (g) △H=-92.2kJ/mol
(2)N2 (g) + 2O2 (g)=2NO2 (g) △H=+68kJ/mol
(4)C(s) + H2O(g)=CO (g)+H2(g)△H=+131.5kJ/mol
(5)N2H4(l)+ O2 (g)=N2(g)+2H2O (l) △H=-622kJ/mol
(3)Cu(s) + O2 (g)=CuO(s) △H=-157kJ/mol
(6)C8H18(l)+ O2 (g)=8CO2(g)+9H2O (l) △H=-5518kJ/mol
4. 根据下列图式,写出反应的热化学方程式。
(2)CO2(g)+ H2(g)=CO (g)+H2O(g)△H=+41kJ/mol
提示:(1)CO(g) + H2O(g)=CO 2(g)+H2(g) △H=-41kJ/mol
