高中化学人教版选修5第二章2.1-脂肪烃(71张PPT)
文档属性
| 名称 | 高中化学人教版选修5第二章2.1-脂肪烃(71张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 19:10:26 | ||
图片预览








文档简介
(共71张PPT)
选修5《有机化学基础》
第二章 烃和卤代烃
(烷烃和烯烃)
【知识与技能】
了解烷烃、烯烃和炔烃的物理性质的规律性变化
了解烷烃、烯烃、炔烃的结构特点
【过程与方法】注意不同类型脂肪烃的结构和性质的对比
善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力
【情感态度价值观】
根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想
【教学重点】烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法。
【教学难点】烯烃的顺反异构。
【教学目标】
销售经理的工作计划小结包括哪些内容
工作计划的概念
1、工作计划就是对即将开展的工作的设想和安排,如提出任务、指标、完成时间和步骤方法等。
2、工作计划是提高工作效率的有效手段。
3、工作计划是我们走向积极式工作的起点。
4、工作计划能力是干部管理水平的体现。
为什么要写工作计划
古代孙武曾说:“用兵之道,以计为首。”其实,无论是单位还是个人,无论办什么事情,事先都应有个打算和安排。有了计划,工作就有了明确的目标和具体的步骤,就可以协调大家的行动,增强工作的主动性,减少盲目性,使工作有条不紊地进行。同时,计划本身又是对工作进度和质量的考核标准,对大家有较强的约束和督促作用。
计划对工作既有指导作用,又有推动作用,搞好工作计划,是建立正常的工作秩序,提高工作效率的重要手段。作为一个管理者,必须知道你的部门的工作任务与目标,明确方向,知道自己的工作内容,如何来干好这些工作,什么人来干这些工作,工作进度怎么安排,掌握哪些可以使用的资源?
一个管理干部通过工作计划,利用可以使用的资源,统筹规划,按照事先设定策略、方法、完成时间与要求,完成各项工作目标。这就体现了你的管理水平与能力。
写工作计划
第29届奥林匹克运动会于2008年8月8日在北京举行,所用火炬祥云选用某气体为燃料,燃烧后只产生CO2和H2O,不会对环境造成污染,更主要的是它可以适应比较宽的温度范围,在零下40摄氏度时仍能产生1个以上饱和蒸汽压,高于外界大气压,形成燃烧;而且它产生的火焰呈亮黄色,火炬手跑动时,动态飘动的火焰在不同背景下都比较醒目。
你知道吗?
此气体为—丙烷
本节学习烷烃和烯烃性质
【复习1】
1、黑色的金子、工业的血液是什么?它的主要组成元素是什么?
2、什么是烃?烃的衍生物?什么是卤代烃?
烃可以看作是有机化合物的母体,烃分子中的氢原子被其他原子或原子团取代的产物称为它的衍生物。
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。烃如何分类?
3、有机物的反应与无机物反应相比有何特点?
烃的主要来源——石油
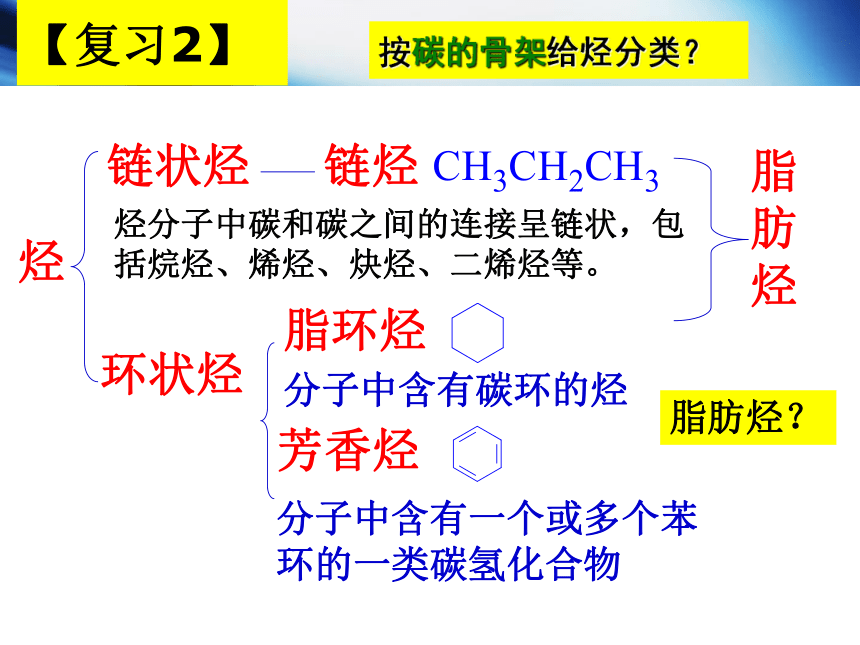
链状烃
烃分子中碳和碳之间的连接呈链状,包括烷烃、烯烃、炔烃、二烯烃等。
环状烃
脂环烃
芳香烃
分子中含有一个或多个苯环的一类碳氢化合物
链烃
脂肪烃
烃
分子中含有碳环的烃
按碳的骨架给烃分类?
【复习2】
脂肪烃?
什么是脂肪烃?
具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
分子中碳原子间连结成链状的碳架,两端张开而不成环的烃,叫做开链烃,简称链烃。因为脂肪具有这种结构,所以也叫做脂链烃。
有些环烃在性质上不同于芳香烃,而十分类似脂链烃,这类环烃叫脂环烃。这样,脂肪烃便成为除芳香烃以外的所有烃的总称。脂链烃和它的衍生物总称为脂肪族化合物,脂环烃及它的衍生物总称脂环族化合物。
自然界中的脂肪烃较少,但其衍生物则广泛存在,而且与生命有极密切的关系。如:樟脑—常用驱虫剂、 麝香— 常用中草药和冰片。
【复习3】
脂肪烃一般都是石油和天然气的重要成分。C1~C5低碳脂肪烃是石油化工的基本原料,尤其是乙烯、丙烯和C4、C5共轭烯烃,在石油化工中应用最多、最广。
分类方法。 ① 饱和脂肪烃 分子中无不饱和的键,碳原子间以碳碳单键相连,通式CnH2n+2。 ② 不饱和脂肪烃 分子中有不饱和键存在。
按不饱和键的不同又分为: 烯烃 含有碳碳双键 通式:有x个碳碳双键,CnH2n+2-2x 炔烃 含有碳碳叁键 通式:有x个碳碳三键,CnH2n+2-4x
烃和卤代烃等有机物的反应与无机物反应相比有其特点:
(1)反应缓慢。有机分子中的原子一般以共价键结合,有机反应是分子之间的反应。
(2)反应产物复杂。有机物往往具有多个反应部位,在生成主要产物的同时,往往伴有其他副产物的生成。
(3)反应常在有机溶剂中进行。有机物一般在水中的溶解度较小,而在有机溶剂中的溶解度较大。
【复习4】
【概念】
烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)
烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。通式:CnH2n (n≥2)
(分子里含有两个双键的链烃叫做二烯烃)
一、 烷烃alkane和烯烃alkene
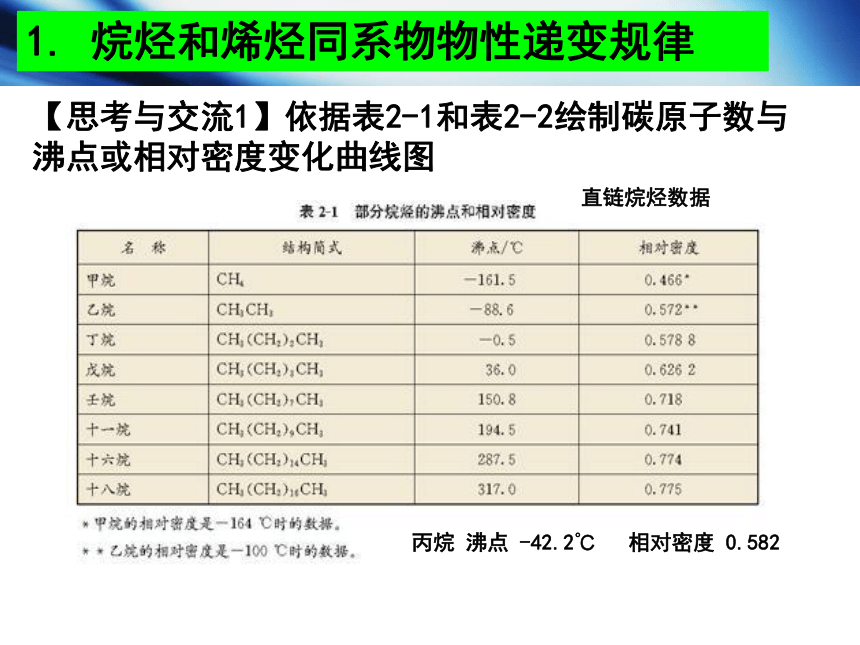
【思考与交流1】依据表2-1和表2-2绘制碳原子数与沸点或相对密度变化曲线图
1. 烷烃和烯烃同系物物性递变规律
丙烷 沸点 -42.2℃ 相对密度 0.582
直链烷烃数据
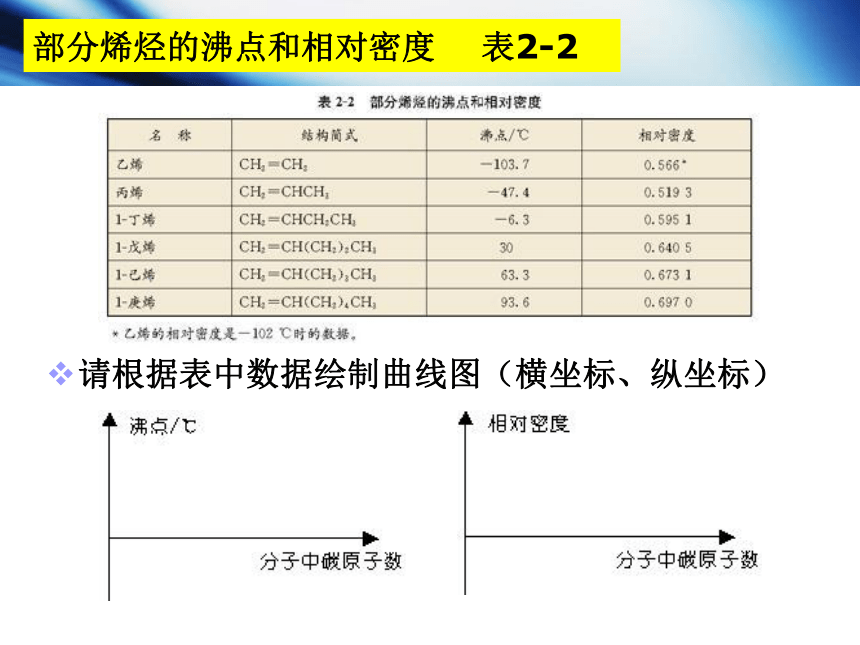
部分烯烃的沸点和相对密度 表2-2
请根据表中数据绘制曲线图(横坐标、纵坐标)
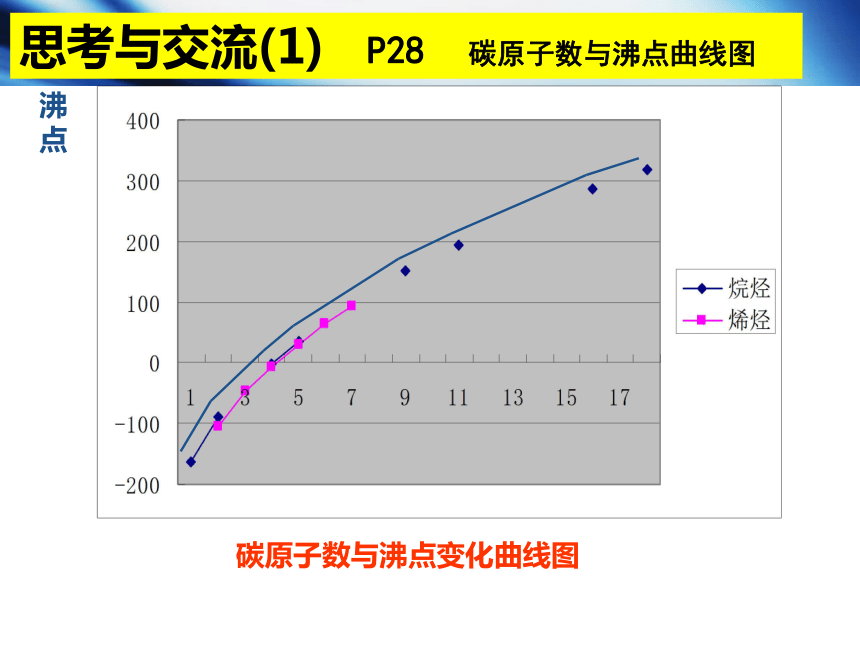
思考与交流(1) P28 碳原子数与沸点曲线图
碳原子数与沸点变化曲线图
碳原子数与密度变化曲线图
碳原子数与相对密度变化曲线图
相对密度
图2-1烷烃、烯烃的沸点随碳原子数变化曲线
图2-1
烷烃、烯烃同系物的相对密度随碳原子数的变化曲线
图2-2烷烃的相对密度随碳原子数变化曲线
图2-3 烯烃的相对密度随碳原子数变化曲线
【请归纳】烷烃和烯烃物理性质递变规律
【结论】烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈规律性的变化。
同系物的沸点逐渐升高,相对密度逐渐增大,常温下的存在状态也由气态逐渐过渡到液态、固态。
【原因】对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变……
【说明】
① 所有烷烃均难溶于水,密度均小于1。
② 常温下烷烃的状态:
当C1~C4 时 呈气态;C5~C16时呈液态; C17以上时为固态。
③ 分子式相同的烃,支链越多,熔沸点越低。
④ 所有的烃都是无色物质,不溶于水而易溶于苯、乙醚等有机溶剂。
【练习】
1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( )
A.高于-0.5℃ B.约是+30℃
C.约是-40℃ D.低于-89℃
2、下列烷烃沸点最高的是( )
A.CH3CH2CH3 B.CH3CH2CH2CH3
C.CH3(CH2)3CH3
D.(CH3)2CHCH2CH3
C
C
思考与交流(2) 谈无机与有机反应分类方法与思路
取代反应:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
加成反应
加聚反应:通过加成反应聚合成高分子化合物的反应(加成聚合反应)。
加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
【思考与交流2】无机反应与有机反应类型的对比
化学反应──无论是无机化学反应和有机化学反应,其本质是相同的,都是构成分子的原子之间的重新组合或排列,在这一过程中必然伴随着旧化学键的断裂和新化学键的形成过程。
有机反应大多是分子反应,大多数无机反应为离子反应。
2. 烷烃和烯烃化学性质比较
【复习】基本有机反应类型——分子组成与结构
(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。
(2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。
(3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。
【讨论】甲烷、乙烯的结构和性质的相似点和不同点,列表小结。
烷烃典型——取代;烯烃典型反应——加成、氧化、加聚
烷烃的化学性质
CnH2n+2
(1)通式:
(2)同系物:
分子结构相似,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物。
(3)化学性质
B 、氧化反应
A、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
C 、取代反应
CnH2n+2 +(3n+1)/2 O2 nCO2 +(n+1)H2O
点燃
写出对应的化学方程式。
烷烃特征反应
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以其它烷烃取代比甲烷复杂。
请写出乙烷、丙烷与氯气光照条件下的反应。
D 、热分解
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
烷烃的裂化
烯烃的化学性质
(1)通式:
【乙烯分子的结构】乙烯与乙烷相比少两个氢原子。C原子为满足4个价键,碳碳键必须以双键存在。
请书写出乙烯分子的电子式和结构式 ?
书写注意事项和结构简式的正误书写:
正:CH2=CH2 H2C=CH2
误:CH2CH2
(2)化学性质:
(A)加成反应 ( 与H2、Br2、HX、H2O等)
使溴水褪色
△
大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。
主产物
(B)氧化反应
①燃烧:
②催化氧化:
火焰明亮,冒黑烟。烯烃燃烧通式?
③与酸性KMnO4的作用:
使KMnO4溶液褪色
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
其它烯烃氧化反应
R—CH=CH2 R—COOH + CO2
使酸性KMnO4 溶液褪色
(C)加聚反应:
由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应。
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子,这样的聚合反应同时也是加成反应,所以这样聚合反应又叫做加聚反应。
【练习】请写出CH3CH=CH2分别与H2、Br2、HBr、H2O发生加成反应及加聚的化学方程式。
单体?
链节?
聚合度?
聚丙烯
聚丁烯
【归纳】烷烃、烯烃的结构和性质
分子结构相似的物质在化学性质上也相似.
完成【学与问】 P30
烃的类别 分子结构
特点 代表物质 主要化学
性质
烷烃 全部单键、饱和 CH4 燃烧、取代、热分解
烯烃 有碳碳双键、不饱和 CH2=CH2 燃烧、与强氧化剂反应、加成、加聚
三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成
【 练习2】
A
已知: ,如果要合成
所用的原始原料可以是
A. 2 -甲基-l,3 -丁二烯和2 -丁炔
B.1,3 -戊二烯和2 -丁炔
C.2,3 -二甲基-1,3 -戊二烯和乙炔
D. 2,3 -二甲基-l,3 -丁二烯和丙炔
【 练习3】
AD
CnH2n-2 (n≧4)
代表物:
1,3-丁二烯 CH2=CH-CH=CH2
2、二烯烃的通式:
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
【思考】 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:含有两个碳碳双键(C=C)的不饱和链烃。
二、 二烯烃性质
两个双键在碳链中的不同位置:
C—C=C=C—C ①累积二烯烃(不稳定)
C=C—C=C—C ②共轭二烯烃
C=C—C—C=C ③孤立二烯烃
3、类别:
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
【思考】当1molCH2=CH-CH=CH2与1molBr2或Cl2加成时,其加成产物是什么?
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
1,2 加成
1,4 加成
1,2 Br
1,4 Br
(主产物)
(中间体)
3,4-二溴-1-丁烯
1,4-二溴-2-丁烯
(1)1,2-加成 和 1,4-加成反应
加成反应——键线表示
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
(2)加聚反应
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
写出下列物质发生加聚反应的化学方程式
分析:加聚反应产物及单体
(1)乙烯型
CH2=CH2
聚合物:
单 体:
(2)1,3-丁二烯型
单体:
单体:
CH2=CH-CH=CH2
聚合物:
聚合物:
(3)混合型
CH2=CH-CH=CH2
单 体:
混合型:
【思考】
2-丁烯 中,与碳碳双键相连的两个碳原子、两个氢原子是否处于同一平面?
如处于同一平面,与碳碳双键相连的两个碳原子是处于双键的同侧还是异侧?
CH3CH=CHCH3
5、烯烃的顺反异构现象
H
H
CH3
CH3
CH3
CH3
H
H
反式异构
顺式异构
如果每个双键碳原子连接了两个不同的原子
或原子团,双键上的4个原子或原子团在空间就有两种不同的排列方式,产生两种不同的异构,
即顺反异构 。
(1)异构现象的产生:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
(2)产生顺反异构体的条件:
双键两端的同一个碳原子上不能连有相同基团。只有这样才会产生顺反异构体。即a’ ? b’,a ? b ,且 a = a’、b = b’ 至少有一个存在。
顺式结构:两个相同的原子或原子团排列在双键的同一侧。
反式结构:两个相同的原子或原子团排列在双键的两侧。
(3)异构的分类
顺式结构和反式结构的两种烯烃化学性质基本相同,物理性质有一定差异。
(4)顺反异构体的性质
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构 ——空间异构
【思考】烷烃是否也有顺反异构现象?
烷烃分子中的碳碳单键可以旋转,所以不会产生有顺反异构现象。
【例题】下列物质中没有顺反异构的是:
A.1,2-二氯乙烯
B.1,2-二氯丙烯
C.2-甲基-2-丁烯
D.2-氯-2-丁烯
【思考】2-丁炔有顺反异构吗?
×
√
√
√
不存在顺反异构现象,线形分子不具备构成的条件。
形成顺反异构的条件:
1.具有碳碳双键
2.组成双键的每个碳原子必须连接
两个不同的原子或原子团.
【例1】某有机物含碳85.7%,含氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水刚好完全褪色 ,此时液体总质量81.4g,
求:①有机物分子式
②经测定,该有机物分子中有两个-CH3。 写出它的结构简式。
练习:
分子式 :
C4H8
两种位置异构:
CH3-CH=CH-CH3或
该有机物能使溴水褪色,说明该有机物中含有不饱和键;
该有机物:
n(C) :n(H)=
所以该有机物为烯烃
1.4g该有机物可与0.025molBr2反应
= 0.025mol
= 1:2
分析:
例2
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯 (B) 2-丁烯
(C) 丙烯 (D) 1-丁烯
AB
(1)丁烯的碳链和位置异构:
CH2=CH-CH2-CH3 CH3 CH=CHCH3
1-丁烯 2-丁烯
(1) (2)
(1),(2)是双键位置异构。
例3:写出丁烯的同分异构体。
【例4】通常,烷烃可以由相应的烯烃催化加氢得到。但是有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A、B1、B2、B3的结构简式分别 , ,
, 。
A: (CH3)3C-CH2-C(CH3)3
B1: (CH3)3C-C(CH3)2-CH2-CH3
B2: (CH3)2-CH-C(CH3)2-CH- (CH3)2
B3: C(CH2-CH3)4
【烃类的几个重要规律及应用】
1、【规律1】烃分子含氢原子数恒为偶数,其相对分子质量恒为偶数。
【应用】如果求得的烃分子所含氢原子数为奇数或相对分子质量为奇数,则求算一定有错。
2、烃燃烧前后气体体积变化规律:
【思考】常温常压下, 某气态烃和氧气的混和物aL,经点燃且完全燃烧后, 得到bL气体(常温常压下),则a和b的大小关系为( )
A. a=b B. a>b
C. aB
【规律2】在100℃以下,任何烃和氧气的混和物完全燃烧,反应后气体体积都是减小的。
【思考】120℃时,某烃和O2混合,完全燃烧后恢复到原来的温度和压强,气体体积减小,该烃是( )
A. CH4 B. C2H4
C. C2H2 D. C2H6
【规律3】
气态烃(CxHy)在100℃及其以上温度完全燃烧时,气体体积变化只与氢原子个数有关: ①若y=4,燃烧前后体积不变,△V=0 ②若y>4,燃烧前后体积增大,△V>0 ③若y<4,燃烧前后体积减少,△V<0 (只有乙炔)
C
燃烧前后气体的体积大小变化规律
原理:
烃的燃烧通式为:
CxHy + (x+y/4)O2 →xCO2 + y/2 H2O
反应前后气体的体积的变化量为
△V=(x+y/2) – (1+x+y/4) = y/4 – 1,
显然, y=4时, △V=0
y>4时, △V>0
y<4时, △V<0
3、烃完全燃烧时耗氧量的规律
烃燃烧的化学方程式:
CxHy + (x+y/4)O2 → xco2 + y/2H2O
等物质的量的烃完全燃烧耗氧量比较的规律:
【 规律4】对于等物质的量的任意烃(CxHy) ,完全燃烧,耗氧量的大小取决于(x+y/4) 的值的大小,该值越大,耗氧量越多。
【例题】等物质的量的CH4, C2H4, C2H6, C3H4, C3H6 完全燃烧,耗氧量最大的是哪个?
解:根据等物质的量的任意烃,完全燃烧,耗氧量的大小取决于(x+y/4) 的值的大小,该值越大,耗氧量越多。
得到C3H6中, (x+y/4)的值最大,所以, C3H6的耗氧量最多。
等质量的烃完全燃烧耗氧量比较的规律:
【例题】等质量的CH4, C2H4, C2H6, C3H4, C3H6完全燃烧,耗氧量最大的是哪个?
【规律5】对于质量的任意烃,完全燃烧,耗氧量的大小取决于( y/x) 的值的大小,该值越大,耗氧量越多。
解:根据上述规律,得到结论( y/x)值越大,耗氧量越多,则对于质量的上述烃,完全燃烧CH4的耗氧量最多。
总结:等质量各类烃完全燃烧,耗O2量关系
【应用】等质量的烷烃随碳原子个数的增大,消耗O2的量 (填“增大” 、“减小”或“不变”)。
等质量的具有相同最简式的有机物完全燃烧时,耗O2量,生成CO2量、H2O量均分别相同。
最简式相同的有机物无论以何种比例混合,只要总质量一定,耗O2量、生成CO2量、H2O量均为定值。
【思考】 等质量的CnH2n O 和CmH2m O 2分别完全燃烧时,消耗O2的量相等,则n和m的数学关系为 。
【规律6】
【规律】:
两种有机物,无论最简式是否相同,只要C%相同,等质量完全燃烧时,生成的CO2量相等。同理若H%相同,则生成的H2O 量相等。但耗O2量未必相同。
如何寻找符合这些特征的有机物分子呢?
有机化合物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种。如果将A、B不论以何种比例混合,只要其质量之和不变,完全燃烧时所消耗的氧气和生成的二氧化碳的质量也不变。那么,A、B组成必须满足的条件是 。
若A是甲醛,则符合上述条件的化合物B中,相对分子质量最小的是?写出分子式? ,并写出相对分子质量最小的不含甲基(?CH3)的B的1种同分异构体结构简式: 。
应用:
4、各类烃含碳(或氢)的质量分数变化
各类烃C%、H%(均为质量分数)随C原子数n的变化图示
【规律7】
烷烃:随着n的增大,含碳质量分数增大,但总是小于85.7%。甲烷是含氢质量分数最高的,也是所有烃中含氢质量分数最高的。
烯烃:含碳质量分数是不变的。85.7%
炔烃:随着n的增大,含碳质量分数减小,但总是大于85.7%。乙炔是含碳量最高的,达到92.3%
苯及其同系物:随着n的增大,含碳质量分数减小,但总是大于85.7%。
注意:
①在各类烃中H%最高的是CH4,其次为C2H6。
②在上述各类烃中C%最高的是C2H2、C6H6,除此外还有C8H8(如立方烷) 。
③在所有烃中并非是最简式CH的烃C%最高的.如还有C10H8(萘)更高。
商余法确定分子式
【原理】对于任意的烃( CxHy ),其相对分子量为M=12x+y,则M/12=x+y/12, 显然,x为商(C原子数目),y为余数(H原子数目)。从而推断出烃的分子式。
例:下列数值都是烃的相对分子质量,其对应的烃一定为烷烃的是( )
A.44 B.42 C.54 D.128
解析:44/12=3余8, 则该烃是C3H8
128/12=10余8,则该烃是C10H8
=9余20,则该烃是C9H20
A
选修5《有机化学基础》
第二章 烃和卤代烃
(烷烃和烯烃)
【知识与技能】
了解烷烃、烯烃和炔烃的物理性质的规律性变化
了解烷烃、烯烃、炔烃的结构特点
【过程与方法】注意不同类型脂肪烃的结构和性质的对比
善于运用形象生动的实物、模型、计算机课件等手段帮助学生理解概念、掌握概念、学会方法、形成能力
【情感态度价值观】
根据有机物的结果和性质,培养学习有机物的基本方法“结构决定性质、性质反映结构”的思想
【教学重点】烯烃、炔烃的结构特点和主要化学性质;乙炔的实验室制法。
【教学难点】烯烃的顺反异构。
【教学目标】
销售经理的工作计划小结包括哪些内容
工作计划的概念
1、工作计划就是对即将开展的工作的设想和安排,如提出任务、指标、完成时间和步骤方法等。
2、工作计划是提高工作效率的有效手段。
3、工作计划是我们走向积极式工作的起点。
4、工作计划能力是干部管理水平的体现。
为什么要写工作计划
古代孙武曾说:“用兵之道,以计为首。”其实,无论是单位还是个人,无论办什么事情,事先都应有个打算和安排。有了计划,工作就有了明确的目标和具体的步骤,就可以协调大家的行动,增强工作的主动性,减少盲目性,使工作有条不紊地进行。同时,计划本身又是对工作进度和质量的考核标准,对大家有较强的约束和督促作用。
计划对工作既有指导作用,又有推动作用,搞好工作计划,是建立正常的工作秩序,提高工作效率的重要手段。作为一个管理者,必须知道你的部门的工作任务与目标,明确方向,知道自己的工作内容,如何来干好这些工作,什么人来干这些工作,工作进度怎么安排,掌握哪些可以使用的资源?
一个管理干部通过工作计划,利用可以使用的资源,统筹规划,按照事先设定策略、方法、完成时间与要求,完成各项工作目标。这就体现了你的管理水平与能力。
写工作计划
第29届奥林匹克运动会于2008年8月8日在北京举行,所用火炬祥云选用某气体为燃料,燃烧后只产生CO2和H2O,不会对环境造成污染,更主要的是它可以适应比较宽的温度范围,在零下40摄氏度时仍能产生1个以上饱和蒸汽压,高于外界大气压,形成燃烧;而且它产生的火焰呈亮黄色,火炬手跑动时,动态飘动的火焰在不同背景下都比较醒目。
你知道吗?
此气体为—丙烷
本节学习烷烃和烯烃性质
【复习1】
1、黑色的金子、工业的血液是什么?它的主要组成元素是什么?
2、什么是烃?烃的衍生物?什么是卤代烃?
烃可以看作是有机化合物的母体,烃分子中的氢原子被其他原子或原子团取代的产物称为它的衍生物。
烃分子中的氢原子被卤素原子取代后生成的化合物称为卤代烃。烃如何分类?
3、有机物的反应与无机物反应相比有何特点?
烃的主要来源——石油
链状烃
烃分子中碳和碳之间的连接呈链状,包括烷烃、烯烃、炔烃、二烯烃等。
环状烃
脂环烃
芳香烃
分子中含有一个或多个苯环的一类碳氢化合物
链烃
脂肪烃
烃
分子中含有碳环的烃
按碳的骨架给烃分类?
【复习2】
脂肪烃?
什么是脂肪烃?
具有脂肪族化合物基本属性的碳氢化合物叫做脂肪烃。
分子中碳原子间连结成链状的碳架,两端张开而不成环的烃,叫做开链烃,简称链烃。因为脂肪具有这种结构,所以也叫做脂链烃。
有些环烃在性质上不同于芳香烃,而十分类似脂链烃,这类环烃叫脂环烃。这样,脂肪烃便成为除芳香烃以外的所有烃的总称。脂链烃和它的衍生物总称为脂肪族化合物,脂环烃及它的衍生物总称脂环族化合物。
自然界中的脂肪烃较少,但其衍生物则广泛存在,而且与生命有极密切的关系。如:樟脑—常用驱虫剂、 麝香— 常用中草药和冰片。
【复习3】
脂肪烃一般都是石油和天然气的重要成分。C1~C5低碳脂肪烃是石油化工的基本原料,尤其是乙烯、丙烯和C4、C5共轭烯烃,在石油化工中应用最多、最广。
分类方法。 ① 饱和脂肪烃 分子中无不饱和的键,碳原子间以碳碳单键相连,通式CnH2n+2。 ② 不饱和脂肪烃 分子中有不饱和键存在。
按不饱和键的不同又分为: 烯烃 含有碳碳双键 通式:有x个碳碳双键,CnH2n+2-2x 炔烃 含有碳碳叁键 通式:有x个碳碳三键,CnH2n+2-4x
烃和卤代烃等有机物的反应与无机物反应相比有其特点:
(1)反应缓慢。有机分子中的原子一般以共价键结合,有机反应是分子之间的反应。
(2)反应产物复杂。有机物往往具有多个反应部位,在生成主要产物的同时,往往伴有其他副产物的生成。
(3)反应常在有机溶剂中进行。有机物一般在水中的溶解度较小,而在有机溶剂中的溶解度较大。
【复习4】
【概念】
烷烃:仅含C—C键和C—H键的饱和链烃,又叫烷烃。(若C—C连成环状,称为环烷烃。)通式:CnH2n+2 (n≥1)
烯烃:分子里含有一个碳碳双键的不饱和链烃叫做烯烃。通式:CnH2n (n≥2)
(分子里含有两个双键的链烃叫做二烯烃)
一、 烷烃alkane和烯烃alkene
【思考与交流1】依据表2-1和表2-2绘制碳原子数与沸点或相对密度变化曲线图
1. 烷烃和烯烃同系物物性递变规律
丙烷 沸点 -42.2℃ 相对密度 0.582
直链烷烃数据
部分烯烃的沸点和相对密度 表2-2
请根据表中数据绘制曲线图(横坐标、纵坐标)
思考与交流(1) P28 碳原子数与沸点曲线图
碳原子数与沸点变化曲线图
碳原子数与密度变化曲线图
碳原子数与相对密度变化曲线图
相对密度
图2-1烷烃、烯烃的沸点随碳原子数变化曲线
图2-1
烷烃、烯烃同系物的相对密度随碳原子数的变化曲线
图2-2烷烃的相对密度随碳原子数变化曲线
图2-3 烯烃的相对密度随碳原子数变化曲线
【请归纳】烷烃和烯烃物理性质递变规律
【结论】烷烃和烯烃的物理性质随着分子中碳原子数的递增,呈规律性的变化。
同系物的沸点逐渐升高,相对密度逐渐增大,常温下的存在状态也由气态逐渐过渡到液态、固态。
【原因】对于结构相似的物质(分子晶体)来说,分子间作用力随相对分子质量的增大而逐渐增大;导致物理性质上的递变……
【说明】
① 所有烷烃均难溶于水,密度均小于1。
② 常温下烷烃的状态:
当C1~C4 时 呈气态;C5~C16时呈液态; C17以上时为固态。
③ 分子式相同的烃,支链越多,熔沸点越低。
④ 所有的烃都是无色物质,不溶于水而易溶于苯、乙醚等有机溶剂。
【练习】
1、由沸点数据:甲烷-146℃,乙烷-89℃,丁烷-0.5℃,戊烷36℃,可以判断丙烷的沸点可能是( )
A.高于-0.5℃ B.约是+30℃
C.约是-40℃ D.低于-89℃
2、下列烷烃沸点最高的是( )
A.CH3CH2CH3 B.CH3CH2CH2CH3
C.CH3(CH2)3CH3
D.(CH3)2CHCH2CH3
C
C
思考与交流(2) 谈无机与有机反应分类方法与思路
取代反应:有机物分子中某些原子或原子团被其它原子或原子团所代替的反应。
加成反应
加聚反应:通过加成反应聚合成高分子化合物的反应(加成聚合反应)。
加成反应:有机物分子中未饱和的碳原子跟其它原子或原子团直接结合生成别的物质的反应。
【思考与交流2】无机反应与有机反应类型的对比
化学反应──无论是无机化学反应和有机化学反应,其本质是相同的,都是构成分子的原子之间的重新组合或排列,在这一过程中必然伴随着旧化学键的断裂和新化学键的形成过程。
有机反应大多是分子反应,大多数无机反应为离子反应。
2. 烷烃和烯烃化学性质比较
【复习】基本有机反应类型——分子组成与结构
(1) 取代反应(substitution reaction):有机物分子里的某些原子或原子团被其他原子或原子团所取代的反应。如烃的卤代反应。
(2) 加成反应(addition reaction):有机物分子中双键(叁键)两端的碳原子与其他原子或原子团所直接结合生成新的化合物的反应。如不饱和碳原子与H2、X2、H2O的加成。
(3) 聚合反应(polymerization reaction):由相对分子质量小的化合物分子结合成相对分子质量较大的高分子化合物的反应。如加聚反应、缩聚反应。
【讨论】甲烷、乙烯的结构和性质的相似点和不同点,列表小结。
烷烃典型——取代;烯烃典型反应——加成、氧化、加聚
烷烃的化学性质
CnH2n+2
(1)通式:
(2)同系物:
分子结构相似,在分子组成上相差一个或若干个CH2原子团的物质,互称为同系物。
(3)化学性质
B 、氧化反应
A、通常状况下,它们很稳定,跟酸、碱及氧化物都不发生反应,也难与其他物质化合。
C 、取代反应
CnH2n+2 +(3n+1)/2 O2 nCO2 +(n+1)H2O
点燃
写出对应的化学方程式。
烷烃特征反应
其它烷烃与甲烷一样,一定条件下能发生取代反应。因为可以被取代的氢原子多,所以其它烷烃取代比甲烷复杂。
请写出乙烷、丙烷与氯气光照条件下的反应。
D 、热分解
由于其它烷烃的碳原子多,所以分解比甲烷复杂。
一般甲烷高温分解,长链烷烃高温裂化、裂解。
烷烃的裂化
烯烃的化学性质
(1)通式:
【乙烯分子的结构】乙烯与乙烷相比少两个氢原子。C原子为满足4个价键,碳碳键必须以双键存在。
请书写出乙烯分子的电子式和结构式 ?
书写注意事项和结构简式的正误书写:
正:CH2=CH2 H2C=CH2
误:CH2CH2
(2)化学性质:
(A)加成反应 ( 与H2、Br2、HX、H2O等)
使溴水褪色
△
大量实验事实表明:凡是不对称结构的烯烃和酸(HX)加成时,酸的负基(X-)主要加到含氢原子较少的双键碳原子上,这称为马尔科夫尼科夫规则,也就是马氏规则。
主产物
(B)氧化反应
①燃烧:
②催化氧化:
火焰明亮,冒黑烟。烯烃燃烧通式?
③与酸性KMnO4的作用:
使KMnO4溶液褪色
5CH2=CH2 + 12KMnO4 +18H2SO4
10CO2 ↑ + 12MnSO4 + 6K2SO4 + 28H2O
其它烯烃氧化反应
R—CH=CH2 R—COOH + CO2
使酸性KMnO4 溶液褪色
(C)加聚反应:
由相对分子质量小的化合物分子互相结合成相对分子质量大的高分子的反应叫做聚合反应。
由不饱和的相对分子质量小的化合物分子结合成相对分子质量大的化合物分子,这样的聚合反应同时也是加成反应,所以这样聚合反应又叫做加聚反应。
【练习】请写出CH3CH=CH2分别与H2、Br2、HBr、H2O发生加成反应及加聚的化学方程式。
单体?
链节?
聚合度?
聚丙烯
聚丁烯
【归纳】烷烃、烯烃的结构和性质
分子结构相似的物质在化学性质上也相似.
完成【学与问】 P30
烃的类别 分子结构
特点 代表物质 主要化学
性质
烷烃 全部单键、饱和 CH4 燃烧、取代、热分解
烯烃 有碳碳双键、不饱和 CH2=CH2 燃烧、与强氧化剂反应、加成、加聚
三位科学家因在烯烃复分解反应研究中的杰出贡献而荣获2005年度诺贝尔化学奖,烯烃复分解反应可示意如下:
下列化合物中,经过烯烃复分解反应可以生成
【 练习2】
A
已知: ,如果要合成
所用的原始原料可以是
A. 2 -甲基-l,3 -丁二烯和2 -丁炔
B.1,3 -戊二烯和2 -丁炔
C.2,3 -二甲基-1,3 -戊二烯和乙炔
D. 2,3 -二甲基-l,3 -丁二烯和丙炔
【 练习3】
AD
CnH2n-2 (n≧4)
代表物:
1,3-丁二烯 CH2=CH-CH=CH2
2、二烯烃的通式:
2-甲基-1,3-丁二烯
也可叫作:异戊二烯
【思考】 1,3-丁二烯分子中最少有多少个C原子在同一平面上?最多可以有多少个原子在同一平面上?
1、概念:含有两个碳碳双键(C=C)的不饱和链烃。
二、 二烯烃性质
两个双键在碳链中的不同位置:
C—C=C=C—C ①累积二烯烃(不稳定)
C=C—C=C—C ②共轭二烯烃
C=C—C—C=C ③孤立二烯烃
3、类别:
4、二烯烃的化学性质
氧化、加成、加聚
与烯烃相似:
【思考】当1molCH2=CH-CH=CH2与1molBr2或Cl2加成时,其加成产物是什么?
CH2=CH-CH=CH2+2Br2
CH2=CH-CH=CH2+Br2
1,2 加成
1,4 加成
1,2 Br
1,4 Br
(主产物)
(中间体)
3,4-二溴-1-丁烯
1,4-二溴-2-丁烯
(1)1,2-加成 和 1,4-加成反应
加成反应——键线表示
1 2 3 4
(1,3-丁二烯)
聚1,3-丁二烯
(2)加聚反应
俗称:异戊二烯 聚异戊二烯
学名:2-甲基-1,3-丁二烯 (天然橡胶)
写出下列物质发生加聚反应的化学方程式
分析:加聚反应产物及单体
(1)乙烯型
CH2=CH2
聚合物:
单 体:
(2)1,3-丁二烯型
单体:
单体:
CH2=CH-CH=CH2
聚合物:
聚合物:
(3)混合型
CH2=CH-CH=CH2
单 体:
混合型:
【思考】
2-丁烯 中,与碳碳双键相连的两个碳原子、两个氢原子是否处于同一平面?
如处于同一平面,与碳碳双键相连的两个碳原子是处于双键的同侧还是异侧?
CH3CH=CHCH3
5、烯烃的顺反异构现象
H
H
CH3
CH3
CH3
CH3
H
H
反式异构
顺式异构
如果每个双键碳原子连接了两个不同的原子
或原子团,双键上的4个原子或原子团在空间就有两种不同的排列方式,产生两种不同的异构,
即顺反异构 。
(1)异构现象的产生:
由于碳碳双键不能旋转而导致分子中原子或原子团在空间的排列方式不同所产生的异构现象,称为顺反异构。
(2)产生顺反异构体的条件:
双键两端的同一个碳原子上不能连有相同基团。只有这样才会产生顺反异构体。即a’ ? b’,a ? b ,且 a = a’、b = b’ 至少有一个存在。
顺式结构:两个相同的原子或原子团排列在双键的同一侧。
反式结构:两个相同的原子或原子团排列在双键的两侧。
(3)异构的分类
顺式结构和反式结构的两种烯烃化学性质基本相同,物理性质有一定差异。
(4)顺反异构体的性质
烯烃的同分
异构现象
碳链异构
位置异构
官能团异构
顺反异构 ——空间异构
【思考】烷烃是否也有顺反异构现象?
烷烃分子中的碳碳单键可以旋转,所以不会产生有顺反异构现象。
【例题】下列物质中没有顺反异构的是:
A.1,2-二氯乙烯
B.1,2-二氯丙烯
C.2-甲基-2-丁烯
D.2-氯-2-丁烯
【思考】2-丁炔有顺反异构吗?
×
√
√
√
不存在顺反异构现象,线形分子不具备构成的条件。
形成顺反异构的条件:
1.具有碳碳双键
2.组成双键的每个碳原子必须连接
两个不同的原子或原子团.
【例1】某有机物含碳85.7%,含氢14.3%,向80g含溴5%的溴水中通入该有机物,溴水刚好完全褪色 ,此时液体总质量81.4g,
求:①有机物分子式
②经测定,该有机物分子中有两个-CH3。 写出它的结构简式。
练习:
分子式 :
C4H8
两种位置异构:
CH3-CH=CH-CH3或
该有机物能使溴水褪色,说明该有机物中含有不饱和键;
该有机物:
n(C) :n(H)=
所以该有机物为烯烃
1.4g该有机物可与0.025molBr2反应
= 0.025mol
= 1:2
分析:
例2
下列哪些物质存在顺反异构?
(A)1,2-二氯丙烯 (B) 2-丁烯
(C) 丙烯 (D) 1-丁烯
AB
(1)丁烯的碳链和位置异构:
CH2=CH-CH2-CH3 CH3 CH=CHCH3
1-丁烯 2-丁烯
(1) (2)
(1),(2)是双键位置异构。
例3:写出丁烯的同分异构体。
【例4】通常,烷烃可以由相应的烯烃催化加氢得到。但是有一种烷烃A,分子式为C9H20,它却不能由任何C9H18的烯烃催化加氢得到。而另有A的三个同分异构体B1、B2、B3,却分别可由而且只能由1种自己相应的烯烃催化加氢得到。A、B1、B2、B3的结构简式分别 , ,
, 。
A: (CH3)3C-CH2-C(CH3)3
B1: (CH3)3C-C(CH3)2-CH2-CH3
B2: (CH3)2-CH-C(CH3)2-CH- (CH3)2
B3: C(CH2-CH3)4
【烃类的几个重要规律及应用】
1、【规律1】烃分子含氢原子数恒为偶数,其相对分子质量恒为偶数。
【应用】如果求得的烃分子所含氢原子数为奇数或相对分子质量为奇数,则求算一定有错。
2、烃燃烧前后气体体积变化规律:
【思考】常温常压下, 某气态烃和氧气的混和物aL,经点燃且完全燃烧后, 得到bL气体(常温常压下),则a和b的大小关系为( )
A. a=b B. a>b
C. aB
【规律2】在100℃以下,任何烃和氧气的混和物完全燃烧,反应后气体体积都是减小的。
【思考】120℃时,某烃和O2混合,完全燃烧后恢复到原来的温度和压强,气体体积减小,该烃是( )
A. CH4 B. C2H4
C. C2H2 D. C2H6
【规律3】
气态烃(CxHy)在100℃及其以上温度完全燃烧时,气体体积变化只与氢原子个数有关: ①若y=4,燃烧前后体积不变,△V=0 ②若y>4,燃烧前后体积增大,△V>0 ③若y<4,燃烧前后体积减少,△V<0 (只有乙炔)
C
燃烧前后气体的体积大小变化规律
原理:
烃的燃烧通式为:
CxHy + (x+y/4)O2 →xCO2 + y/2 H2O
反应前后气体的体积的变化量为
△V=(x+y/2) – (1+x+y/4) = y/4 – 1,
显然, y=4时, △V=0
y>4时, △V>0
y<4时, △V<0
3、烃完全燃烧时耗氧量的规律
烃燃烧的化学方程式:
CxHy + (x+y/4)O2 → xco2 + y/2H2O
等物质的量的烃完全燃烧耗氧量比较的规律:
【 规律4】对于等物质的量的任意烃(CxHy) ,完全燃烧,耗氧量的大小取决于(x+y/4) 的值的大小,该值越大,耗氧量越多。
【例题】等物质的量的CH4, C2H4, C2H6, C3H4, C3H6 完全燃烧,耗氧量最大的是哪个?
解:根据等物质的量的任意烃,完全燃烧,耗氧量的大小取决于(x+y/4) 的值的大小,该值越大,耗氧量越多。
得到C3H6中, (x+y/4)的值最大,所以, C3H6的耗氧量最多。
等质量的烃完全燃烧耗氧量比较的规律:
【例题】等质量的CH4, C2H4, C2H6, C3H4, C3H6完全燃烧,耗氧量最大的是哪个?
【规律5】对于质量的任意烃,完全燃烧,耗氧量的大小取决于( y/x) 的值的大小,该值越大,耗氧量越多。
解:根据上述规律,得到结论( y/x)值越大,耗氧量越多,则对于质量的上述烃,完全燃烧CH4的耗氧量最多。
总结:等质量各类烃完全燃烧,耗O2量关系
【应用】等质量的烷烃随碳原子个数的增大,消耗O2的量 (填“增大” 、“减小”或“不变”)。
等质量的具有相同最简式的有机物完全燃烧时,耗O2量,生成CO2量、H2O量均分别相同。
最简式相同的有机物无论以何种比例混合,只要总质量一定,耗O2量、生成CO2量、H2O量均为定值。
【思考】 等质量的CnH2n O 和CmH2m O 2分别完全燃烧时,消耗O2的量相等,则n和m的数学关系为 。
【规律6】
【规律】:
两种有机物,无论最简式是否相同,只要C%相同,等质量完全燃烧时,生成的CO2量相等。同理若H%相同,则生成的H2O 量相等。但耗O2量未必相同。
如何寻找符合这些特征的有机物分子呢?
有机化合物A、B分子式不同,它们只可能含碳、氢、氧元素中的两种或三种。如果将A、B不论以何种比例混合,只要其质量之和不变,完全燃烧时所消耗的氧气和生成的二氧化碳的质量也不变。那么,A、B组成必须满足的条件是 。
若A是甲醛,则符合上述条件的化合物B中,相对分子质量最小的是?写出分子式? ,并写出相对分子质量最小的不含甲基(?CH3)的B的1种同分异构体结构简式: 。
应用:
4、各类烃含碳(或氢)的质量分数变化
各类烃C%、H%(均为质量分数)随C原子数n的变化图示
【规律7】
烷烃:随着n的增大,含碳质量分数增大,但总是小于85.7%。甲烷是含氢质量分数最高的,也是所有烃中含氢质量分数最高的。
烯烃:含碳质量分数是不变的。85.7%
炔烃:随着n的增大,含碳质量分数减小,但总是大于85.7%。乙炔是含碳量最高的,达到92.3%
苯及其同系物:随着n的增大,含碳质量分数减小,但总是大于85.7%。
注意:
①在各类烃中H%最高的是CH4,其次为C2H6。
②在上述各类烃中C%最高的是C2H2、C6H6,除此外还有C8H8(如立方烷) 。
③在所有烃中并非是最简式CH的烃C%最高的.如还有C10H8(萘)更高。
商余法确定分子式
【原理】对于任意的烃( CxHy ),其相对分子量为M=12x+y,则M/12=x+y/12, 显然,x为商(C原子数目),y为余数(H原子数目)。从而推断出烃的分子式。
例:下列数值都是烃的相对分子质量,其对应的烃一定为烷烃的是( )
A.44 B.42 C.54 D.128
解析:44/12=3余8, 则该烃是C3H8
128/12=10余8,则该烃是C10H8
=9余20,则该烃是C9H20
A
