2020年浙教版科学中考解答题汇编一(化学)
文档属性
| 名称 | 2020年浙教版科学中考解答题汇编一(化学) |
|
|
| 格式 | zip | ||
| 文件大小 | 120.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2020-02-07 00:00:00 | ||
图片预览



文档简介
2020浙教版科学中考解答题汇编一(化学)
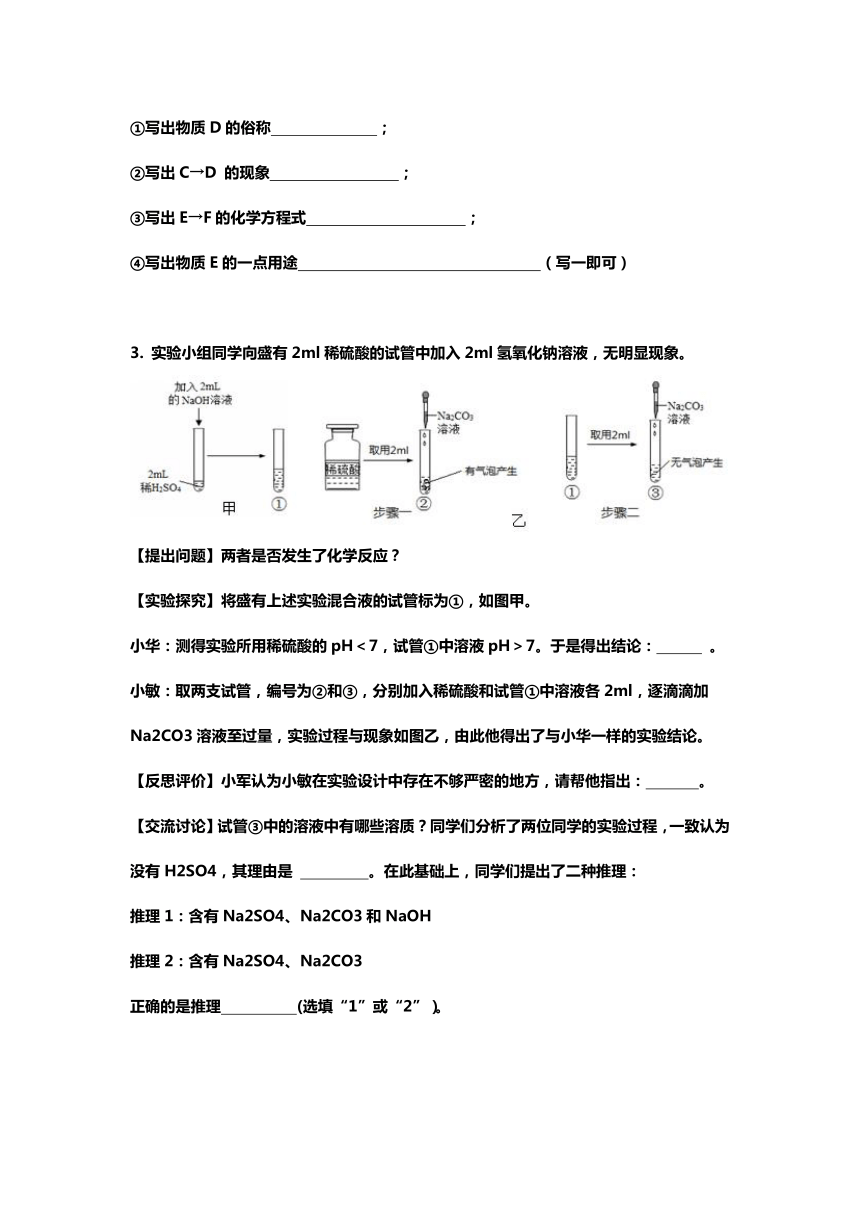
1. 敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质.现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡.如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况.
(1)写出氢氧化钠溶液变质的化学方程式________.
(2)图中线段BC对应的实验现象是________.
(3)图中B点时溶液中的溶质是________.
2. 实验课上同学们对酸碱盐的性质作了如下探究.
(1)小海探究了中和滴定实验,操作如图甲所示,当他观察到 ,说明恰好完全反应.写出反应的化学方程式 .
(2)小郝对一瓶敞口放置的氢氧化钠溶液产生兴趣,他想探究该溶液是否完全变质.取样后先加入 ,有白色沉淀生成.过滤.滤液中加入无色酚酞溶液,观察到溶液变红,他推断该氢氧化钠溶液部分变质.
(3)小亮则根据所学知识绘制了如图1所示物质间关系网络图,并做了相关实验.(“-”表示相连的两种物质能发生反应,“→”表示某物质可以转化为另一种物质.)已知A为胃酸的主要成分,B是贝壳的主要成分,D微溶于水,A与F反应生成气体.
①写出物质D的俗称 ;
②写出C→D 的现象 ;
③写出E→F的化学方程式 ;
④写出物质E的一点用途 (写一即可)
3. 实验小组同学向盛有2ml稀硫酸的试管中加入2ml氢氧化钠溶液,无明显现象。
【提出问题】两者是否发生了化学反应?
【实验探究】将盛有上述实验混合液的试管标为①,如图甲。
小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7。于是得出结论: 。
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2ml,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论。
【反思评价】小军认为小敏在实验设计中存在不够严密的地方,请帮他指出: 。
【交流讨论】试管③中的溶液中有哪些溶质?同学们分析了两位同学的实验过程,一致认为没有H2SO4,其理由是 。在此基础上,同学们提出了二种推理:
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理 (选填“1”或“2”)。
4. 复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个探究实验.
探究1:研究常见物质组成
A、B、C都是研究物质组成的实验.从研究方法得知,A实验 ,使瓶内 推测空气里氧气含量的.B实验是通过证明 来推断水的组成的.而C实验与B(填实验代号)实验的方法相同.
探究2:研究常见物质性质
探索:根据设计方案,小英向试管中加入2mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显红色.然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色.
(1)他们探究的问题是 (填Ⅰ或Ⅱ)
Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?
Ⅱ.酸和碱溶液能发生反应吗?
(2)验证:大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是 .
5.CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质.
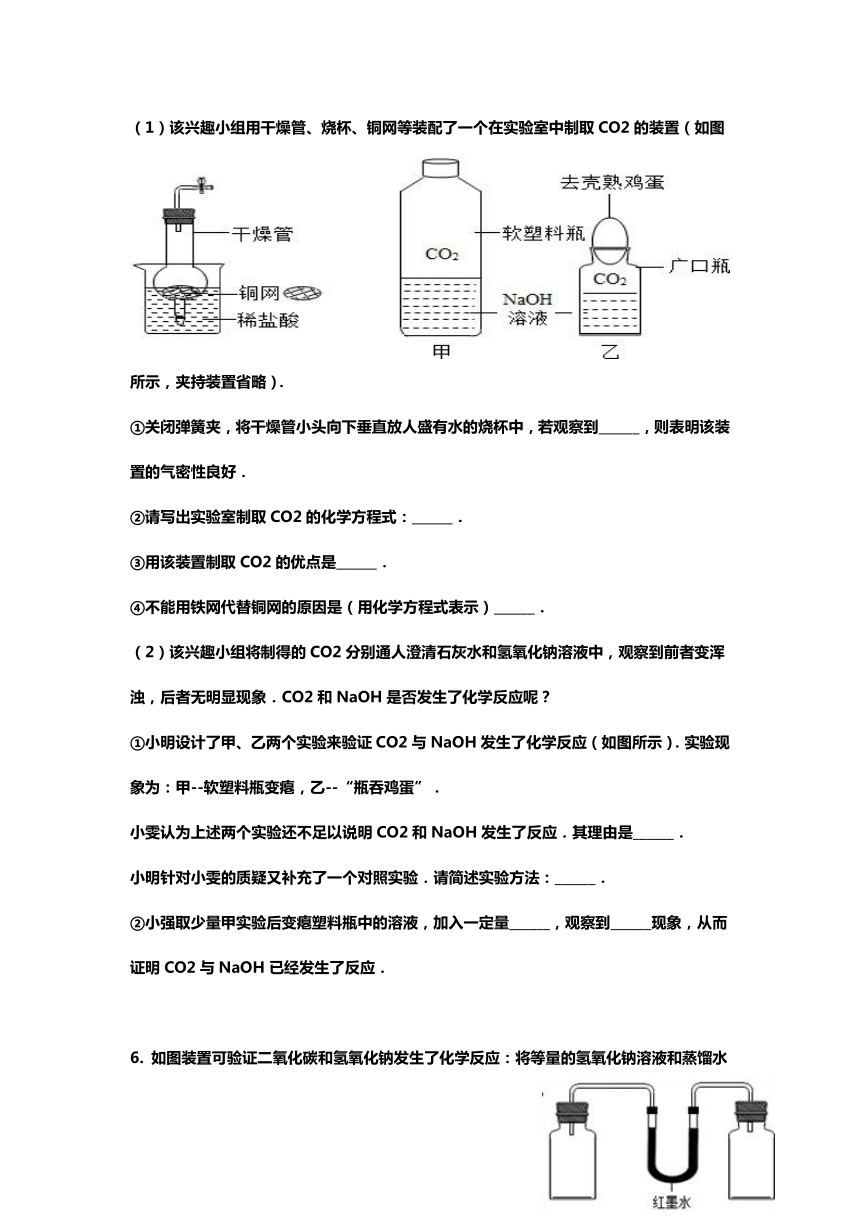
(1)该兴趣小组用干燥管、烧杯、铜网等装配了一个在实验室中制取CO2的装置(如图所示,夹持装置省略).
①关闭弹簧夹,将干燥管小头向下垂直放人盛有水的烧杯中,若观察到______,则表明该装置的气密性良好.
②请写出实验室制取CO2的化学方程式:______.
③用该装置制取CO2的优点是______.
④不能用铁网代替铜网的原因是(用化学方程式表示)______.
(2)该兴趣小组将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.CO2和NaOH是否发生了化学反应呢?
①小明设计了甲、乙两个实验来验证CO2与NaOH发生了化学反应(如图所示).实验现象为:甲--软塑料瓶变瘪,乙--“瓶吞鸡蛋”.
小雯认为上述两个实验还不足以说明CO2和NaOH发生了反应.其理由是______.
小明针对小雯的质疑又补充了一个对照实验.请简述实验方法:______.
②小强取少量甲实验后变瘪塑料瓶中的溶液,加入一定量______,观察到______现象,从而证明CO2与NaOH已经发生了反应.
6. 如图装置可验证二氧化碳和氢氧化钠发生了化学反应:将等量的氢氧化钠溶液和蒸馏水分别加入两瓶等量二氧化碳气体中,用U型管连接.充分反应后放在水平桌面上可观察到U型管中液面出现高度差.
(1)室温下利用此装置,你还可以研究 .
A.比较氧气和二氧化碳在水中的溶解能力
B.比较氯酸钾和氯化钠在水中的溶解能力
C.比较饱和氢氧化钠和氢氧化钙溶液吸收二氧化碳气体的能力
(2)进一步思考、迁移:有 .
7.(中考真题)氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质。今年以来,化工原料市场供不应求,各种化工原料价格持续上扬。某化工厂为了增加效益,计划将一批库存的氢氧化钠投入市场。如果你是质检员,请你按以下方案抽取样品对该批氢氧化钠进行检验,看是否变质。
【实验方案】
【推断和结论】(1)若现象a为有气泡产生,则加入的A溶液可能是________,说明氢氧化钠已经变质。
(2)为了进一步探究该产品变质的程度,再取少量样品,加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该批产品_________(填“部分”或“完全”)变质。
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示)__________________。
8. 在日常生活中,有这样的说法,“肥皂水是碱性的,洗衣粉溶液是酸性的”.这种说法正确吗?肥皂和洗衣粉混用会降低去污效果吗?某科学兴趣小组对此进行了探究,实验过程如下:
①取三个塑料杯,分别编为甲、乙、丙,在甲杯中加入5克洗衣粉、乙杯中加入5克肥皂、丙杯中加入2.5克洗衣粉和2.5克肥皂.
②在三个塑料杯中,分别加入相同温度、相同质量的水,充分搅拌使之完全溶解,并测出溶液pH.
③在相同温度下,将三块大小、油污程度均相同的白棉布分别放入三杯溶液中浸泡10分钟后,取出观察,实验结果记录如下:
甲 乙 丙
洗涤前洗涤剂溶液pH 10 8 9
去污效果 基本去除油污 基本去除油污 基本去除油污
换另一种品牌洗衣粉和肥皂做同样实验,实验结果记录如下:
甲 乙 丙
洗涤前洗涤剂溶液pH 8 9 9
去污效果 完全去除油污 完全去除油污 完全去除油污
根据上述实验,回答下列问题:
(1)“肥皂水是碱性的,洗衣粉溶液是酸性的”,这种说法正确吗?______(选填“正确”或“不正确”).
(2)将肥皂和洗衣粉混合使用会降低去污效果吗?______(选填“会”或“不会”).
(3)为什么要换另一种品牌洗衣粉和肥皂重复同样的实验?______.
2020浙教版科学中考解答题汇编一答案
1. 解:(1)氢氧化钠与二氧化碳反应会生成碳酸钠与水.化学方程式为:2NaOH+CO2═Na2CO3+H2O
(2)从图象可以看出,溶液在AB段质量增加的比BC段要快,所以可以判断AB是中和反应,BC段是盐酸与碳酸钠的反应,这是由于二氧化碳的产生溶液质量增加放缓,两物质反应的现象是有气泡产生;
(3)到达B点时溶液中氢氧化钠和盐酸的反应结束,而此时碳酸钠尚未参加反应.所以溶质为氯化钠和碳酸钠.
故答案为:(1)CO2+2NaOH═Na2CO3+H2O;
(2)有气泡生成;
(3)氯化钠和碳酸钠
分析:氢氧化钠与二氧化碳反应会生成碳酸钠与水,溶液反应时一开始是酸碱中和溶液质量增加,中和完成后会是碳酸钠与盐酸的反应,溶液由于释放出二氧化碳溶液质量增加放缓,至C点反应正好结束.
点评:此题是一道酸碱盐之间的问题考查题,解题的关键是掌握烧碱的变质,以及盐酸与氢氧化钠及碳酸钠的反应,属基础性知识考查题.
2. 分析:(1)氢氧化钠和盐酸反应生成的中性的氯化钠溶液,而酚酞只有在碱性溶液才能变红,可以据此解答该题;
(2)氢氧化钠溶液变质后的产物为碳酸钠,所以可以加入过量的氯化钙溶液来进行检验,可以据此解答该题;
(3)A为胃酸的主要成分,可以知道A盐酸,B是贝壳的主要成分,可以知道B为碳酸钙;A与F反应生成气体,且F能够反应生成B,所以可以判断F可以为碳酸钠,而D微溶于水,可以判断D为氢氧化钙,所以C为氧化钙,D能够通过反应生成E,且E能够通过反应生成F,所以可以判断E为氢氧化钾,带入验证,符合题意,可以据此解答该题.
解答:解:(1)氢氧化钠和盐酸反应生成的中性的氯化钠溶液,而酚酞只有在碱性溶液才能变红,所以当小海进行如图甲所示的操作时,当他观察到溶液的红色消失说明恰好完全反应.该反应的化学方程式为:NaOH+HCl═NaCl+H2O;
(2)氢氧化钠溶液变质后的产物为碳酸钠,所以可以加入过量的氯化钙溶液来进行检验,碳酸钠和氯化钙溶液反应生成了白色沉淀;
(3)①A为胃酸的主要成分,可以知道A盐酸,B是贝壳的主要成分,可以知道B为碳酸钙;A与F反应生成气体,且F能够反应生成B,所以可以判断F可以为碳酸钠,而D微溶于水,可以判断D为氢氧化钙,所以C为氧化钙,D能够通过反应生成E,且E能够通过反应生成F,所以可以判断E为氢氧化钾,根据上述分析可以知道D为氢氧化钙,其俗名为熟石灰;
②C为氧化钙,氧化钙和水反应生成了氢氧化钙,该反应中放出大量的热;
③E为氢氧化钠,氢氧化钠和二氧化碳反应生成了碳酸钠,所以E→F的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
④E为氢氧化钠,其用途非常广泛,例如制肥皂、石油工业、造纸、纺织工业、印染等.
故答案为:(1)溶液恰好变为无色;NaOH+HCl═NaCl+H2O;
(2)过量的CaCl2;
(3)①熟石灰;
②放热;
③2NaOH+CO2=Na2CO3+H2O;
④制肥皂、石油工业、造纸、纺织工业、印染等(写一即可).
点评:在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.
3. (1)两者发生了反应; (2)应取用试管①中的全部溶液与2ml稀硫酸做比对实验;(3)试管①溶液pH大于7(H2SO4已经反应完或试管③中滴入Na2CO3无气泡); (4) l
解析试题分析: (1)因为稀硫酸的pH<7,而试管①中溶液pH>7,说明稀硫酸已经消失了,故可得出结论为稀硫酸与氢氧化钠发生了反应; (2) 应取用试管①中的全部溶液与2ml稀硫酸做比对实验;(3)试管③中加入碳酸钠后没有气泡产生,说明溶液中没有硫酸;(4)因为试管①溶液pH大于7,说明有氢氧化钠存在,并且不与碳酸钠反应,故试管③中的溶液中的溶质有氢氧化钠、碳酸钠及生成的硫酸钠。
考点: 科学探究;实验方案的设计与评价;溶液的酸碱度;酸的性质
4. 解:探究1:
A、B、C都是研究物质组成的实验.从研究方法得知,A实验是利用可燃物消耗瓶内的氧气,使瓶内压强减小来推测空气里氧气含量的.B实验是通过证明生成物的元素组成来推断水的组成的.而C实验与B实验的方法相同.
故填:氧气;元素组成;B.
探究2:
(1)他们探究的问题是酸和碱溶液能发生反应吗?
故填:Ⅱ.
(2)验证:大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是硫酸钠和硫酸.
故填:硫酸钠和硫酸.
5. 解:(1)①关闭弹簧夹,将干燥管小头向下垂直放人盛有水的烧杯中,若观察到无水进入干燥管,则证明装置的密封性良好.
②该反应的反应物为碳酸钙与稀盐酸,生成物是氯化钙、水、二氧化碳,根据化学方程式的书写规则,该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
③该装置可以控制稀盐酸与石灰石的接触与脱离,反应物接触时反应发生,反应物脱离接触时反应停止,可随时控制反应的发生和停止.
④稀盐酸可以和铁反应但不能和铜反应,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
(2)①由于二氧化碳能和氢氧化钠溶液中的氢氧化钠发生反应从而导致瓶内压强减小,因此瓶子变瘪或出现瓶吞鸡蛋现象,但二氧化碳也能溶于水,也能使瓶内压强减小,因此小明的实验就缺乏足够的说服力,为了使实验有足够的说服力,可以做对照实验,将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别.
②为了证明二氧化碳能和氢氧化钠反应,除了设计有明显实验现象的实验外,也可以证明有新物质生成,即证明碳酸钠的生成.即取少量甲实验后变瘪塑料瓶中的溶液,加入一定量稀盐酸,若观察到有气泡产生的现象,就可证明CO2与NaOH已经发生了反应
故答案为:(1)①无水进入干燥管;②CaCO3+2HCl═CaCl2+H2O+CO2↑;③可随时控制反应的发生和停止;④Fe+2HCl=FeCl2+H2↑
(2)①CO2能溶于水,也能使瓶内气压减小;②将氢氧化钠溶液换成等体积的水,做对比实验,②稀盐酸,有气泡产生.
分析:抓住实验室中制取二氧化碳的有关知识和二氧化碳的有关性质:二氧化碳能与氢氧化钠反应、二氧化碳能溶于水.
点评:根据实验装置的不同之处分析出它的不同的仪器的作用,再进行横向比较,得出结论.
6. (1)A、C;
(2)气压(或气体体积)
7. 1)稀盐酸(稀硫酸或其它合理答案均可得分)
(2)部分;2NaOH+CO2==Na2CO3+H2O
8. 解:首先从洗涤前洗涤剂溶液的pH分析,可以发现三组的pH均大于7,则可判断洗涤剂溶液均为碱性,那么在日常生活中“肥皂水是碱性的,洗衣粉溶液是酸性的”说法是不正确的.然后对比三组pH的变化趋势和去污效果,可以得出,肥皂和洗衣粉可以混合使用,也不会降低洗涤剂的去污效果.
第二次重复实验选择另一品牌洗涤剂,其目的是为了借助同样的实验来排除实验的偶然性,增加实验结果的可靠性.
故答案为:(1)不正确;(2)不会; (3)排除实验的偶然性,增加实验结果的可靠性.
分析:溶解酸碱性与pH的关系:pH>7时,溶液呈碱性,且pH越大碱性越强;pH=7时,溶液呈中性;pH<7时,溶液呈酸性,且pH越小酸性越强;根据溶解酸碱性与pH的关系及实验探究所得到实验数据,对猜想中的问题进行分析与判断.
点评:考查学生对“溶液酸碱性判断”这部分知识的掌握程度,考查学生分析问题、解决问题的综合能力和表达能力的同时,把科学探究的过程与基本方法,通过试题的形式介绍给学生,增进对科学探究的理解.
1. 敞口放置的氢氧化钠溶液易吸收空气中的二氧化碳而变质.现向一定质量且部分变质的氢氧化钠溶液中逐滴加入稀盐酸,并振荡.如图表示反应过程中溶液质量随加入盐酸质量的变化而变化的情况.
(1)写出氢氧化钠溶液变质的化学方程式________.
(2)图中线段BC对应的实验现象是________.
(3)图中B点时溶液中的溶质是________.
2. 实验课上同学们对酸碱盐的性质作了如下探究.
(1)小海探究了中和滴定实验,操作如图甲所示,当他观察到 ,说明恰好完全反应.写出反应的化学方程式 .
(2)小郝对一瓶敞口放置的氢氧化钠溶液产生兴趣,他想探究该溶液是否完全变质.取样后先加入 ,有白色沉淀生成.过滤.滤液中加入无色酚酞溶液,观察到溶液变红,他推断该氢氧化钠溶液部分变质.
(3)小亮则根据所学知识绘制了如图1所示物质间关系网络图,并做了相关实验.(“-”表示相连的两种物质能发生反应,“→”表示某物质可以转化为另一种物质.)已知A为胃酸的主要成分,B是贝壳的主要成分,D微溶于水,A与F反应生成气体.
①写出物质D的俗称 ;
②写出C→D 的现象 ;
③写出E→F的化学方程式 ;
④写出物质E的一点用途 (写一即可)
3. 实验小组同学向盛有2ml稀硫酸的试管中加入2ml氢氧化钠溶液,无明显现象。
【提出问题】两者是否发生了化学反应?
【实验探究】将盛有上述实验混合液的试管标为①,如图甲。
小华:测得实验所用稀硫酸的pH<7,试管①中溶液pH>7。于是得出结论: 。
小敏:取两支试管,编号为②和③,分别加入稀硫酸和试管①中溶液各2ml,逐滴滴加Na2CO3溶液至过量,实验过程与现象如图乙,由此他得出了与小华一样的实验结论。
【反思评价】小军认为小敏在实验设计中存在不够严密的地方,请帮他指出: 。
【交流讨论】试管③中的溶液中有哪些溶质?同学们分析了两位同学的实验过程,一致认为没有H2SO4,其理由是 。在此基础上,同学们提出了二种推理:
推理1:含有Na2SO4、Na2CO3和NaOH
推理2:含有Na2SO4、Na2CO3
正确的是推理 (选填“1”或“2”)。
4. 复习时,常用专题探究的方法学习常见物质的组成、性质与制取,课堂上老师引导我们回顾了几个探究实验.
探究1:研究常见物质组成
A、B、C都是研究物质组成的实验.从研究方法得知,A实验 ,使瓶内 推测空气里氧气含量的.B实验是通过证明 来推断水的组成的.而C实验与B(填实验代号)实验的方法相同.
探究2:研究常见物质性质
探索:根据设计方案,小英向试管中加入2mL氢氧化钠溶液,滴入几滴酚酞溶液,溶液显红色.然后她又用滴管连续滴入一定量的稀硫酸,溶液由红色变为无色.
(1)他们探究的问题是 (填Ⅰ或Ⅱ)
Ⅰ.酚酞溶液遇酸、碱溶液能显示不同颜色吗?
Ⅱ.酸和碱溶液能发生反应吗?
(2)验证:大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是 .
5.CO2是初中化学重点研究的气体之一.某化学兴趣小组设计了如下实验来探究CO2的制取和性质.
(1)该兴趣小组用干燥管、烧杯、铜网等装配了一个在实验室中制取CO2的装置(如图所示,夹持装置省略).
①关闭弹簧夹,将干燥管小头向下垂直放人盛有水的烧杯中,若观察到______,则表明该装置的气密性良好.
②请写出实验室制取CO2的化学方程式:______.
③用该装置制取CO2的优点是______.
④不能用铁网代替铜网的原因是(用化学方程式表示)______.
(2)该兴趣小组将制得的CO2分别通人澄清石灰水和氢氧化钠溶液中,观察到前者变浑浊,后者无明显现象.CO2和NaOH是否发生了化学反应呢?
①小明设计了甲、乙两个实验来验证CO2与NaOH发生了化学反应(如图所示).实验现象为:甲--软塑料瓶变瘪,乙--“瓶吞鸡蛋”.
小雯认为上述两个实验还不足以说明CO2和NaOH发生了反应.其理由是______.
小明针对小雯的质疑又补充了一个对照实验.请简述实验方法:______.
②小强取少量甲实验后变瘪塑料瓶中的溶液,加入一定量______,观察到______现象,从而证明CO2与NaOH已经发生了反应.
6. 如图装置可验证二氧化碳和氢氧化钠发生了化学反应:将等量的氢氧化钠溶液和蒸馏水分别加入两瓶等量二氧化碳气体中,用U型管连接.充分反应后放在水平桌面上可观察到U型管中液面出现高度差.
(1)室温下利用此装置,你还可以研究 .
A.比较氧气和二氧化碳在水中的溶解能力
B.比较氯酸钾和氯化钠在水中的溶解能力
C.比较饱和氢氧化钠和氢氧化钙溶液吸收二氧化碳气体的能力
(2)进一步思考、迁移:有 .
7.(中考真题)氢氧化钠是重要的化工原料,在保存的过程中如果密封不严容易变质。今年以来,化工原料市场供不应求,各种化工原料价格持续上扬。某化工厂为了增加效益,计划将一批库存的氢氧化钠投入市场。如果你是质检员,请你按以下方案抽取样品对该批氢氧化钠进行检验,看是否变质。
【实验方案】
【推断和结论】(1)若现象a为有气泡产生,则加入的A溶液可能是________,说明氢氧化钠已经变质。
(2)为了进一步探究该产品变质的程度,再取少量样品,加入的A是过量的CaCl2溶液(CaCl2溶液呈中性),现象a为有白色沉淀,现象b为无色酚酞试液变红色,则证明该批产品_________(填“部分”或“完全”)变质。
【反思】久置的氢氧化钠变质的原因是(用化学方程式表示)__________________。
8. 在日常生活中,有这样的说法,“肥皂水是碱性的,洗衣粉溶液是酸性的”.这种说法正确吗?肥皂和洗衣粉混用会降低去污效果吗?某科学兴趣小组对此进行了探究,实验过程如下:
①取三个塑料杯,分别编为甲、乙、丙,在甲杯中加入5克洗衣粉、乙杯中加入5克肥皂、丙杯中加入2.5克洗衣粉和2.5克肥皂.
②在三个塑料杯中,分别加入相同温度、相同质量的水,充分搅拌使之完全溶解,并测出溶液pH.
③在相同温度下,将三块大小、油污程度均相同的白棉布分别放入三杯溶液中浸泡10分钟后,取出观察,实验结果记录如下:
甲 乙 丙
洗涤前洗涤剂溶液pH 10 8 9
去污效果 基本去除油污 基本去除油污 基本去除油污
换另一种品牌洗衣粉和肥皂做同样实验,实验结果记录如下:
甲 乙 丙
洗涤前洗涤剂溶液pH 8 9 9
去污效果 完全去除油污 完全去除油污 完全去除油污
根据上述实验,回答下列问题:
(1)“肥皂水是碱性的,洗衣粉溶液是酸性的”,这种说法正确吗?______(选填“正确”或“不正确”).
(2)将肥皂和洗衣粉混合使用会降低去污效果吗?______(选填“会”或“不会”).
(3)为什么要换另一种品牌洗衣粉和肥皂重复同样的实验?______.
2020浙教版科学中考解答题汇编一答案
1. 解:(1)氢氧化钠与二氧化碳反应会生成碳酸钠与水.化学方程式为:2NaOH+CO2═Na2CO3+H2O
(2)从图象可以看出,溶液在AB段质量增加的比BC段要快,所以可以判断AB是中和反应,BC段是盐酸与碳酸钠的反应,这是由于二氧化碳的产生溶液质量增加放缓,两物质反应的现象是有气泡产生;
(3)到达B点时溶液中氢氧化钠和盐酸的反应结束,而此时碳酸钠尚未参加反应.所以溶质为氯化钠和碳酸钠.
故答案为:(1)CO2+2NaOH═Na2CO3+H2O;
(2)有气泡生成;
(3)氯化钠和碳酸钠
分析:氢氧化钠与二氧化碳反应会生成碳酸钠与水,溶液反应时一开始是酸碱中和溶液质量增加,中和完成后会是碳酸钠与盐酸的反应,溶液由于释放出二氧化碳溶液质量增加放缓,至C点反应正好结束.
点评:此题是一道酸碱盐之间的问题考查题,解题的关键是掌握烧碱的变质,以及盐酸与氢氧化钠及碳酸钠的反应,属基础性知识考查题.
2. 分析:(1)氢氧化钠和盐酸反应生成的中性的氯化钠溶液,而酚酞只有在碱性溶液才能变红,可以据此解答该题;
(2)氢氧化钠溶液变质后的产物为碳酸钠,所以可以加入过量的氯化钙溶液来进行检验,可以据此解答该题;
(3)A为胃酸的主要成分,可以知道A盐酸,B是贝壳的主要成分,可以知道B为碳酸钙;A与F反应生成气体,且F能够反应生成B,所以可以判断F可以为碳酸钠,而D微溶于水,可以判断D为氢氧化钙,所以C为氧化钙,D能够通过反应生成E,且E能够通过反应生成F,所以可以判断E为氢氧化钾,带入验证,符合题意,可以据此解答该题.
解答:解:(1)氢氧化钠和盐酸反应生成的中性的氯化钠溶液,而酚酞只有在碱性溶液才能变红,所以当小海进行如图甲所示的操作时,当他观察到溶液的红色消失说明恰好完全反应.该反应的化学方程式为:NaOH+HCl═NaCl+H2O;
(2)氢氧化钠溶液变质后的产物为碳酸钠,所以可以加入过量的氯化钙溶液来进行检验,碳酸钠和氯化钙溶液反应生成了白色沉淀;
(3)①A为胃酸的主要成分,可以知道A盐酸,B是贝壳的主要成分,可以知道B为碳酸钙;A与F反应生成气体,且F能够反应生成B,所以可以判断F可以为碳酸钠,而D微溶于水,可以判断D为氢氧化钙,所以C为氧化钙,D能够通过反应生成E,且E能够通过反应生成F,所以可以判断E为氢氧化钾,根据上述分析可以知道D为氢氧化钙,其俗名为熟石灰;
②C为氧化钙,氧化钙和水反应生成了氢氧化钙,该反应中放出大量的热;
③E为氢氧化钠,氢氧化钠和二氧化碳反应生成了碳酸钠,所以E→F的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
④E为氢氧化钠,其用途非常广泛,例如制肥皂、石油工业、造纸、纺织工业、印染等.
故答案为:(1)溶液恰好变为无色;NaOH+HCl═NaCl+H2O;
(2)过量的CaCl2;
(3)①熟石灰;
②放热;
③2NaOH+CO2=Na2CO3+H2O;
④制肥皂、石油工业、造纸、纺织工业、印染等(写一即可).
点评:在做中和反应的实验时,由于酸和碱的溶液一般是无色,二者反应时的现象不明显,所以往往借助于一些试剂或仪器等(如酸碱指示剂、pH试纸、温度计等),来帮助我们判断反应是否进行或恰好完全.
3. (1)两者发生了反应; (2)应取用试管①中的全部溶液与2ml稀硫酸做比对实验;(3)试管①溶液pH大于7(H2SO4已经反应完或试管③中滴入Na2CO3无气泡); (4) l
解析试题分析: (1)因为稀硫酸的pH<7,而试管①中溶液pH>7,说明稀硫酸已经消失了,故可得出结论为稀硫酸与氢氧化钠发生了反应; (2) 应取用试管①中的全部溶液与2ml稀硫酸做比对实验;(3)试管③中加入碳酸钠后没有气泡产生,说明溶液中没有硫酸;(4)因为试管①溶液pH大于7,说明有氢氧化钠存在,并且不与碳酸钠反应,故试管③中的溶液中的溶质有氢氧化钠、碳酸钠及生成的硫酸钠。
考点: 科学探究;实验方案的设计与评价;溶液的酸碱度;酸的性质
4. 解:探究1:
A、B、C都是研究物质组成的实验.从研究方法得知,A实验是利用可燃物消耗瓶内的氧气,使瓶内压强减小来推测空气里氧气含量的.B实验是通过证明生成物的元素组成来推断水的组成的.而C实验与B实验的方法相同.
故填:氧气;元素组成;B.
探究2:
(1)他们探究的问题是酸和碱溶液能发生反应吗?
故填:Ⅱ.
(2)验证:大家对小英得到的无色溶液继续探究.小斌认为反应后溶液中的溶质是硫酸钠,小亮认为溶质有两种,它们是硫酸钠和硫酸.
故填:硫酸钠和硫酸.
5. 解:(1)①关闭弹簧夹,将干燥管小头向下垂直放人盛有水的烧杯中,若观察到无水进入干燥管,则证明装置的密封性良好.
②该反应的反应物为碳酸钙与稀盐酸,生成物是氯化钙、水、二氧化碳,根据化学方程式的书写规则,该反应的化学方程式为:CaCO3+2HCl═CaCl2+H2O+CO2↑;
③该装置可以控制稀盐酸与石灰石的接触与脱离,反应物接触时反应发生,反应物脱离接触时反应停止,可随时控制反应的发生和停止.
④稀盐酸可以和铁反应但不能和铜反应,反应的化学方程式为:Fe+2HCl=FeCl2+H2↑;
(2)①由于二氧化碳能和氢氧化钠溶液中的氢氧化钠发生反应从而导致瓶内压强减小,因此瓶子变瘪或出现瓶吞鸡蛋现象,但二氧化碳也能溶于水,也能使瓶内压强减小,因此小明的实验就缺乏足够的说服力,为了使实验有足够的说服力,可以做对照实验,将氢氧化钠溶液换成等体积的水,做同样的实验,看现象是否有差别.
②为了证明二氧化碳能和氢氧化钠反应,除了设计有明显实验现象的实验外,也可以证明有新物质生成,即证明碳酸钠的生成.即取少量甲实验后变瘪塑料瓶中的溶液,加入一定量稀盐酸,若观察到有气泡产生的现象,就可证明CO2与NaOH已经发生了反应
故答案为:(1)①无水进入干燥管;②CaCO3+2HCl═CaCl2+H2O+CO2↑;③可随时控制反应的发生和停止;④Fe+2HCl=FeCl2+H2↑
(2)①CO2能溶于水,也能使瓶内气压减小;②将氢氧化钠溶液换成等体积的水,做对比实验,②稀盐酸,有气泡产生.
分析:抓住实验室中制取二氧化碳的有关知识和二氧化碳的有关性质:二氧化碳能与氢氧化钠反应、二氧化碳能溶于水.
点评:根据实验装置的不同之处分析出它的不同的仪器的作用,再进行横向比较,得出结论.
6. (1)A、C;
(2)气压(或气体体积)
7. 1)稀盐酸(稀硫酸或其它合理答案均可得分)
(2)部分;2NaOH+CO2==Na2CO3+H2O
8. 解:首先从洗涤前洗涤剂溶液的pH分析,可以发现三组的pH均大于7,则可判断洗涤剂溶液均为碱性,那么在日常生活中“肥皂水是碱性的,洗衣粉溶液是酸性的”说法是不正确的.然后对比三组pH的变化趋势和去污效果,可以得出,肥皂和洗衣粉可以混合使用,也不会降低洗涤剂的去污效果.
第二次重复实验选择另一品牌洗涤剂,其目的是为了借助同样的实验来排除实验的偶然性,增加实验结果的可靠性.
故答案为:(1)不正确;(2)不会; (3)排除实验的偶然性,增加实验结果的可靠性.
分析:溶解酸碱性与pH的关系:pH>7时,溶液呈碱性,且pH越大碱性越强;pH=7时,溶液呈中性;pH<7时,溶液呈酸性,且pH越小酸性越强;根据溶解酸碱性与pH的关系及实验探究所得到实验数据,对猜想中的问题进行分析与判断.
点评:考查学生对“溶液酸碱性判断”这部分知识的掌握程度,考查学生分析问题、解决问题的综合能力和表达能力的同时,把科学探究的过程与基本方法,通过试题的形式介绍给学生,增进对科学探究的理解.
同课章节目录
