人教版 高中化学 选修三 第一章《原子结构和性质》本章复习与测试 (共45张PPT)
文档属性
| 名称 | 人教版 高中化学 选修三 第一章《原子结构和性质》本章复习与测试 (共45张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-07 19:14:43 | ||
图片预览









文档简介
(共45张PPT)
第一章 原子结构与性质复习
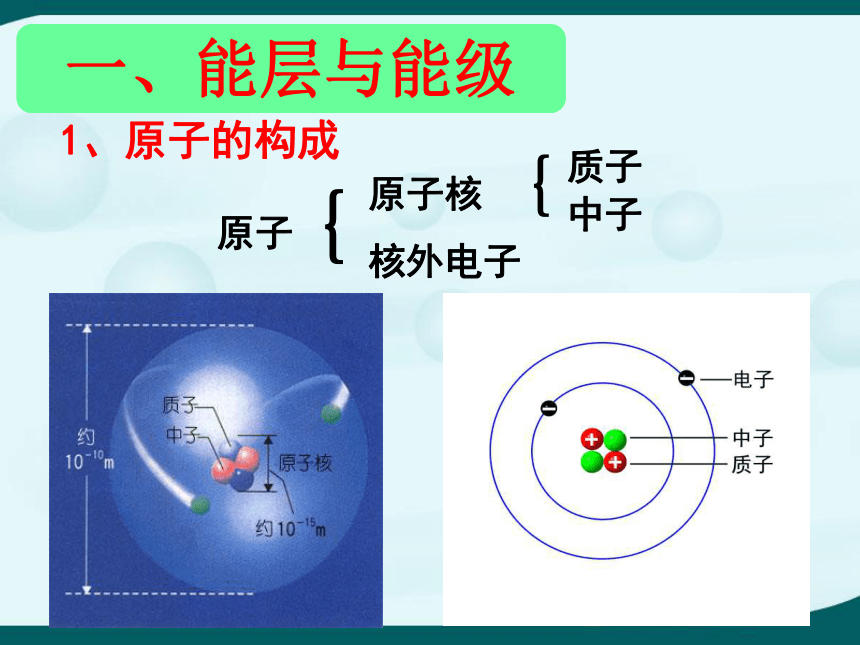
1、原子的构成
原子
原子核
核外电子
质子
中子
{
{
二、能层与能级
一、能层与能级
2、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
(2)能级
表示方法及各能级所容纳的最多电子数:
在多电子原子中,同一能层的电子能量可以不同,还可以把它们分成能级。
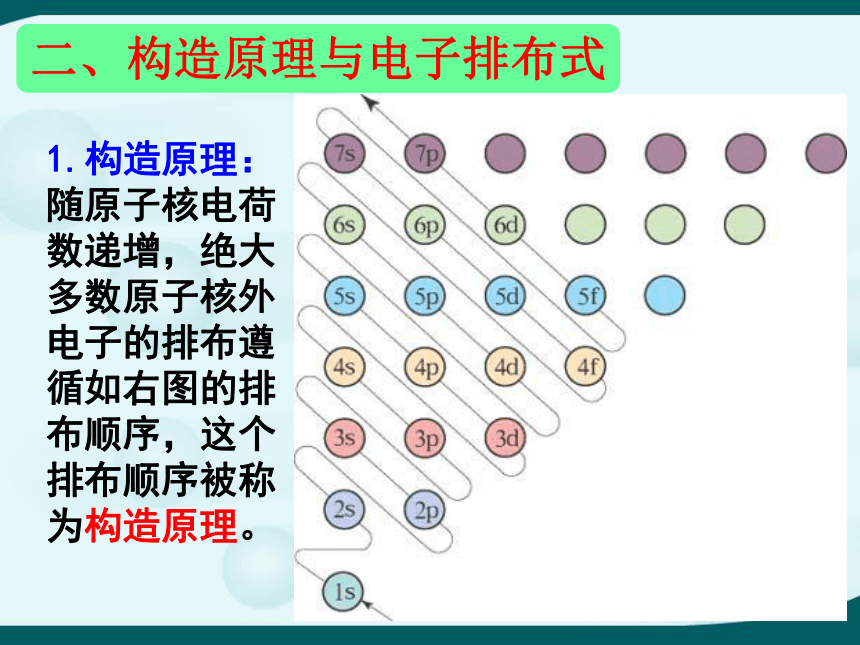
1.构造原理:
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。
二、构造原理与电子排布式
核 外 电 子 填 充 顺 序 图
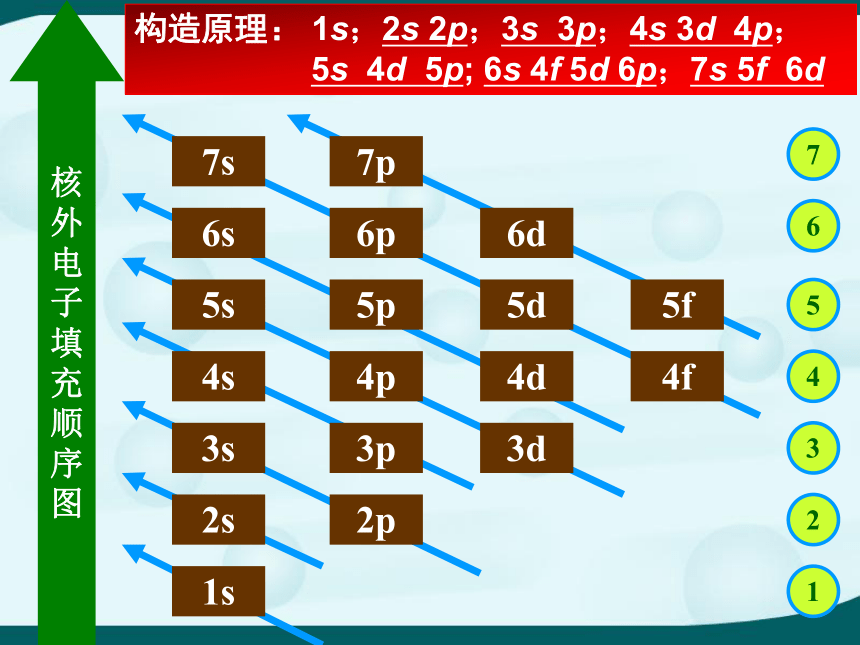
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理中排布顺序的实质
1)相同能层的不同能级的能量高低顺序 :
ns2)英文字母相同的不同能级的能量高低顺序:
1s<2s<3s<4s; 2p<3p<4p; 3d<4d
3)不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
4)能层和形状都相同的原子轨道的能量相同。
2px=2py=2pz
-----各能级的能量高低顺序
2.电子排布式
如:
Na:1s22s22p63s1
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
简化为
用数字在能级符号右上角表明该能级上的排布的电子数。
原子结构示意图
电子排布式
Li: 1s22s1
1.能量最低原理:
原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
2.基态原子: 处于最低能量的原子 (稳定)
电子放出能量
↓
电子吸收能量
↓
三、能量最低原理、基态与激发态、光谱
3.原子光谱
不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
光谱分析:
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速)。
1.核外电子运动的特征
⑵无确定的轨道,无法描述其运动轨迹。
⑶无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。
四、电子云与原子轨道
电子云:电子在原子核外出现的概率分布图。
1s电子在原子核外出现的概率分布图
2.核外电子运动状态的描述
电子轮廓图的制作
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
各能级包含的原子轨道数:
3.原子轨道----电子云轮廓图
电子云形状
①s电子云呈球形,在半径相同的球面上,电子出现的机会相同;
②p电子云呈哑铃形 (或纺锤形);
③d电子云是花瓣形;
④f电子云更为复杂。
S能级的原子轨道图
* S能级的原子轨道是球形对称的
* 能层序数n越大,原子轨道半径越大
P能级的原子轨道图
* P能级的原子轨道是哑铃形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示。
泡利原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋方向必须相反,此时体系最稳定,原子的总能量最低。
五、泡利原理和洪特规则
泡利不相容原理
电子排布式
1s 2s
电子排布图
用一个□表示一个原子轨道,在□中用“↑”或“↓”表示该轨道上排入的电子。
Li: 1s22s1
洪特规则
对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。
C :1s2 2s22p2
洪特规则特例:
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
铁原子的电子排布图
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
1s
2s
2p
3p
3d
3s
4s
能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。
注意:
六、元素周期律
元素的性质随着原子序数的递增发生周期性的递变,称为元素周期律。
性质包括
核外电子排布
元素的化合价
元素的金属性和非金属性
原子半径
电离能
电负性
1)、影响因素:
2)、规律:
(1)电子层数不同时,电子层数越多,原子半径越大。
原子半径大小
取决于
(1)电子的能层数
(2)核电荷数
(2)电子层相同时,核电荷数越大,原子半径越小。
(3)电子层、核电荷数都相同时,电子数越多,原子半径越大;反之,越小。
1、原子半径的周期性变化
六、元素周期律
2、电离能的周期性变化
1)第一电离能:
①概念: 原子 转化为气态基态正离子所需要的最低能量.
②第一电离能的意义:
衡量元素的原子失去一个电子的难易程度,第一电离能数值越小,原子越容易失去一个电子.元素的金属性越强。
气态
电中性
基态
失去一个电子
2)、元素第一电离能的变化规律:
(1)同周期:
a.从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素;
(2)同主族:自上而下第一电离能逐渐减少。
3)、电离能的意义:
第ⅡA元素和第ⅤA元素的反常现象如何解释?
b.第ⅡA元素> ⅢA的元素;第ⅤA元素> ⅥA元素
电离能是衡量气态原子失去电子难易的物理量。元素的电离能越小,表示气态时越容易失去电子,即元素在气态时的金属性越强。
ⅤA是半充满、ⅡA是全充满结构。
3、电负性
1)、基本概念
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子。
电负性:
用来描述不同元素的原子对键合电子的吸引力的大小电负性越大,对键合电子的吸引力越大。(电负性是相对值,没单位)
为了比较元素的原子吸引电子能力的大小,美国化学家鲍林于1932年首先提出了用电负性来衡量元素在化合物中吸引电子的能力。经计算确定氟的电负性为4.0,锂的为1.0,并以此为标准确定其它与元素的电负性。
2)、电负性大小的标准
同一周期,主族元素的电负性从左到右逐渐增大,表明其吸电子的能力逐渐增强(非金属性,氧化性增强)。
同一主族,元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐减弱(金属性、还原性增强)。
3)、电负性的规律
4)、电负性的应用
判断元素的金属性和非金属性 金属性元素的电负性一般在1.8以下,非金属性性元素一般在1.8以上。电负性最大的元素是位于右上方的F,电负性最小的元素是位于左下方的Fr(Fr是放射性元素).
【练习】
1.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWüthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
【练习】
2.下列原子或离子原子核外电子排布不属于基态排布的是( )
A. N: 1s22s22p3
B. S2-: 1s22s22p63s23p6
C. Na: 1s22s22p53s2
D. Si: 1s22s22p63s23p2
3.下列能级中轨道数为3的是( )
A.S能级 B.P能级
C.d能级 D.f能级
【练习】
4.下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1
B.S2- 1s22s22p63s23p4
C.Na+ 1s22s22p6
D.F 1s22s22p5
【练习】
5.下列第三周期元素的离子中,半径最大的是( )
A.Na+ B.Al3+ C.S2- D.Cl-
6.一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A.+1 B.+2 C.+3 D.-1
【练习】
7.下列图象中所发生的现象与电子的跃迁无关的是
A B C D
【练习】
8.有关核外电子运动规律的描述错误的是
A.核外电子质量很小,在原子核外作高速运动
B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
【练习】
9.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
【练习】
10.下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4
B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
【练习】
11.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D.气态氢化物的稳定性:HmY小于HmX
【练习】
12.在同一个原子中,离核越近、n越小的电子层能量 。在同一电子层中,各亚层的能量按s、p、d、f的次序 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级分别为 。现在物质结构理论原理证实,原子的电子排步遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
【练习】
13.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 Al B Be C Br F Li
X的数值 1.5 2.0 1.5 2.5 2.8 4.0 1.0
元素 Mg Na O P S Si N
X的数值 1.2 0.9 3.5 2.1 2.5 1.8 3.0
【练习】
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系____________________。
【练习】
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于_____原子
第一章 原子结构与性质复习
1、原子的构成
原子
原子核
核外电子
质子
中子
{
{
二、能层与能级
一、能层与能级
2、能层与能级
(1)能层
在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。
(2)能级
表示方法及各能级所容纳的最多电子数:
在多电子原子中,同一能层的电子能量可以不同,还可以把它们分成能级。
1.构造原理:
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。
二、构造原理与电子排布式
核 外 电 子 填 充 顺 序 图
构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d
构造原理中排布顺序的实质
1)相同能层的不同能级的能量高低顺序 :
ns
1s<2s<3s<4s; 2p<3p<4p; 3d<4d
3)不同层不同能级可由下面的公式得出:
ns < (n-2)f < (n-1)d < np (n为能层序数)
4)能层和形状都相同的原子轨道的能量相同。
2px=2py=2pz
-----各能级的能量高低顺序
2.电子排布式
如:
Na:1s22s22p63s1
[Ne]3s1
表示钠的内层电子排布与稀有气体元素Ne的核外电子排布相同
简化为
用数字在能级符号右上角表明该能级上的排布的电子数。
原子结构示意图
电子排布式
Li: 1s22s1
1.能量最低原理:
原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。
2.基态原子: 处于最低能量的原子 (稳定)
电子放出能量
↓
电子吸收能量
↓
三、能量最低原理、基态与激发态、光谱
3.原子光谱
不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
光谱分析:
在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。
⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速)。
1.核外电子运动的特征
⑵无确定的轨道,无法描述其运动轨迹。
⑶无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。
四、电子云与原子轨道
电子云:电子在原子核外出现的概率分布图。
1s电子在原子核外出现的概率分布图
2.核外电子运动状态的描述
电子轮廓图的制作
常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。
各能级包含的原子轨道数:
3.原子轨道----电子云轮廓图
电子云形状
①s电子云呈球形,在半径相同的球面上,电子出现的机会相同;
②p电子云呈哑铃形 (或纺锤形);
③d电子云是花瓣形;
④f电子云更为复杂。
S能级的原子轨道图
* S能级的原子轨道是球形对称的
* 能层序数n越大,原子轨道半径越大
P能级的原子轨道图
* P能级的原子轨道是哑铃形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示。
泡利原理
一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋方向必须相反,此时体系最稳定,原子的总能量最低。
五、泡利原理和洪特规则
泡利不相容原理
电子排布式
1s 2s
电子排布图
用一个□表示一个原子轨道,在□中用“↑”或“↓”表示该轨道上排入的电子。
Li: 1s22s1
洪特规则
对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。
C :1s2 2s22p2
洪特规则特例:
相对稳定的状态
全充满(p6,d10,f14)
全空时(p0,d0,f0)
半充满(p3,d5,f7)
铁原子的电子排布图
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑↓
↑
↑
↑
↑
洪特规则
泡利原理
能量最低原理
1s
2s
2p
3p
3d
3s
4s
能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。
注意:
六、元素周期律
元素的性质随着原子序数的递增发生周期性的递变,称为元素周期律。
性质包括
核外电子排布
元素的化合价
元素的金属性和非金属性
原子半径
电离能
电负性
1)、影响因素:
2)、规律:
(1)电子层数不同时,电子层数越多,原子半径越大。
原子半径大小
取决于
(1)电子的能层数
(2)核电荷数
(2)电子层相同时,核电荷数越大,原子半径越小。
(3)电子层、核电荷数都相同时,电子数越多,原子半径越大;反之,越小。
1、原子半径的周期性变化
六、元素周期律
2、电离能的周期性变化
1)第一电离能:
①概念: 原子 转化为气态基态正离子所需要的最低能量.
②第一电离能的意义:
衡量元素的原子失去一个电子的难易程度,第一电离能数值越小,原子越容易失去一个电子.元素的金属性越强。
气态
电中性
基态
失去一个电子
2)、元素第一电离能的变化规律:
(1)同周期:
a.从左到右呈现递增趋势(最小的是碱金属,最大的是稀有气体的元素;
(2)同主族:自上而下第一电离能逐渐减少。
3)、电离能的意义:
第ⅡA元素和第ⅤA元素的反常现象如何解释?
b.第ⅡA元素> ⅢA的元素;第ⅤA元素> ⅥA元素
电离能是衡量气态原子失去电子难易的物理量。元素的电离能越小,表示气态时越容易失去电子,即元素在气态时的金属性越强。
ⅤA是半充满、ⅡA是全充满结构。
3、电负性
1)、基本概念
化学键:
元素相互化合,相邻的原子之间产生的强烈的化学作用力,叫做化学键。
键合电子:
原子中用于形成化学键的电子称为键合电子。
电负性:
用来描述不同元素的原子对键合电子的吸引力的大小电负性越大,对键合电子的吸引力越大。(电负性是相对值,没单位)
为了比较元素的原子吸引电子能力的大小,美国化学家鲍林于1932年首先提出了用电负性来衡量元素在化合物中吸引电子的能力。经计算确定氟的电负性为4.0,锂的为1.0,并以此为标准确定其它与元素的电负性。
2)、电负性大小的标准
同一周期,主族元素的电负性从左到右逐渐增大,表明其吸电子的能力逐渐增强(非金属性,氧化性增强)。
同一主族,元素的电负性从上到下呈现减小的趋势,表明其吸引电子的能力逐渐减弱(金属性、还原性增强)。
3)、电负性的规律
4)、电负性的应用
判断元素的金属性和非金属性 金属性元素的电负性一般在1.8以下,非金属性性元素一般在1.8以上。电负性最大的元素是位于右上方的F,电负性最小的元素是位于左下方的Fr(Fr是放射性元素).
【练习】
1.13C—NMR(核磁共振)、15N—NMR可用于测定蛋白质、核酸等生物大分子的空间结构,KurtWüthrich等人为此获得2002年诺贝尔化学奖。下面有关13C、15N叙述正确的是( )
A.13C与15N有相同的中子数
B.13C与C60互为同素异形体
C.15N与14N互为同位素
D.15N的核外电子数与中子数相同
【练习】
2.下列原子或离子原子核外电子排布不属于基态排布的是( )
A. N: 1s22s22p3
B. S2-: 1s22s22p63s23p6
C. Na: 1s22s22p53s2
D. Si: 1s22s22p63s23p2
3.下列能级中轨道数为3的是( )
A.S能级 B.P能级
C.d能级 D.f能级
【练习】
4.下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1
B.S2- 1s22s22p63s23p4
C.Na+ 1s22s22p6
D.F 1s22s22p5
【练习】
5.下列第三周期元素的离子中,半径最大的是( )
A.Na+ B.Al3+ C.S2- D.Cl-
6.一个电子排布为1s22s22p63s23p1的元素最可能的价态是
A.+1 B.+2 C.+3 D.-1
【练习】
7.下列图象中所发生的现象与电子的跃迁无关的是
A B C D
【练习】
8.有关核外电子运动规律的描述错误的是
A.核外电子质量很小,在原子核外作高速运动
B.核外电子的运动规律与普通物体不同,不能用牛顿运动定律来解释
C.在电子云示意图中,通常用小黑点来表示电子绕核作高速圆周运动
D.在电子云示意图中,小黑点密表示电子在核外空间单位体积内电子出现的机会多
【练习】
9.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
【练习】
10.下列是几种原子的基态电子排布,电负性最大的原子是( )
A.1s22s22p4
B.1s22s22p63s23p3
C.1s22s22p63s23p2 D.1s22s22p63s23p64s2
【练习】
11.已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成化合物是,X可以显负价,Y显正价
B.第一电离能可能Y小于X
C.最高价含氧酸的酸性:X对应的酸性弱于于Y对应的
D.气态氢化物的稳定性:HmY小于HmX
【练习】
12.在同一个原子中,离核越近、n越小的电子层能量 。在同一电子层中,各亚层的能量按s、p、d、f的次序 。理论研究证明,多电子原子中,同一能层的电子,能量也可能不同,还可以把它们分成能级,第三能层有3个能级分别为 。现在物质结构理论原理证实,原子的电子排步遵循构造原理能使整个原子的能量处于最低状态,处于最低能量的原子叫做 原子。
【练习】
13.已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
元素 Al B Be C Br F Li
X的数值 1.5 2.0 1.5 2.5 2.8 4.0 1.0
元素 Mg Na O P S Si N
X的数值 1.2 0.9 3.5 2.1 2.5 1.8 3.0
【练习】
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断AlBr3中的化学键类型是 。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性或非金属性强弱之间的关系______________________________;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系____________________。
【练习】
(3)请你预测Br与I元素的X数值的大小关系________。
(4)某有机化合物分子中含有S—N键,你认为该共用电子对偏向于_____原子
