人教版九年级化学下册:第八单元 课题2 金属的化学性质
文档属性
| 名称 | 人教版九年级化学下册:第八单元 课题2 金属的化学性质 |  | |
| 格式 | zip | ||
| 文件大小 | 2.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-10 19:42:55 | ||
图片预览










文档简介
(共49张PPT)
金光闪闪,全是假冒!
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜(铜锌合金,号称“愚人金”)冒充黄金进行欺诈活动.这种“愚人金”与黄金的外观相似,我们可用什么方法来鉴别它们呢?
真假黄金的鉴别方法
1、测硬度
2、测密度
3、灼烧
4、 。。。
1.镁条和铝片在 就能和空气中的氧气发生反应。(填反应条件,下同)
2.铁丝与铜片在 与氧气反应
3.“真金不怕火炼”
常温下
高温时
一、金属与氧气的反应
即使高温,金也不与O2反应
Mg 、Al > Fe 、 Cu > Au
活动性:
4Al+3O2=2Al2O3 2Mg+O2=2MgO
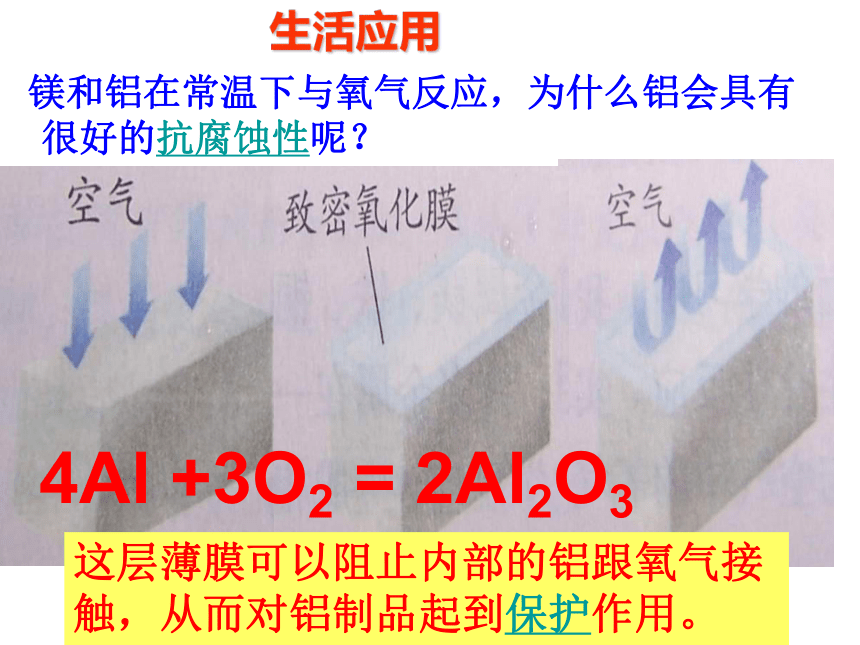
镁和铝在常温下与氧气反应,为什么铝会具有很好的抗腐蚀性呢?
铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。
生活应用
这层薄膜可以阻止内部的铝跟氧气接触,从而对铝制品起到保护作用。
4Al +3O2 = 2Al2O3
镁和铝在常温下与氧气反应,为什么铝会具有很好的抗腐蚀性呢?
生活应用
我能应用:
小明看到妈妈在厨房里用钢丝球用力擦洗铝锅上的污垢,立即喊起来:“妈妈,不能用钢丝球擦。”你知道为什么吗?
除去铝锅表面致密的的氧化铝薄膜,就不能保护里层的铝不再与氧气反应,使铝锅容易被腐蚀。
1、所有的金属都可以和酸反应吗?
2、不同金属和酸反应的剧烈程度一样吗?
二.金属与酸的反应
【探究活动】 金属与酸的反应
实验步骤:
分别取四种金属按照Mg、Zn、Fe、Cu的顺序放入四支试管中,再在各试管中加入约5mL的盐酸,观察并记录实验现象。
注意观察:
1、是不是所有金属都能与酸反应?
2、不同金属与酸反应的剧烈程度是否相同?
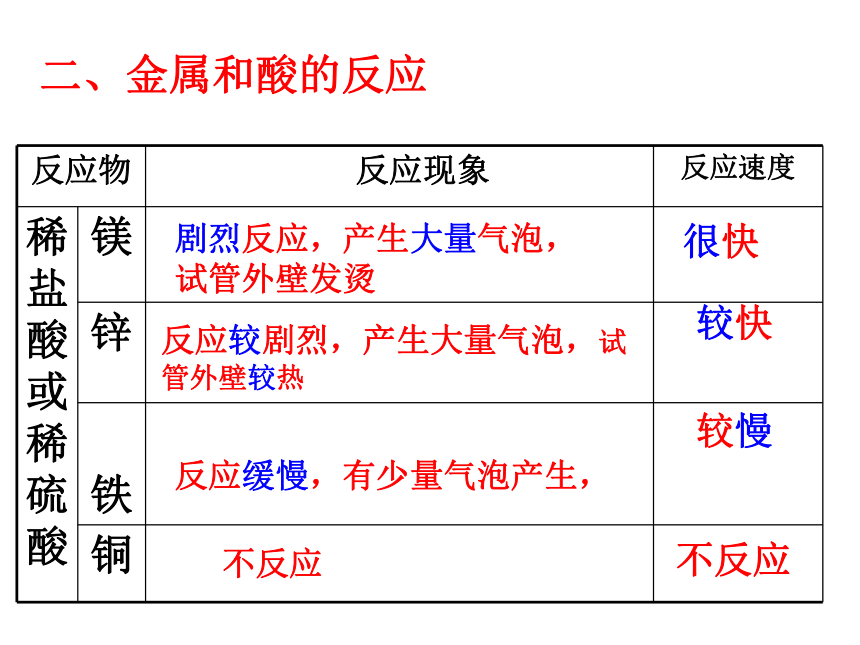
镁、锌、铁、铜与盐酸反应比较
二、金属和酸的反应
很快
较快
较慢
不反应
剧烈反应,产生大量气泡,试管外壁发烫
反应较剧烈,产生大量气泡,试管外壁较热
反应缓慢,有少量气泡产生,
不反应
反应物 反应现象 反应速度
稀盐酸或稀硫酸 镁
锌
铁
铜
讨论:观察此图,填空:
1、能与盐酸、稀硫酸反应的金属是
2、不能与盐酸、稀硫酸反应的金属是
3、镁、锌、铁、铜四种金属的活泼性顺序
是 > > > .
Mg Zn Fe
Cu
Mg Zn Fe Cu
思考:实验室用锌和稀盐酸反应制取氢气
(1)用锌不用镁和铁是为什么?
(2)用稀硫酸不用盐酸又是为什么?
镁的反应速率太快,铁的反应速率太慢
金属与酸是放热反应,会加快盐酸的挥发
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应
观察下列化学方程式,你发现有什么特点?
单质
化合物
另一种单质
+
=
+
另一种化合物
三、置换反应:
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应。
1、概念:
2、特点:A+BC→B+AC
1、下列反应属于置换反应的是( )
①H2+CuO===Cu+H2O
②2CO+O2===2CO
③Zn+2HCl===ZnCl+H2↑
④Fe2O3+3CO===2Fe+3CO2
A、①④ B、②③ C、①③ D、②④
加热
高温
C
本节课你应该知道:
1:很多金属(除Au外)都能与氧气反应;但是与金属反应的难易程度不同;
2:金属与氧气反应的难易程度体现了金属的活泼性。
3:很多金属(除铜等金属外)能够与酸反应产生氢气;
4:金属与酸反应的剧烈程度体现了金属的活泼性。
5:置换反应:一种单质与一种化合物反应生成另一种单质与另一种化合物的反应。
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
B
2.下列关于金属的说法正确的是( )
A.各种金属在常温下都不能与氧气反应
B.“真金不拍火炼”是说明黄金的熔点高
C.根据金属与氧气反应的难易程度可以初步比 较金属 的活动性
D.各种金属都能与盐酸发生置换反应
C
3、小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
D
4、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl=2AlCl3+3H2↑ ( )
(2)H2CO3=CO2↑+H2O ( )
(3)Fe+CuSO4=FeSO4+Cu ( )
(4)CaO+H2O=Ca(OH)2 ( )
C
B
C
A
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜(铜锌合金)冒充黄金进行欺诈活动.黄铜与黄金的外观相似,我们可用什么方法来鉴别它们呢?
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
2.镁条在空气中燃烧时,可观察到的现象是( )
A.发出蓝色火焰 B.发出耀眼白光
C.发出黄色火焰 D.剧烈燃烧,火星四射
B
B
金属化学性质(第二课时)
结合前面金属与氧气、稀酸反应表现出来的活泼性顺序,你能否得出金属和盐中的金属的活泼强弱顺序?
现象:_________________________________________________
________________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面有红色物质析出,若时间
足够长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
铁与硫酸铜溶液的反应:
Fe + CuSO4 = Cu + FeSO4
提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明?
三.金属与金属化合物溶液的反应
利用Al条、Cu丝及CuSO4 、 AgNO3 、 Al2(SO4)3溶液判断:Al、Cu 、Ag的活动性
将铝条投入到硫酸铜溶液中,观察铝能否将金属铜
从它的硫酸铜溶液中置换出来,(如果能,会有什么
现象?)接着做一个对比实验,将铜丝放入硫酸
铝溶液中,观察又有什么现象,可以得出什么结论?
再将铜丝放入硝酸银溶液中,通过现象验证你的结论
金属与某些化合物的溶液反应
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al+3CuSO4==3Cu+Al2(SO4)3
Cu+2AgNO3==2Ag+Cu(NO3)2
活动性:Al﹥Cu
活动性:Cu﹥Ag
实验 现象 反应的化学方程式及结论
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
1、铝、铜、银三种金属的活动性顺序是
置换
Al > Cu >Ag
金属活动性由强到弱
2、以上反应类型都属于 反应。
也就是说:活泼的金属,可以从较不活泼的金属的
化合物溶液中把不活泼的金属置换出来!
金属活动性顺序
由强逐渐减弱
常见金属的活动性顺序:
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。如 Mg > Al > Cu
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。如Mg、Al、Zn、Fe 可以和盐酸反应生成氢气,而Cu不行
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。如铁能把铜从硫酸铜中置换出来
4.铁与酸,铁与化合物溶液发生置换反应,生成亚铁化合物(铁元素显+2)常见的有FeCl2 、 FeSO4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属位置越靠前,金属活动性越强
(1)在金属活动性顺序表中,排在氢前的金属可置换出酸中的氢,排在氢后的金属不能置换出酸中的氢。
氢前金属能置(置换)氢,氢后金属不反应
(3)金属与稀酸反应时,产生氢气的速率越快,金属的活动性越强。
(2)酸是盐酸(一般浓、稀都可以)或者稀硫酸!
2、金属跟金属化合物溶液的反应
“前”金属+
“后金属化合物溶液”
新金属化合物溶液
+新金属
(1)在金属活动性顺序表中,排在前面的金属可以把排在
后面的金属从它的化合物溶液中置换出来。
(3)一般来说,不用钾K、钙Ca、钠Na置换盐溶液中的
金属,因为钾、钙、钠的化学性质极强,它们与金属化合物
溶液的反应比较复杂(可以先跟水反应)。
(2)与金属反应的化合物溶液必须是可溶的。
可溶的金属化合物溶液:钾钠硝铵都能溶!
含有硝酸根的金属化合物溶液、含有硫酸根的金属化合物溶液(除了硫酸钡BaSO4白色沉淀)、氯化物溶液(除了氯化银AgCl白色沉淀)
下列反应能否进行?写出能发生的反应方程式并判断他们是否是置换反应。
(1)银与稀盐酸
(2)锌与稀硫酸反应
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
一般来说,发生置换反应时,金属活动性差异越大,越易进行;如把Fe投入到AgNO3,Cu(NO3)2混合溶液中,置换出金属的先后顺序是Ag、Cu。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
Mg Al Zn Fe (H) Cu Ag
常见金属活动性:
某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,将其分成A、B两份,各加入一定量的锌粉,充分反应后,过滤洗涤,分别得到滤渣和滤液
1.将A得到的滤渣加入到稀盐酸中有气泡产生,则该滤渣中含有的物质是 ;
2.往B得到的滤液中滴加稀盐酸,有白色沉淀产生,则对应的滤渣中含有 ,滤液中含有的溶质是 。
Zn Cu Ag
Ag
Ag(NO3)2 Cu(NO3)2 Zn(NO3)2
试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl=2AlCl3+3H2↑ ( )
(2)H2CO3=CO2↑+H2O ( )
(3)Fe+CuSO4=FeSO4+Cu ( )
(4)CaO+H2O=Ca(OH)2 ( )
C
B
C
A
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应
下面是我们这节课探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?
单质
化合物
另一种单质
+
=
+
另一种化合物
2、置换反应:化学基本反应类型之三
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应。
1、概念:
2、置换反应的特点:A+BC→B+AC
{
化合反应:A+B+…→C 多变一
分解反应:A→B+C+… 一变多
化学反应的基本类型
化合反应:A + B + … → AB…
分解反应:AB… →A + B + …
置换反应:A +BC →AC + B
复分解反应:AB + CD → AD + CB
7、请你设计实验:证明真假黄金,要求写出实验方案、现象和结论。
1.加热
变黑
2.稀H2SO4
产生气泡
3.AgNO3溶液
生成银白色固体,溶液变蓝
测密度
密度较小
是黄铜,不是金
简述实验方案 现象 结论
物理
方法
化学
方法
8、请大家根据实验事实,也可以自己设计实验方案并选择药品比较铁、镁、铜三种金属的活动性顺序
O2
等质量等浓度的稀H2SO4
Mg FeSO4 Cu
MgSO4 Fe CuSO4
活泼性
Mg>Fe>Cu
简述实验步骤 结论
1、
2、
3、
4、
9、实验课上同学错将铁粉和铜粉混合了,请你预想三种能将混合物中的铁粉除去的方法。
磁铁吸引
稀H2SO4
2、过滤,洗涤,干燥
过量CuSO4
同②
1.加过量
A
B
A B
简述实验步骤 各步所需装置
填写A或B
物理方法 ①
化学方法 ②
③
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
2.镁条在空气中燃烧时,可观察到的现象是( )
A.发出蓝色火焰 B.发出耀眼白光
C.发出黄色火焰 D.剧烈燃烧,火星四射
B
B
3.小兰家中收藏一件清末的铝制佛像,至今仍保存十
分完好。该佛像未锈蚀的主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生化学反应
C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用。
4.将足量的铁粉投入硫酸铜和硫酸的混合溶液中,反
应完毕后过滤,在滤液里含有的物质是( )
A.Fe2(SO4)3 B.CuSO4
C.FeSO4 D.H2SO4
D
C
5、现有铁片、铜片、硝酸汞溶液和盐酸几种物质,欲确定Fe、Cu 、Hg、H 的活动性顺序,有如下三种方案:
A. Fe +HCl Fe + Hg(NO3)2 Cu +HCl
B.Fe + HCl Cu + HCl Cu + Hg(NO3)2
C. Fe + HCl Fe + Hg(NO3)2 Cu +Hg(NO3)2
试评价这三种方案:
(1)最差的方案是 ,理由是 。
(2)最好的方案是 ,理由是 。
3.填写下列表格(括号内为杂质)
Fe+2HCl=FeCl2+H2↑
Fe+CuCl2=FeCl2+Cu
溶解、过滤、洗涤
溶解、过滤
混合物 除去杂质的化学方程式 主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
金光闪闪,全是假冒!
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜(铜锌合金,号称“愚人金”)冒充黄金进行欺诈活动.这种“愚人金”与黄金的外观相似,我们可用什么方法来鉴别它们呢?
真假黄金的鉴别方法
1、测硬度
2、测密度
3、灼烧
4、 。。。
1.镁条和铝片在 就能和空气中的氧气发生反应。(填反应条件,下同)
2.铁丝与铜片在 与氧气反应
3.“真金不怕火炼”
常温下
高温时
一、金属与氧气的反应
即使高温,金也不与O2反应
Mg 、Al > Fe 、 Cu > Au
活动性:
4Al+3O2=2Al2O3 2Mg+O2=2MgO
镁和铝在常温下与氧气反应,为什么铝会具有很好的抗腐蚀性呢?
铝在空气中与氧气反应,其表面生成一层致密的氧化铝(Al2O3)薄膜,从而阻止铝进一步被氧化。
生活应用
这层薄膜可以阻止内部的铝跟氧气接触,从而对铝制品起到保护作用。
4Al +3O2 = 2Al2O3
镁和铝在常温下与氧气反应,为什么铝会具有很好的抗腐蚀性呢?
生活应用
我能应用:
小明看到妈妈在厨房里用钢丝球用力擦洗铝锅上的污垢,立即喊起来:“妈妈,不能用钢丝球擦。”你知道为什么吗?
除去铝锅表面致密的的氧化铝薄膜,就不能保护里层的铝不再与氧气反应,使铝锅容易被腐蚀。
1、所有的金属都可以和酸反应吗?
2、不同金属和酸反应的剧烈程度一样吗?
二.金属与酸的反应
【探究活动】 金属与酸的反应
实验步骤:
分别取四种金属按照Mg、Zn、Fe、Cu的顺序放入四支试管中,再在各试管中加入约5mL的盐酸,观察并记录实验现象。
注意观察:
1、是不是所有金属都能与酸反应?
2、不同金属与酸反应的剧烈程度是否相同?
镁、锌、铁、铜与盐酸反应比较
二、金属和酸的反应
很快
较快
较慢
不反应
剧烈反应,产生大量气泡,试管外壁发烫
反应较剧烈,产生大量气泡,试管外壁较热
反应缓慢,有少量气泡产生,
不反应
反应物 反应现象 反应速度
稀盐酸或稀硫酸 镁
锌
铁
铜
讨论:观察此图,填空:
1、能与盐酸、稀硫酸反应的金属是
2、不能与盐酸、稀硫酸反应的金属是
3、镁、锌、铁、铜四种金属的活泼性顺序
是 > > > .
Mg Zn Fe
Cu
Mg Zn Fe Cu
思考:实验室用锌和稀盐酸反应制取氢气
(1)用锌不用镁和铁是为什么?
(2)用稀硫酸不用盐酸又是为什么?
镁的反应速率太快,铁的反应速率太慢
金属与酸是放热反应,会加快盐酸的挥发
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应
观察下列化学方程式,你发现有什么特点?
单质
化合物
另一种单质
+
=
+
另一种化合物
三、置换反应:
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应。
1、概念:
2、特点:A+BC→B+AC
1、下列反应属于置换反应的是( )
①H2+CuO===Cu+H2O
②2CO+O2===2CO
③Zn+2HCl===ZnCl+H2↑
④Fe2O3+3CO===2Fe+3CO2
A、①④ B、②③ C、①③ D、②④
加热
高温
C
本节课你应该知道:
1:很多金属(除Au外)都能与氧气反应;但是与金属反应的难易程度不同;
2:金属与氧气反应的难易程度体现了金属的活泼性。
3:很多金属(除铜等金属外)能够与酸反应产生氢气;
4:金属与酸反应的剧烈程度体现了金属的活泼性。
5:置换反应:一种单质与一种化合物反应生成另一种单质与另一种化合物的反应。
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
B
2.下列关于金属的说法正确的是( )
A.各种金属在常温下都不能与氧气反应
B.“真金不拍火炼”是说明黄金的熔点高
C.根据金属与氧气反应的难易程度可以初步比 较金属 的活动性
D.各种金属都能与盐酸发生置换反应
C
3、小兰家中收藏一件清末的铝制佛像,该佛像至今保存十分完好。其主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生还原反应
C.铝不易被氧化
D.铝易氧化,但氧化铝具有保护内部铝的作用
D
4、试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl=2AlCl3+3H2↑ ( )
(2)H2CO3=CO2↑+H2O ( )
(3)Fe+CuSO4=FeSO4+Cu ( )
(4)CaO+H2O=Ca(OH)2 ( )
C
B
C
A
黄金饰品中的假货常常鱼目混珠,社会上有些不法分子时常以黄铜(铜锌合金)冒充黄金进行欺诈活动.黄铜与黄金的外观相似,我们可用什么方法来鉴别它们呢?
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
2.镁条在空气中燃烧时,可观察到的现象是( )
A.发出蓝色火焰 B.发出耀眼白光
C.发出黄色火焰 D.剧烈燃烧,火星四射
B
B
金属化学性质(第二课时)
结合前面金属与氧气、稀酸反应表现出来的活泼性顺序,你能否得出金属和盐中的金属的活泼强弱顺序?
现象:_________________________________________________
________________________________________________________
回忆:将铁钉投入到硫酸铜溶液中有何现象?
铁钉表面有红色物质析出,若时间
足够长,则溶液会从蓝色变为浅绿色。
Fe + CuSO4 = Cu + FeSO4
该反应的化学方程式:
铁与硫酸铜溶液的反应:
Fe + CuSO4 = Cu + FeSO4
提出问题:铝、铜、银三种金属的活动性顺序的强弱如何证明?
三.金属与金属化合物溶液的反应
利用Al条、Cu丝及CuSO4 、 AgNO3 、 Al2(SO4)3溶液判断:Al、Cu 、Ag的活动性
将铝条投入到硫酸铜溶液中,观察铝能否将金属铜
从它的硫酸铜溶液中置换出来,(如果能,会有什么
现象?)接着做一个对比实验,将铜丝放入硫酸
铝溶液中,观察又有什么现象,可以得出什么结论?
再将铜丝放入硝酸银溶液中,通过现象验证你的结论
金属与某些化合物的溶液反应
浸入溶液中的铝丝
表面覆盖一层紫红
色物质,溶液由蓝
色逐渐变为无色。
浸入溶液中的铜丝
表面覆盖一层银白
色物质,溶液由无
色逐渐变为蓝色。
不反应
2Al+3CuSO4==3Cu+Al2(SO4)3
Cu+2AgNO3==2Ag+Cu(NO3)2
活动性:Al﹥Cu
活动性:Cu﹥Ag
实验 现象 反应的化学方程式及结论
铝丝浸入硫酸铜溶液中
铜丝浸入硝酸银溶液中
铜丝浸入硫酸铝溶液中
1、铝、铜、银三种金属的活动性顺序是
置换
Al > Cu >Ag
金属活动性由强到弱
2、以上反应类型都属于 反应。
也就是说:活泼的金属,可以从较不活泼的金属的
化合物溶液中把不活泼的金属置换出来!
金属活动性顺序
由强逐渐减弱
常见金属的活动性顺序:
1.在金属活动性顺序中,金属的位置越靠前,它的活动性越强。如 Mg > Al > Cu
2.在金属活动性顺序中,位于氢前面的金属能置换出盐酸、稀硫酸中的氢。如Mg、Al、Zn、Fe 可以和盐酸反应生成氢气,而Cu不行
3.在金属活动性顺序中,位于前面的金属能把位于后面的金属从它们化合物的溶液里置换出来。如铁能把铜从硫酸铜中置换出来
4.铁与酸,铁与化合物溶液发生置换反应,生成亚铁化合物(铁元素显+2)常见的有FeCl2 、 FeSO4
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
金属位置越靠前,金属活动性越强
(1)在金属活动性顺序表中,排在氢前的金属可置换出酸中的氢,排在氢后的金属不能置换出酸中的氢。
氢前金属能置(置换)氢,氢后金属不反应
(3)金属与稀酸反应时,产生氢气的速率越快,金属的活动性越强。
(2)酸是盐酸(一般浓、稀都可以)或者稀硫酸!
2、金属跟金属化合物溶液的反应
“前”金属+
“后金属化合物溶液”
新金属化合物溶液
+新金属
(1)在金属活动性顺序表中,排在前面的金属可以把排在
后面的金属从它的化合物溶液中置换出来。
(3)一般来说,不用钾K、钙Ca、钠Na置换盐溶液中的
金属,因为钾、钙、钠的化学性质极强,它们与金属化合物
溶液的反应比较复杂(可以先跟水反应)。
(2)与金属反应的化合物溶液必须是可溶的。
可溶的金属化合物溶液:钾钠硝铵都能溶!
含有硝酸根的金属化合物溶液、含有硫酸根的金属化合物溶液(除了硫酸钡BaSO4白色沉淀)、氯化物溶液(除了氯化银AgCl白色沉淀)
下列反应能否进行?写出能发生的反应方程式并判断他们是否是置换反应。
(1)银与稀盐酸
(2)锌与稀硫酸反应
(3)铜与硫酸锌溶液
(4)铝与硝酸银溶液
一般来说,发生置换反应时,金属活动性差异越大,越易进行;如把Fe投入到AgNO3,Cu(NO3)2混合溶液中,置换出金属的先后顺序是Ag、Cu。
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
Mg Al Zn Fe (H) Cu Ag
常见金属活动性:
某溶液中仅含有AgNO3和Cu(NO3)2两种溶质,将其分成A、B两份,各加入一定量的锌粉,充分反应后,过滤洗涤,分别得到滤渣和滤液
1.将A得到的滤渣加入到稀盐酸中有气泡产生,则该滤渣中含有的物质是 ;
2.往B得到的滤液中滴加稀盐酸,有白色沉淀产生,则对应的滤渣中含有 ,滤液中含有的溶质是 。
Zn Cu Ag
Ag
Ag(NO3)2 Cu(NO3)2 Zn(NO3)2
试判断下列物质的化学反应类型:
A.化合反应 B.分解反应 C.置换反应
(1)2Al+6HCl=2AlCl3+3H2↑ ( )
(2)H2CO3=CO2↑+H2O ( )
(3)Fe+CuSO4=FeSO4+Cu ( )
(4)CaO+H2O=Ca(OH)2 ( )
C
B
C
A
Mg + 2HCl == MgCl2 + H2↑
Mg + H2SO4 == MgSO4 + H2 ↑
Zn + 2HCl == ZnCl2 + H2 ↑
Zn + H2SO4 == ZnSO4 + H2 ↑
Fe + 2HCl == FeCl2 + H2 ↑
Fe + H2SO4 == FeSO4 + H2 ↑
置 换 反 应
下面是我们这节课探究时发生的一些反应。请从反应物和生成物的物质类别的角度分析,这些反应有什么特点?
单质
化合物
另一种单质
+
=
+
另一种化合物
2、置换反应:化学基本反应类型之三
由一种单质和一种化合物反应生成另一种单质和另一种化合物的反应叫做置换反应。
1、概念:
2、置换反应的特点:A+BC→B+AC
{
化合反应:A+B+…→C 多变一
分解反应:A→B+C+… 一变多
化学反应的基本类型
化合反应:A + B + … → AB…
分解反应:AB… →A + B + …
置换反应:A +BC →AC + B
复分解反应:AB + CD → AD + CB
7、请你设计实验:证明真假黄金,要求写出实验方案、现象和结论。
1.加热
变黑
2.稀H2SO4
产生气泡
3.AgNO3溶液
生成银白色固体,溶液变蓝
测密度
密度较小
是黄铜,不是金
简述实验方案 现象 结论
物理
方法
化学
方法
8、请大家根据实验事实,也可以自己设计实验方案并选择药品比较铁、镁、铜三种金属的活动性顺序
O2
等质量等浓度的稀H2SO4
Mg FeSO4 Cu
MgSO4 Fe CuSO4
活泼性
Mg>Fe>Cu
简述实验步骤 结论
1、
2、
3、
4、
9、实验课上同学错将铁粉和铜粉混合了,请你预想三种能将混合物中的铁粉除去的方法。
磁铁吸引
稀H2SO4
2、过滤,洗涤,干燥
过量CuSO4
同②
1.加过量
A
B
A B
简述实验步骤 各步所需装置
填写A或B
物理方法 ①
化学方法 ②
③
1.下列叙述中,属于金属化学性质的是( )
A.纯铁是银白色固体
B.铝在空气中易与氧气反应生成致密的氧化膜
C.铜容易传热、导电
D.钨有很高的熔点
2.镁条在空气中燃烧时,可观察到的现象是( )
A.发出蓝色火焰 B.发出耀眼白光
C.发出黄色火焰 D.剧烈燃烧,火星四射
B
B
3.小兰家中收藏一件清末的铝制佛像,至今仍保存十
分完好。该佛像未锈蚀的主要原因是( )
A.铝不易发生化学反应
B.铝的氧化物容易发生化学反应
C.铝不易被氧化
D.铝易被氧化,但氧化铝具有保护内部铝的作用。
4.将足量的铁粉投入硫酸铜和硫酸的混合溶液中,反
应完毕后过滤,在滤液里含有的物质是( )
A.Fe2(SO4)3 B.CuSO4
C.FeSO4 D.H2SO4
D
C
5、现有铁片、铜片、硝酸汞溶液和盐酸几种物质,欲确定Fe、Cu 、Hg、H 的活动性顺序,有如下三种方案:
A. Fe +HCl Fe + Hg(NO3)2 Cu +HCl
B.Fe + HCl Cu + HCl Cu + Hg(NO3)2
C. Fe + HCl Fe + Hg(NO3)2 Cu +Hg(NO3)2
试评价这三种方案:
(1)最差的方案是 ,理由是 。
(2)最好的方案是 ,理由是 。
3.填写下列表格(括号内为杂质)
Fe+2HCl=FeCl2+H2↑
Fe+CuCl2=FeCl2+Cu
溶解、过滤、洗涤
溶解、过滤
混合物 除去杂质的化学方程式 主要操作步骤
铜粉(Fe)
FeCl2溶液(CuCl2)
同课章节目录
