鲁教版九年级化学下册第七单元第一节 酸及其性质
文档属性
| 名称 | 鲁教版九年级化学下册第七单元第一节 酸及其性质 |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2020-02-14 08:58:22 | ||
图片预览






文档简介
(共23张PPT)
第七单元 常见的酸和碱
第一节 酸及其性质
1.认识酸的化学性质,理解酸的化学性质实质是H+的性质。
2.初步认识复分解反应,会写常见的复分解反应的化学方程式。
3.认识几种重要的酸,掌握使用酸的方法。
4.通过对酸的性质的开放性探究活动,进一步发展科学探究能力。
生活中有些酸味的物质都含有一类特殊的化合物——酸;你已经知道哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
1.人的胃液里含有什么酸?
2.汽车电瓶里含有什么酸?
3.食醋里含有什么酸?
胃液里含盐酸(HCl)
电瓶里含硫酸(H2SO4)
食醋里含醋酸(CH3COOH)
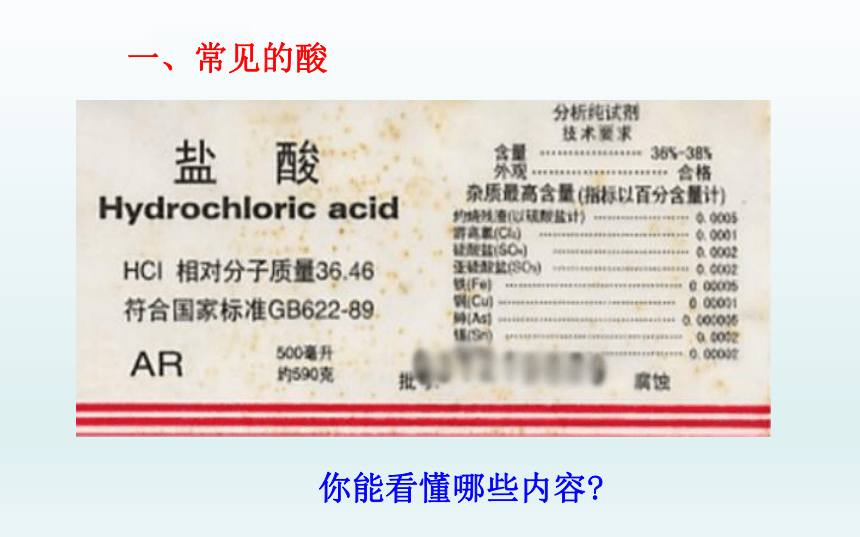
一、常见的酸
你能看懂哪些内容?
你能看懂哪些内容?
ph
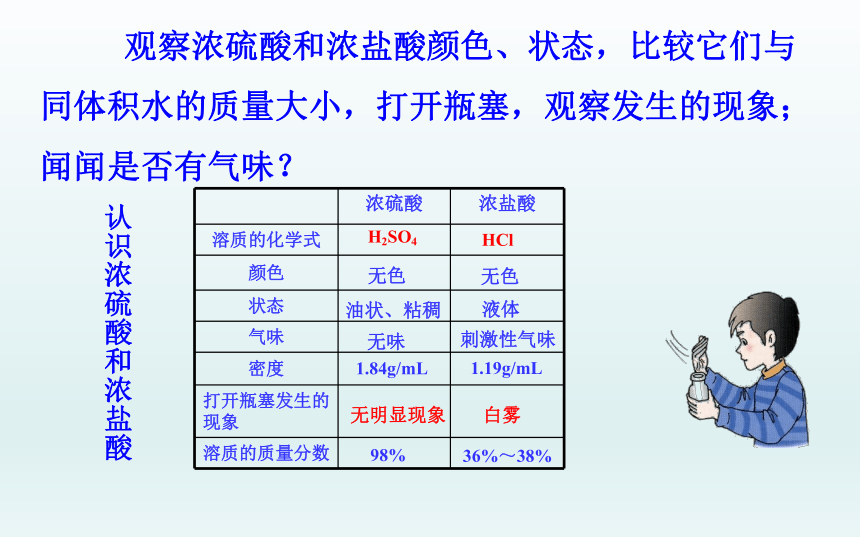
观察浓硫酸和浓盐酸颜色、状态,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻闻是否有气味?
认识浓硫酸和浓盐酸
无色
白雾
1.84g/mL
油状、粘稠
无味
刺激性气味
无明显现象
1.19g/mL
36%~38%
98%
无色
液体
H2SO4
HCl
浓硫酸 浓盐酸
溶质的化学式
颜色
状态
气味
密度
打开瓶塞发生的现象
溶质的质量分数
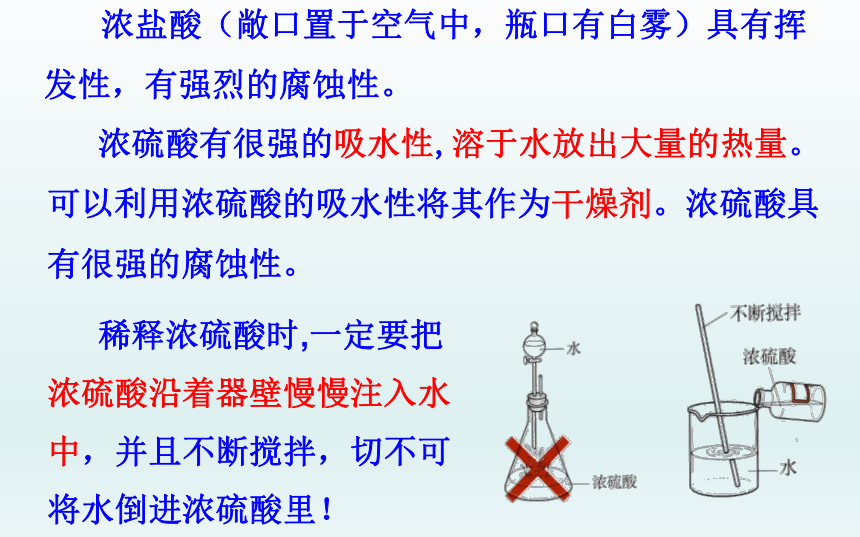
浓硫酸有很强的吸水性,溶于水放出大量的热量。可以利用浓硫酸的吸水性将其作为干燥剂。浓硫酸具有很强的腐蚀性。
浓盐酸(敞口置于空气中,瓶口有白雾)具有挥发性,有强烈的腐蚀性。
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,并且不断搅拌,切不可将水倒进浓硫酸里!
一、常见的酸
1.浓盐酸和浓硫酸的物理性质:
(1)浓盐酸(溶质化学式:HCl)
色、态:_________;气味:_____________;挥发性:___
(填“有”或“无”)。
无色液体
有刺激性气味
有
(2)浓硫酸(溶质化学式:H2SO4)
色、态:_____________________;气味:_____;
挥发性:___(填“有”或“无”)。
无色、黏稠、油状液体
无味
无
2.浓硫酸的安全使用:
(1)如果不慎将浓硫酸沾到皮肤上,应立即用大量的___
冲洗,然后涂上3%~5%的_________溶液,以防灼伤皮肤。
(2)稀释浓硫酸的方法
(如右图所示)。
水
碳酸氢钠
不断搅拌
浓硫酸
水
探究活动1:盐酸和石蕊试液、酚酞试液的作用
紫色石蕊试液变红
没有变化
实验探究——盐酸能与哪些物质发生化学反应
操作 取少量稀盐酸,
滴入石蕊试液 取少量稀盐酸,滴入酚酞试液
现象 ___________________________ ______________
盐酸和镁条、碳酸钠粉末、生锈铁钉、硝酸银溶液、氯化钡溶液的反应
产生大量气泡、放出热量
产生大量气泡
铁锈溶解,溶液由无色变为黄色,一段时间后有气泡产生
产生白色沉淀
无变化
探究活动2:
加入稀盐酸后的现象
镁条
碳酸钠粉末
生锈铁钉
硝酸银溶液
氯化钡溶液
AgNO3 + HCl === AgCl↓+ HNO3
有关反应的反应的化学方程式
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
Mg + 2HCl=== MgCl2 + H2↑
Fe2O3 + 6HCl === 2FeCl3 + 3H2O
盐
金属离子(或铵根离子)
盐:由__________________和________构成的化合物。
酸根离子
复分解反应:___________互相交换成分生成另外
___________的反应。
两种化合物
两种化合物
1、酸的通性:
(1)能使紫色石蕊试液_____;
(2)能与某些金属氧化物反应,生成_______;
(3)能与某些金属反应,生成_________;
(4)能与部分盐反应,生成_______________。
变红
盐和水
盐和氢气
新的酸和新的盐
自主学习,主干梳理
二、酸的化学性质
2.酸具有相似化学性质的原因。
酸溶液性质相似的原因是它们的溶液中都含有_______。
氢离子
硫酸能与BaCl2溶液反应,反应的化学方程式为
__________________________。
BaCl2+H2SO4====BaSO4↓+2HCl
不同的酸也有一些不同的化学性质,如:
而盐酸与BaCl2溶液不反应
自主学习,主干梳理
请结合所学过的知识,将图中酸的有关性质的反应规律在图中填写完整。
变红
不变色
盐+氢气
盐+水
【示范题1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
典题例析
(1)请你在编号②、③处各填入一种物质。
②是________;③是________。
(2)根据上图可以总结出稀硫酸的化学性质。请你写出编号①体现的稀硫酸的化学性质___________________。
(3)若编号④的物质是盐。请你写出符合编号④的一个化学方程式:_____________________________,
反应类型是_________。
铁
氧化铜
能使紫色石蕊试液变红
H2SO4+BaCl2====BaSO4↓+2HCl
复分解反应
【示范题2】(2016·泸州中考改编)醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明:除了3%~5%醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式_________________________________。
混合物
2∶1
CH3CH2OH+O2 CH3COOH+H2O
(3)某同学对白醋性质进行如下探究。
紫色石蕊试液
有气泡产生
二氧化碳
实验操作 实验现象 实验结论与解释
①向白醋中滴入______________ 观察到溶液变红 白醋显酸性
②向镁粉中滴加白醋直至过量 ________ 白醋能与活泼金属反应
③将白醋滴加到碳酸钙表面 有少量气泡产生 白醋能与碳酸钙反应,生成的气体是
(填名称)。
1.从物质的组成角度解释酸具有相似化学性质的原因是( )
A.酸都能在水中电离出H+ B.酸都含有酸根
C.酸中都含有氢气 D.酸中都含有氧元素
课堂练习
2.实验室常用浓硫酸做某些气体的干燥剂,这是利用浓硫酸的( )
A.腐蚀性 B.脱水性 C.吸水性 D.氧化性
A
C
3.保存或使用浓盐酸的合理方法是( )
A. 密封保存在阴凉处
B.用广口瓶存放浓盐酸
C. 浓盐酸可以做干燥剂
D. 把鼻孔凑到试剂瓶口闻浓盐酸的气味
4.若将浓盐酸和浓硫酸敞口放置在空气中一段时
间后,可以肯定的是( )
A.溶质质量都不变 B.溶剂质量都增大
C.溶液质量都不变 D.溶质质量分数都减小
A
D
5.盐酸或稀硫酸常用作金属表面的清洁剂,是利用
了它们化学性质中的( )
A.能与金属反应
B.能与某些盐反应
C.能与紫色石蕊试液反应
D.能与某些金属氧化物反应
D
今天我们学到了什么知识?掌握了什
么学习方法?明确了哪些道理?
盘点收获
第七单元 常见的酸和碱
第一节 酸及其性质
1.认识酸的化学性质,理解酸的化学性质实质是H+的性质。
2.初步认识复分解反应,会写常见的复分解反应的化学方程式。
3.认识几种重要的酸,掌握使用酸的方法。
4.通过对酸的性质的开放性探究活动,进一步发展科学探究能力。
生活中有些酸味的物质都含有一类特殊的化合物——酸;你已经知道哪些酸?了解它们的性质吗?它们在生产、生活中有哪些应用?
1.人的胃液里含有什么酸?
2.汽车电瓶里含有什么酸?
3.食醋里含有什么酸?
胃液里含盐酸(HCl)
电瓶里含硫酸(H2SO4)
食醋里含醋酸(CH3COOH)
一、常见的酸
你能看懂哪些内容?
你能看懂哪些内容?
ph
观察浓硫酸和浓盐酸颜色、状态,比较它们与同体积水的质量大小,打开瓶塞,观察发生的现象;闻闻是否有气味?
认识浓硫酸和浓盐酸
无色
白雾
1.84g/mL
油状、粘稠
无味
刺激性气味
无明显现象
1.19g/mL
36%~38%
98%
无色
液体
H2SO4
HCl
浓硫酸 浓盐酸
溶质的化学式
颜色
状态
气味
密度
打开瓶塞发生的现象
溶质的质量分数
浓硫酸有很强的吸水性,溶于水放出大量的热量。可以利用浓硫酸的吸水性将其作为干燥剂。浓硫酸具有很强的腐蚀性。
浓盐酸(敞口置于空气中,瓶口有白雾)具有挥发性,有强烈的腐蚀性。
稀释浓硫酸时,一定要把浓硫酸沿着器壁慢慢注入水中,并且不断搅拌,切不可将水倒进浓硫酸里!
一、常见的酸
1.浓盐酸和浓硫酸的物理性质:
(1)浓盐酸(溶质化学式:HCl)
色、态:_________;气味:_____________;挥发性:___
(填“有”或“无”)。
无色液体
有刺激性气味
有
(2)浓硫酸(溶质化学式:H2SO4)
色、态:_____________________;气味:_____;
挥发性:___(填“有”或“无”)。
无色、黏稠、油状液体
无味
无
2.浓硫酸的安全使用:
(1)如果不慎将浓硫酸沾到皮肤上,应立即用大量的___
冲洗,然后涂上3%~5%的_________溶液,以防灼伤皮肤。
(2)稀释浓硫酸的方法
(如右图所示)。
水
碳酸氢钠
不断搅拌
浓硫酸
水
探究活动1:盐酸和石蕊试液、酚酞试液的作用
紫色石蕊试液变红
没有变化
实验探究——盐酸能与哪些物质发生化学反应
操作 取少量稀盐酸,
滴入石蕊试液 取少量稀盐酸,滴入酚酞试液
现象 ___________________________ ______________
盐酸和镁条、碳酸钠粉末、生锈铁钉、硝酸银溶液、氯化钡溶液的反应
产生大量气泡、放出热量
产生大量气泡
铁锈溶解,溶液由无色变为黄色,一段时间后有气泡产生
产生白色沉淀
无变化
探究活动2:
加入稀盐酸后的现象
镁条
碳酸钠粉末
生锈铁钉
硝酸银溶液
氯化钡溶液
AgNO3 + HCl === AgCl↓+ HNO3
有关反应的反应的化学方程式
Na2CO3 + 2HCl === 2NaCl + CO2↑+ H2O
Mg + 2HCl=== MgCl2 + H2↑
Fe2O3 + 6HCl === 2FeCl3 + 3H2O
盐
金属离子(或铵根离子)
盐:由__________________和________构成的化合物。
酸根离子
复分解反应:___________互相交换成分生成另外
___________的反应。
两种化合物
两种化合物
1、酸的通性:
(1)能使紫色石蕊试液_____;
(2)能与某些金属氧化物反应,生成_______;
(3)能与某些金属反应,生成_________;
(4)能与部分盐反应,生成_______________。
变红
盐和水
盐和氢气
新的酸和新的盐
自主学习,主干梳理
二、酸的化学性质
2.酸具有相似化学性质的原因。
酸溶液性质相似的原因是它们的溶液中都含有_______。
氢离子
硫酸能与BaCl2溶液反应,反应的化学方程式为
__________________________。
BaCl2+H2SO4====BaSO4↓+2HCl
不同的酸也有一些不同的化学性质,如:
而盐酸与BaCl2溶液不反应
自主学习,主干梳理
请结合所学过的知识,将图中酸的有关性质的反应规律在图中填写完整。
变红
不变色
盐+氢气
盐+水
【示范题1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应的颜色变化。
典题例析
(1)请你在编号②、③处各填入一种物质。
②是________;③是________。
(2)根据上图可以总结出稀硫酸的化学性质。请你写出编号①体现的稀硫酸的化学性质___________________。
(3)若编号④的物质是盐。请你写出符合编号④的一个化学方程式:_____________________________,
反应类型是_________。
铁
氧化铜
能使紫色石蕊试液变红
H2SO4+BaCl2====BaSO4↓+2HCl
复分解反应
【示范题2】(2016·泸州中考改编)醋是中国传统的调味品,市场上售卖的某一品牌白醋,标签说明:除了3%~5%醋酸(CH3COOH)和水之外不含或极少含其他成分,请回答相应问题。
(1)白醋是________(填“纯净物”或“混合物”),醋酸分子中氢、氧原子个数比为________。
(2)酿醋原理是在醋酸菌作用下乙醇(CH3CH2OH)与氧气反应,除生成醋酸外,还有另一产物,请写出该反应的化学方程式_________________________________。
混合物
2∶1
CH3CH2OH+O2 CH3COOH+H2O
(3)某同学对白醋性质进行如下探究。
紫色石蕊试液
有气泡产生
二氧化碳
实验操作 实验现象 实验结论与解释
①向白醋中滴入______________ 观察到溶液变红 白醋显酸性
②向镁粉中滴加白醋直至过量 ________ 白醋能与活泼金属反应
③将白醋滴加到碳酸钙表面 有少量气泡产生 白醋能与碳酸钙反应,生成的气体是
(填名称)。
1.从物质的组成角度解释酸具有相似化学性质的原因是( )
A.酸都能在水中电离出H+ B.酸都含有酸根
C.酸中都含有氢气 D.酸中都含有氧元素
课堂练习
2.实验室常用浓硫酸做某些气体的干燥剂,这是利用浓硫酸的( )
A.腐蚀性 B.脱水性 C.吸水性 D.氧化性
A
C
3.保存或使用浓盐酸的合理方法是( )
A. 密封保存在阴凉处
B.用广口瓶存放浓盐酸
C. 浓盐酸可以做干燥剂
D. 把鼻孔凑到试剂瓶口闻浓盐酸的气味
4.若将浓盐酸和浓硫酸敞口放置在空气中一段时
间后,可以肯定的是( )
A.溶质质量都不变 B.溶剂质量都增大
C.溶液质量都不变 D.溶质质量分数都减小
A
D
5.盐酸或稀硫酸常用作金属表面的清洁剂,是利用
了它们化学性质中的( )
A.能与金属反应
B.能与某些盐反应
C.能与紫色石蕊试液反应
D.能与某些金属氧化物反应
D
今天我们学到了什么知识?掌握了什
么学习方法?明确了哪些道理?
盘点收获
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
